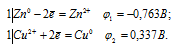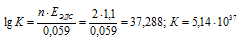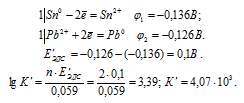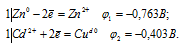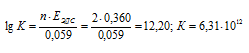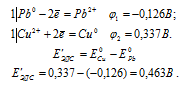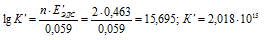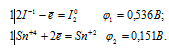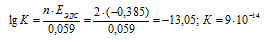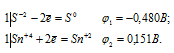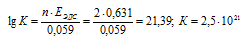Вычисление константы равновесия химических реакций
Задача 675.
Пользуясь таблицей стандартных электродных потенциалов, вычислить константы равновесия следующих реакций:
а) Zn + CuSO4 = Cu + ZnSO4;
б) Sn + Pb(CH3COO)2 = Sn(CH3COO)2+ Pb.
Решение:
а) Zn + CuSO4 = Cu + ZnSO4
Составляем уравнения электронного баланса:
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
EЭДС = E(Cu 0 ) — E(Zn 0 ) = 0,337 — (-0,763) = 1,1B.
Здесь n – число электронов, принимающих участие в процессе.
Ответ: а) 5,14 . 10 37 ; б) 3,07 . 10 3 .
Задача 676.
Вычислить константы равновесия реакций, протекающих
а) в кадмиево-цинковом гальваническом элементе; 6) в медно-свинцовом гальваническом элементе.
Решение:
а) Составляем уравнения электронного баланса:
Для определения ЭДС гальванического элемента необходимо из потенциала катода вы-честь потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
EЭДС = E(Cd 0 ) — E(Zn 0 ) = -0,403 — (-0,763) = 0,360B.
Ответ: а) 6,12 . 10 31 ; б) 2,018 . 10 15 .
Задача 677.
Можно ли восстановить олово (IV) в олово (II) с помощью следующих реакций:
а) SnCl4 + 2KI = SnCl2 + 2KCl;
б) SnCl4+ 2H2S = SnCl2 + S + 2HCl.
Ответ обосновать расчетом констант равновесия реакций.
Решение:
а) SnCl4 + 2KI = SnCl2 + 2KC
Составляем уравнения электронного баланса:
Для определения ЭДС гальванического элемента необходимо из потенциала катода вы-честь потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
EЭДС = E(Sn 0 ) — E(I2 0 ) = 0,151 — 0,536 = -0,385B.
Вывод:
Так как константа равновесия реакции К
Для определения ЭДС гальванического элемента необходимо из потенциала катода вы-честь потенциал анода, т. е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
EЭДС = E(Sn 0 ) — E(S) = 0,151 — (-o,481) = 0,631B.
Вывод: Так как константа равновесия реакции K > 0, то процесс протекает самопроизвольно при нормальных условиях.
Ответ: а) нельзя, К = 9 . 10 -14 ; б) можно, К = 2,5 . 10 21 .
Написать уравнения ступенчатого гидролиза ацетата свинца Pb(CH3COO)2
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Ацетат меди (II)
| Ацетат меди (II) | |
|---|---|
| Систематическое наименование | Ацетат меди (II) |
| Традиционные названия | Уксуснокислая медь |
| Хим. формула | C4H6CuO4 и Cu2(CH3CO2)4(H2O)2 |
| Рац. формула | (CH3COO)2Cu |
| Состояние | твёрдое |
| Молярная масса | 181.65(безводный) 199.67(моногидрат) г/моль |
| Плотность | 1.882 г/см³ |
| Температура | |
| • плавления | 115 °C |
| • кипения | 240 °C |
| • разложения | 290 °C |
| Растворимость | |
| • в воде | 7.2\20(холодная\горячая вода) |
| • в этаноле | растворим |
| • в ацетоне | малорастворим (0.28г на 100г при 15°С) |
| Рег. номер CAS | 142-71-2 |
| PubChem | 8895 |
| Рег. номер EINECS | 205-553-3 |
| SMILES | |
| ChemSpider | 8555 и 21169880 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат меди (II) (ярь-медянка; (CH3COO)2Cu) — сложное химическое соединение, медная соль уксусной кислоты.
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 3.1 Диссоциация
- 3.2 Реакции обмена
- 3.3 Реакции замещения
- 4 Применение
- 6 Фото
Физические свойства
Ацетат меди (II) представляет собой тёмно-сине-зелёные кристаллы моноклинной сингонии, растворимые в воде (7,1 г/100г воды), растворим также в спиртах, эфире.
Ацетат меди не горит, но окрашивает пламя в нежно-салатовый цвет.
Получение
Ацетат меди (II) получают взаимодействием гидроксида меди (II) c уксусной кислотой:
Карбоната меди(II) c уксусной кислотой:
Так же можно получить смешиванием сульфата меди (II) c гидрокарбонатом натрия, и затем, после промывания осадка основного карбоната меди от сульфата натрия, добавить уксусной кислоты:
Практически получается и растворением опилок металлической меди в уксусной эссенции при доступе кислорода воздуха. Процесс происходит медленно и на дне ёмкости по мере реакции вырастают крупные ровные кристаллы:
Химические свойства
Диссоциация
Как и все растворимые соли, ацетат меди в водных растворах диссоциирует.
Реакции обмена
Ацетат меди реагирует с сильными основаниями с образованием студенистого голубого осадка гидроксида меди (II) и соответствующей соли-ацетата.
Реакции замещения
Ацетат меди реагирует с металлами, стоящими левее меди в электрохимическом ряду активности металлов.
Применение
Моногидрат ацетата меди (II) (CH3COO)2Cu·H2O — фунгицид, пигмент для керамики, реагент для обнаружения углеводов и селективно — глюкозы, катализатор полимеризации (стирола и др.), стабилизатор искусственных волокон.
Кристаллы ацетата меди (II) на медной проволоке
Водный раствор ацетата меди (II)
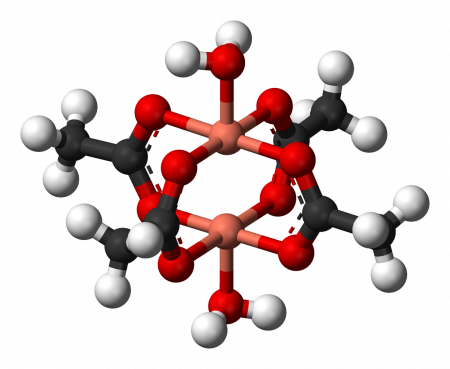
Молекулярная структура дигидрата тетраацетата димеди(II)
http://www.soloby.ru/1095451/%D0%BD%D0%B0%D0%BF%D0%B8%D1%81%D0%B0%D1%82%D1%8C-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D1%81%D1%82%D1%83%D0%BF%D0%B5%D0%BD%D1%87%D0%B0%D1%82%D0%BE%D0%B3%D0%BE-%D0%B3%D0%B8%D0%B4%D1%80%D0%BE%D0%BB%D0%B8%D0%B7%D0%B0-%D0%B0%D1%86%D0%B5%D1%82%D0%B0%D1%82%D0%B0-%D1%81%D0%B2%D0%B8%D0%BD%D1%86%D0%B0
http://chem.ru/acetat-medi-ii.html