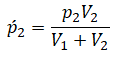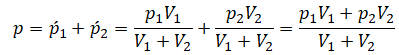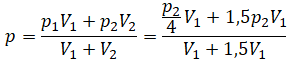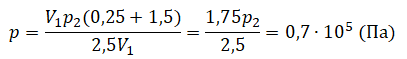Закон Дальтона
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Давление смеси газов равно сумме их парциальных давлений.
К примеру, давление воздуха складывается из давления азота, кислорода, углекислого газа, водяного пара и т. д.
Парциальное давление — давление, которое производил бы данный газ, если бы другие газы отсутствовали.
Применение закона Дальтона при решении задач
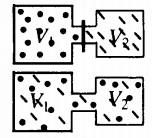
Самая популярная задача на закон Дальтона, это случай, когда газы находятся в сосудах, соединенных трубкой с краном. По условию этой задачи нужно найти давление, которое установится после того, как этот кран будет открыт.
После открытия крана первый и второй газы заполнят оба сосуда. Используем закон Бойля — Мариотта для первого газа (так как температура остается постоянной):
Этот же закон можем применить для второго газа. Тогда мы получим:
Применим закон Дальтона и получим:
Пример №1. Два сосуда соединены трубкой с краном. Определить давление, которое установится после того, как кран будет открыт. Считать, что объем второго сосуда в 1,5 раза больше первого. Давление во втором сосуде составляет половину от атмосферного давления. В первом сосуде оно меньше в 4 раза.
Проанализируем условия задачи и запишем:
Теперь можем применить выведенную ранее формулу:
Преобразуем выражение и найдем установившееся давление:
Алгоритм решения
Решение
Запишем исходные данные:
После того, как открыли кран между 2 и 3 сосудом, объем возрос вдвое, и давление распределилось по нему равномерно. Согласно закону Дальтона, оно стало равным сумме давлений, оказываемых газами в количестве вещества ν2 и ν3. Так как объем после открытия крана увеличивается вдвое, то парциальное давление каждого из количества вещества равно половине исходного давления:
p 23 = p 2 . . + 3 p 2 . . = 2 p
Потом кран 2–3 закрыли, но открыли кран 1–2. Применим закон Дальтона, получим:
p 12 = 2 p 2 . . + p 2 . . = 3 p 2 . .
Теперь применим закон Менделеева — Клапейрона:
Для начального состояния газа в 1 сосуде:
Для конечного состояния газа в 1 сосуде:
3 p 2 . . V = ν 2 R T
Так как температура и объем неизменны, но давление увеличилось в 1,5 раза, то и количество газа в первом сосуде увеличилось в 1,5 раза.
pазбирался: Алиса Никитина | обсудить разбор | оценить

Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
Решение
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева — Клапейрона:
Из уравнения видно, что давление и количество вещества — прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Физика. 10 класс
Конспект урока
Физика, 10 класс
Урок 20. Уравнение состояния идеального газа. Газовые законы
Перечень вопросов, рассматриваемых на уроке:
1) уравнение состояния идеального газа и уравнение Менделеева — Клапейрона;
2) закон Дальтона, парциальное давление, закон Авогадро;
3) газовые законы и границы их применимости;
4) графики изохорного, изобарного и изотермического процесса;
5) определение по графикам характера процессов и макропараметров идеального газа;
6) применение модели идеального газа для описания поведения реальных газов.
Глоссарий по теме
Уравнение, связывающее три макроскопических параметра давление, объём и температура, называют уравнением состояния идеального газа.
Парциальное давление – давление отдельно взятого компонента газовой смеси, равно давлению, которое он будет оказывать, если занимает весь объем при той же температуре.
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессами).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении называют изобарным.
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Основная и дополнительная литература по теме урока:
Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика. 10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 209 – 218.
Рымкевич А.П. Сборник задач по физике. 10-11 класс. — М.: Дрофа, 2009.
Открытые электронные ресурсы по теме урока:
Теоретический материал для самостоятельного изучения
Уравнение Клапейрона при m = const: отношение произведения давления и объёма к температуре есть величина постоянная для постоянной массы газа:
Если изменяется какой-либо макроскопический параметр газа постоянной массы, то два других параметра изменятся таким образом, чтобы указанное соотношение осталось постоянным.
Отношение произведения давления и объёма к температуре равно универсальной газовой постоянной для одного моля идеального газа.
Уравнение Менделеева при v = 1 моль
Произведение постоянной Больцмана и постоянной Авогадро называется универсальной газовой постоянной.

Уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона».
Давление смеси химически невзаимодействующих газов равно сумме их парциальных давлений: закон Дальтона.
где pi– парциальное давление i-й компоненты смеси.
Парциальное давление – давление отдельно взятого компонента газовой смеси, равное давлению, которое он будет оказывать, если занимает весь объём при той же температуре.
Один моль любого газа при нормальных условиях занимает один и тот же объём равный:
V0=0,0224м 3 /моль=22,4дм 3 /моль.
Это утверждение называется законом Авогадро
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессами).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Для газа данной массы произведение давления на объём постоянна, если температура газа не меняется — закон Бойля – Мариотта.
Изотерма соответствующая более высокой температуре T1, лежит на графике выше изотермы, соответствующей более низкой температуре T2.
Если значения давления и температуры в различных точках объёма разные, то в этом случае газ находится в неравновесном состоянии.
Равновесное состояние — это состояние, при котором температура и давление во всех точках объёма одинаковы.
Процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении называют изобарным.
Для газа данной массы отношение объема к температуре постоянно, если давление не изменяется — закон Гей-Люссака.
Изобара соответствующая более высокому давлению p2 лежит на графике ниже изобары соответствующей более низкому давлению p1.
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
При данной массе газа отношение давление газа к температуре постоянно, если объем газа не изменяется — закон Шарля.
Изохора соответствующая большему объему V2 лежит ниже изохоры, соответствующей меньшему объему V1.
Примеры и разбор решения заданий
1. Установите соответствие между физическими величинами и приборами для их измерения. К каждой позиции первого столбца подберите нужную позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
Закон Дальтона
В природе и в технике мы очень часто имеем дело не только с одним чистым газом, но со смесью нескольких газов. Например воздух, это смесь азота, кислорода, аргона, углекислого газа и других газов. От чего зависит давление смеси газов?
В 1801 г. Джон Дальтон установил, что давление смеси нескольких газов равно сумме парциальных давлений всех газов, составляющих смесь.
Этот закон получил название закона парциальных давлений газов
Закон Дальтона Парциальное давление каждого газа, входящего в состав смеси, это давление, которое создавалось бы той же массой данного газа, если он будет занимать весь объем смеси при той же температуре.
Закон Дальтона устанавливает, что давление смеси (идеальных) газов составляет сумму парциальных давлений компонент смеси (парциальное давление компоненты – это давление, которое компонента оказала бы, если бы она одна занимала все пространство, занятое смесью). Этот закон указывает, что на каждую компоненту не воздействует присутствие других компонент и свойства компоненты в смеси не меняются.
Два закона Дальтона
Закон 1 Давление смеси газов равно сумме их парциальных давлений. Из этого следует, что парциальное давление компонента газовой смеси равно произведению давления смеси на молярную долю этого компонента.
Закон 2 Растворимость компонента газовой смеси в данной жидкости при постоянной температуре пропорциональна парциальному давлению этого компонента и не зависит от давления смеси и природы других компонентов.
Законы сформулированы Дж. Дальтоном соотв. в 1801 и 1803.
Уравнение закона Дальтона
Как уже отмечалось, отдельные компоненты смеси газов считаются независимыми. Поэтому каждая компонента создает давление:
\[ p = p_i k T \quad \left(1\right), \]
а полное давление равно сумме давлений компонент:
\[ p = p_ <01>k T + p_ <02>k T + \cdots + p_ k T = p_ <01>+ p_ <02>+ \cdots + p_ \quad \left(2\right),\]
где \( p_i \) — парциальное давление i газовой компоненты. Это уравнение — закон Дальтона.
При больших концентрациях, больших давлениях закон Дальтона не выполняется в точности. Так как проявляется взаимодействие между компонентами смеси. Компоненты перестают быть независимыми. Дальтон объяснил свой закон с помощью атомистической гипотезы.
Пусть имеется i компонент в смеси газов, тогда уравнение Менделеева — Клайперона будет иметь вид:
где \( m_i \) — массы компонент смеси газа, \( <\mu >_i \) — молярные массы компонент смеси газа.
Если ввести \( \left\langle \mu \right\rangle \) такую, что:
то уравнение (3) запишем в виде:
Закон Дальтона можно записать в виде:
Следствием закона Дальтона можно считать следующее выражение:
\[ p_i=x_ip\ \quad \left(7\right), \]
где \( x_i-молярная\ концентрация\ i-го \) газа в смеси, при этом:
где \( <\nu >_i \) — количество молей \( i-го \) газа в смеси.
http://resh.edu.ru/subject/lesson/6292/conspect/
http://calcsbox.com/post/zakon-daltona.html