Способы критериального описания химико-технологических процессов нефтехимического синтеза, моделирование технологических объектов на их основе
Критериальное уравнение включает в себя целый ряд критериев и симплексов подобия. Обычно различают кинетические, диффузионные, тепловые и гидродинамические критерии подобия.
Кинетические критерии включают в основном три критерия:
ü критерий Дамкелера, характеризующий отношение скорости химической реакции к изменению концентрации основного исходного вещества по высоте (длине) реактора
Dа = 
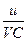
ü критерий Маргулиса, характеризует отношение скорости процесса к скорости реакционного потока
Ма = 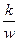
где k – константа скорости реакции;
ü критерий Аррениуса является кинетическим критерием, учитывающим влияние соотношения энергии активации и температуры на скорость химической реакции
Arn = 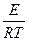
Диффузионные критерии описывают явления массопереноса в системе.
ü Диффузионный критерий Пекле, характеризующий отношение скорости потока к приведенной скорости молекулярной диффузии, обычно записывается в виде
РеД = 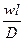
где l – характерный линейный размер (например, высота или радиус реактора).
ü Диффузионный критерий Прандтля характеризует отношение вязкостных свойств и диффузионной способности системы
PrД = 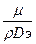
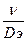
ü Критерий Нуссельта, характеризующий меру отношения скорости процесса к приведенной скорости молекулярной диффузии, записывают в виде
NuД = 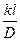
Гидродинамические критерии подобия
ü Критерий Рейнольдса характеризует соотношение сил инерции и сил трения
Re = 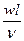
где w- скорость, l – определяющий линейный размер, 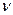
ü Критерий Архимеда, характеризующий соотношение сил тяжести, подъемной силы и сил трения
Ar = 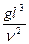
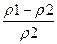
ü Критерий Фруда
Fr = 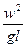
ü Критерий Эйлера
Eu = 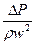
Тепловыми критериями подобия являются
ü Критерий Нуссельта
Nur = 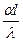
ü Критерий Прандтля
РrТ = 
При решении критериального уравнения, обычно в качестве определяемого выбирается один из кинетических критериев подобия. Теория подобия позволяет уравнения (11.1) представить в виде зависимости определяемого (кинетического) критерия (допустим, Маргулиса) от определяющих критериев и симплексов подобия, например, в виде
Ма= А · Re n ·Arn m ·Pr 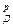
где А – постоянная, характеризующая природу процесса.
Уравнение (11.15) устанавливает влияние гидродинамической обстановки процесса (Re); температуры и активности катализатора (Arn); диффузионных этапов (PrД) на скорость изучаемого (моделируемого) процесса; Г- некоторый геометрический симплекс, например отношение высоты аппарата Н к его диаметру D, который характеризует влияние этих параметров на скорость превращения; S- некоторый концентрированный симплекс, равный, например отношению действительной и равновесной концентрации реагирующих веществ.
Эксперимент проводится для определения показателей степеней и коэффициента А в уравнении (11.15), для чего последовательно решают частные уравнения типа Ma = f1(Re); Ma = f2(Arn) и т.д. Далее устанавливается точность, с которой можно пользоваться полученным уравнением, а также пределы его применимости по отдельным параметрам, входящим в уравнение (11.15).
Варианты соединения аппаратов и передаточные функции
Все блоки, входящие в технологическую схему, можно разделить на два типа: блоки разомкнутых и блоки рециркуляционных последовательностей. Процесс исследования любой технологической схемы включает следующие операции:
— определение разомкнутых и рециркуляционных последовательностей и расположение их в удобном для вычисления виде;
— нахождение методики расчета каждой рециркуляциооной последовательности.
Различают структурные схемы последовательного, параллельного соединений и схемы с обратной связью.
Объекты химической технологии, состоящие из элементов, соединенных между собой различными способами, т.е. имеющие соответствующие структурные схемы, могут быть описаны статистическими и динамическими характеристиками, представляющими собой взаимосвязь между входными и выходными параметрами. Во многих случаях математическое описание объекта химической реакции имеет вид дифференциальных уравнений, устанавливающих связь между основными переменными процесса. Однако решение дифференциальных уравнений усложняется с повышением их порядка и зависит от вида производных.
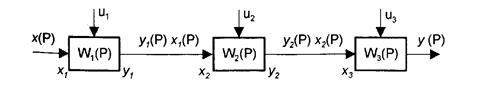
v Последовательное соединение элементов.
В этом случае технологические звенья (элементы) соединены таким образом, что выход предыдущего является входом последующего звена. И между ними существует следующая зависимость:
где х0 и у0 – общий вход и общий выход последовательной цепочки.
Примером такой связи может служить последовательное соединение нескольких реакторов: участками производства являются отдельные реакторы, технологическими связями – векторные величины, составляющими которых служат нагрузки реакторов, а также концентрации целевых и побочных продуктов. Управляющими воздействиями могут быть, например, температура, давление и др.
Такие технологические связи широко представлены в непрерывных химических производствах, так как при переходе от периодического процесса к непрерывному последовательность технологических операций во времени заменяется последовательностью технологических аппаратов в пространстве.
Передаточная функция W(P) двух последовательно соединенными элементами может быть записана так:
Для n последовательно соединенных элементов:
Рисунок 11.1 Последовательное соединение элементов
Таким образом, передаточная функция последовательно соединенных элементов равна произведению их передаточных функций.
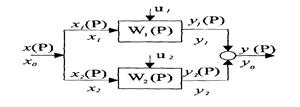
v Параллельное соединение элементов.
Технологические схемы, представляющие параллельную структуру, имеют объединенные входы и выходы.
В этом случае общий вход равен сумме входов отдельных звеньев, общий выход – сумме выходов:
х0 = 
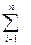
Примером параллельной технологической связи может служить группа параллельно работающих реакторов, полимеризаторов, теплообменников и т.д.
Передаточная функция такой цепочки W(P) имеет вид:
Следовательно, для n параллельных элементов передаточная функция будет иметь вид:
т.е. передаточная функция дляn параллельно соединенных элементов равна сумме их передаточных функций.
Рисунок 11.2 Параллельное соединение элементов
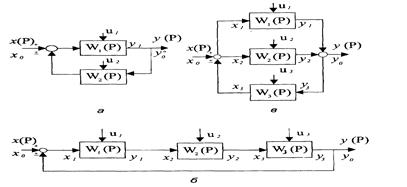
v Соединение элементов по схеме с обратной связью.
Характерной особенностью системы с обратной связью (рециклом) является то, что часть продукта с выходом, например, из последнего звена поступает на вход первого (а). Если х0 – общий вход системы, а у0 – ее выход, то уравнение обратной связи для (б) имеет вид:
х1 = х0 + 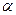
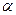
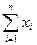
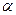
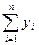
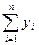
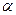
Величина 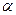
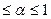
Рисунок 11.3 Соединение элементов по схеме с обратной связью
В соответствии с рисунком 11.3 значения передаточных функций могут быть выражены следующим образом:
х1(Р) = х(Р) + у(Р) – при положительной обратной связи (обратное воздействие усиливает процесс); х1(Р) = х(Р) – у1(Р) – при отрицательной обратной связи (обратное воздействие замедляет процесс).
При решении системы уравнений 11.24 в случае положительной обратной связи (а) получаем следующее выражение для передаточной функции:
а для отрицательной обратной связи:
Структурные схемы в качестве наглядных образцов проектируемых комплексных систем, отображающих различные технологические объекты, используют давно. Применение структурных схем позволяет наглядно представлять причинные отношения между входом и выходом каждого элемента системы, а также взаимосвязь между ними.
Каждый блок структурной схемы имеет свою передаточную функцию. Как правило, блоки структурных схем являются многопараметрическими и имеют более одного входа и выхода, связанных между собой векторно-матричными уравнениями.
Дата добавления: 2017-11-04 ; просмотров: 353 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Курс лекций Б3.Б.5 Общая химическая технология ( ) Химическая технология
- Валерия Скрипицина 4 лет назад Просмотров:
1 Курс лекций Б3.Б.5 Общая химическая технология 8.3. (4.6) Химическая технология ВВЕДЕНИЕ Химическая технология это область химических наук, которая изучает процессы изменения состава и внутренней структуры вещества, осуществляемые путем химической реакции. Эта наука изучает методы и средства оптимальной переработки химического сырья в предметы потребления и средства производства. В отличии от других химических наук она собрала в себе все науки, но частично. Методы — это изучение самой химической реакции, лежащей в основе производства. Средства — это аппаратура, на которой осуществляется производство. Химическое производство состоит из следующих стадий:. подготовка сырья;. химико технологический процесс; 3. выделение целевого продукта; 4. очистка выбросов. Целевой продукт () — продукт, ради которого осуществляется данная химическая технология. Побочный продукт (S) продукт, образующийся наряду с целевым, который образуется в ходе параллельной реакции химической технологии. Все эти стадии осуществляются типовыми процессами. Группы типовых процессов: ) механические (дробление, классификация, грохочение). Используется на стадии подготовки сырья; ) гидродинамические (процессы движение жидкостей и газов по трубопроводам и аппаратам, процессы разделения жидкостей — адсорбция, адсорбция, осаждение, фильтрация, циклоны, кипящий слой). Их особенность состоит в том, что они основаны на одной и той же теоретической базе. Используется на всех стадиях химического производства. Закон Ньютона: dw dx Движущая сила процесса — скорость 3) тепловые (нагревание и охлаждение материальный потоков, сушка, выпаривание).! Основную роль играет на стадии выделении целевого продукта, а побочную роль на всех остальных. Закон Фурье: dt q dx Формула Движущая сила процесса — время
2 4) массообменные или диффузионные процессы (абсорбция, десорбция, адсорбция, сушка, ректификация, кристаллизация)!используются на стадии выделения целевого продукта и очистке выбросов. Закон Фика: M D d d dx Движущая сила процесса — разность концентраций 5) химические (связаны с осуществлением самой химической реакции).используется на стадиях химико-технологического процесса и очистке выбросов. Скорость химической реакции: W xp À Для всех законов и процессов нужно знать:. кинетику физических процессов;. для получения конечного результата нужно знать как рассчитываются: а) основные размеры для типовых процессов механических, гидродинамических, тепловых, массообменных; б) химические дисциплины для химических процессов. Порядок проектирования нового химического производства состоит:. синтез нового продукта в лабораторных условиях;. микрокинетика данной химической реакции, которая изучается в лабораторных условиях и включает в себя: а) определение маршрутов химической реакции; б) определение констант химической реакции; в) определение порядка химической реакции. Все эти стадии изучаются в «чистом» виде, вне влияния тепловых и диффузионных процессов. 3. изучение макрокинетики (изучается на укрупненных опытных или промышленных установках), для того, чтобы определить влияние на химическую кинетику условий организации движения потоков, их перемешивания, а также сопутствующих тепловых и диффузионных параметров. Макрокинетика начинается с выбора типа аппарата и его математической модели. Эта часть исследований ведется с учетом данных микрокинетики. Конечной целью этой стадии является составление полной математической модели химического реактора, позволяющей получить представления о воз-
3 можных вариантах течения процесса, выявить максимально выгодный режим и сформулировать четкие условия по его удержанию в ходе процесса. Изучение макрокинетики и микрокинетики процессов позволяют рассчитать размеры аппаратов, реакторов, определиться с последовательностью осуществления процесса и спроектировать технологическую схему производства. Классификация химических производств:. высокотемпературные — например, металлургическое и коксохимическое производство при температуре более С;. электрохимические — получение водорода; 3. каталитические; 4. химические производства, идущие под повышенным или под пониженным давлением. Эти производства, в основе которых лежат газовые химические реакции. Например, синтез аммиака. 5. биохимические производства — например, процесс брожения; 6. фотохимические производства, в основе которых лежат реакции, осуществляемые при отсутствии света или его наличии. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИКО- ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА. Химико-технологические процесс (ХТП). Понятия о ХТП, и его содержании. ХТП это комплекс физических и химических явлений, которые приводят к коренному изменению химического состава, свойств и внутреннего строения вещества. В общем случае различают три типовых стадии ХТП: А А 3 стадия: происходит подвод химических реагентов в зону химической реакции, эта физическая стадия ХТП, как правило, она имеет место быть в случае гетерогенных химических реакций. И ее можно осуществить следующими способами: адсорбцией, абсорбцией, конденсацией, испарением, т.е. с помощью диффузионных процессов. стадия: собственно сама химическая реакция, конечным результатом которой является образование целевого и побочных продуктов. 3 стадия: отвод продуктов из зоны реакции, это физическая стадия. Скорость химико-технологического процесса в целом складывается из скоростей стадий, и лимитируется наиболее медленной из них. Если процесс лимитируется и 3 стадиями — это означает, что процесс происходит в диффузионной области и эти стадии обязательно присутствуют в гетерогенных процессах. Если процесс лимитируется стадией, то процесс происходит в S
4 кинетической области, это характерно в основном для гомогенных реакций, где отсутствуют диффузионные процессы. Скорость всего процесса ХТП будет определятся законом химической кинетики. Чтобы увеличить скорость ХТП и 3 стадии нужно:. увеличить концентрацию в ядре потока;. турбулизация потока, перемешивание. Чтобы увеличить скорость ХТП стадии нужно:. необходимо иметь высокую концентрацию реагентов;. изменить коэффициент химической реакции, т.е. увеличить температуру и энергию активации, т.е. для этого необходимо использовать катализатор. Ускорение химической реакции может существенно зависеть от типа самой реакции:. по степени происхождения химической реакции: а) прямая и обратная; б) обратимая и необратимая.. по фазовому состоянию реагентов и продуктов: а) гомогенные; б) гетерогенные. 3. по тепловому эффекту реакции: а) экзотермические, т.е. с выделением тепла; б) эндотермические, т.е. с поглощением тепла. 4. по механизму химической реакции: а) простые; б) сложные. 5. по порядку химической реакции: а) нулевого, W ; б) первого, W ; в) второго, W. Порядок химической реакции это сумма показателей степеней в кинетическом уравнении. Если реакция идет в несколько стадий, то порядок может быть дробным. 6. по использованию специальных веществ: а) каталитические; б) некаталитические. Помимо типа реакции на скорость химической реакции влияет и аппарат оформления химической реакции:. по гидродинамическому режиму осуществления различают реакторы смешения и вытеснения;. по способу осуществления процесса во времени различают реакторы периодического, непрерывного и 999; 3. по тепловому режиму осуществления процесса: а) изотермический при t const ; б) адиабатический при Q const ; в) полибермический.999
5 Основные технологические понятия. Производительность количество выработанного продукта или переработанного сырья в единицу времени (П). Максимальное П называется мощностью Формула Интенсивность П отнесенная к какой-то геометрической характеристике реактора (I): I Vp( F). Расходный коэффициент (по сырью, по электроэнергии, по воде и т.д.) это количество всего этого, отнесенное к единице целевого продукта. В расходный коэффициент входят все затраты. Все вышеперечисленные показатели характеризуют экономическую эффективность. Они не затрагивают физико-химическую сущность явлений, происходящих в аппаратах. Степень превращения доля исходного реагента, пошедшего на химическую реакцию. Степень превращения характеризует насколько полно в химической реакции используется химический реагент (х). Необратимая химическая реакция: a b ss r. Моль количество граммов вещества равное его молекулярной массе. Например, моль Н О равен 8 граммам. x N N N ; x N N N где: N и N число молей исходного реагента, взятого на осуществление реакции; N и N — число молей исходного реагента, оставшихся после химической реакции. Степень превращения может быть рассчитана по любому из исходных реагентов: N N N r ( ), a N N N r ( ), b Выводы: r N x N x a N a x x. N b r b,
6 . если реагенты взяты в стехиометрических количествах, то х А =х В ;. если реагент В для проведения химической реакции взят в избытке, то х А х В =. Обратимая химическая реакция: a b ss r. Для такой реакции имеет место равновесная степень превращения это максимально возможно допустимая степень превращения. N N x* ( ) *. N Если объем реакционной смеси постоянен, то количество молей может быть замещено на величину объемной концентрации, которая выражается либо в долях, либо в процентах. N, V x Выход продукта бывает:. теоретический это максимально возможный выход для данных внешних условий;. практический. В зависимости от типа реакции различают выходы:. стехиометрический, когда реакция необратимая, он может быть рассчитан по уравнению химической реакции;. равновесный, когда реакция обратимая это максимально возможный выход, который можно изменить за счет изменения внешних условий. На практике практический выход, он всегда меньше теоретического. Он представляет из себя: отношение количества реально полученного продукта к теоретическому: Для необратимой реакции: N N max p N N ( ) ( ) max N N r a N x r a N N r a.. x N r a Вывод: выход численно равен степени превращения. Для обратимой реакции: (*- обозначение для обратимой реакции) * N N max *. N N) r a N x r a x. ( N N*) r a N x * r x * a Вывод: выход численно равен отношению реальной степени превращения к максимальной (равновесной) степени превращения.
7 Селективность по целевому продукту определяет эффективность осуществления целевой реакции наряду с побочными взаимодействиями (). N N N S S N ; N N С учетом закона сохранения селективность по целевому продукту может быть записана следующим образом: N N N max N ( N N) ( N N) Вывод: если входе ХТП наряду с целевым продуктом образуется и побочный, то выход по целевому продукту будет зависеть не только от достигнутой степени превращения по исходным реагентам, но и от селективности: x. Технологическая схема. Любое химическое производство реализуется в виде технологической схемы производства. Под технологической схемой производства понимают последовательное описание или изображение осуществляемых процессов и соответствующих им аппаратов. В целом технологическая схема должна нести следующую информацию:. о последовательности отдельных операций и взаимосвязях между ними;. данные о математическом и энергетическом балансе в целом по технологической схеме и ее отдельных аппаратах; 3. данные о типе, числе и основных размерах аппаратов и реакторов. Технологическая схема может быть исполнена для изображения как действующих, так и проектируемых производств. Классификация технологических схем:. по полноте описания: а) полные, где имеется вся информация; б) принципиальные, менее информированы, чем полные, но в них обязательно отражена взаимосвязь между аппаратами, последовательность осуществления операций, данные о типах аппаратов, информация о составе материальных потоков; в) блок-схемы. Видим движение материальных потоков, но не видим реакторов, их обвязку, и видим последовательность.. по количеству стадий переработки: а) одностадийные описывают одну стадию; б) многостадийные описывают несколько или все стадии данного химического производства. 3. по количестве целевых продуктов а) разветвленные получение нескольких целевых продуктов; x.
8 б) неразветвленные получение одного продукта из нескольких продуктов. 4. по характеру движения реагентов через аппараты и реакторы: а) открытые, когда все реагенты последовательно проходят цепочку аппаратов только один раз; б) циклические, когда один из реагентов или продуктов или все проходят по аппарату несколько раз; в) комбинированные. Классификация продуктов и отходов химической технологии. Основные вещества Исходные вещества Технологический процесс Вспомогательные вещества Отход Выход из сферы производства Побочный продукт Конечный продукт Конечный продукт Целевой продукт Полупродукт Исходные вещества это материалы, вводимые в процесс, над которым совершают технологические операции и которые претерпевают химические превращения входе процесса. К ним относятся, например, материалы, которые составляют материальную основу продукта. Вспомогательные вещества способствуют осуществлению процесса, например, катализаторы. Конечный продукт то, то получено в результате ХТП. Полупродукт продукт, не выходящий из сферы производства и участвующий в дальнейших стадиях. Отход конечный продукт, который либо не имеет достаточно материальной ценности, либо не находит применения в данной технологической схеме.
9 РАВНОВЕСИЕ В ХИМИКО-ТЕХНОЛОГИЧЕСКОМ ПРОЦЕССЕ. По степени происхождения существуют следующие реакции обратимые и необратимые. Обратимые реакции это те, для которых существует состояние химического равновесия. Устойчивое химическое равновесие характеризуется:. неизменностью состояния равновесия системы во времени при постоянных внешних условиях;. подвижностью равновесия, т.е. самопроизвольным восстановлением состояния равновесия при снятии внешних воздействий, вызвавшего отклонения в системе; 3. динамичностью характера равновесия, т.е. установлением и сохранением его вследствие равенства скоростей прямого и обратного процессов; 4. минимальностью значения энергии Гиббса. a b r; W a b; W r; W W r Kc. a * b * Это вывод закона действующих масс для обратимой реакции, где константа химической реакции К с выражается через концентрацию. График : «Зависимость концентраций реагента и продукта от времени» С * С * С А На графике С * и С А * — равновесные концентрации. С А во времени уменьшается, а С увеличивается. Константа химического равновесия для газовых реакций К р, выражаемая через давление: K p pr * pa * pb *. Константа химической реакции, выражаемая через число молей: Kc KpT n.
10 При изменении внешних условий равновесие может быть сдвинуто влево или вправо это называется смещение равновесия. Принцип Лешателье в системе, выведенной внешними воздействиями, происходят изменения, направленные на ослабление этих воздействий. Допущение: если реакция газовая: Оценим внешние условия:. если увеличить температуру, то равновесие сместится влево;. если увеличить концентрацию А или В или уменьшить концентрацию, то равновесие сместится вправо; 3. если в системе увеличить общее давление через объем, то равновесие сместится вправо, т.е. если увеличить объем, зависящий от числа молей в системе, то увеличится и общее давление. Скорость химико-технологических процессов. Скорость ХТП по целевому продукту есть результирующая скоростей прямой, обратной и побочной реакций, а также скорости подвода исходных реагентов в зону реакций и отводу продуктов из этой зоны.. Реакция простая, гомогенная, идущая в одну стадию. Скорость всего процесса равна скорости самой химической реакции. Скорость химической реакции это количество молей реагентов (продуктов), израсходованных (образующихся) в единицу времени на единицу объема реакционного пространства (W ): W dn V d, где V dn объемная концентрация. d W, d Этим выражение определяется величина скорости химической реакции, т.е. изменение концентрации в единицу времени. График Касательная d d. tg d d W это практический путь определения W. Из графика видно, что W max в начале процесса и W mn, когда концентрация уменьшается. Факторы, оказывающие влияние на скорость химико-технологического процесса, определяются законами микрокинетики. Закон действующих масс, в соответствии с которым скорость гомогенной реакции пропорциональна концентрациям исходных реагентов эта функциональная зависимость называется кинетическим равнением реакции: где a+b=порядок реакции (-3). W a b; a b r;
11 . Реакция сложная, протекающая через ряд параллельных или последовательных элементарных стадий. Для написания кинетического уравнения этой реакции нужно знать следующие правила: ) количество кинетических уравнений должно соответствовать количеству реагентов и продуктов, рассматриваемых в реакции; ) суммарная скорость химической реакции по компоненту определяется алгебраической суммой скоростей тех стадий, в которых он участвует; 3) знак в алгебраической сумме определяется правилом знаков. Правило знаков производной концентрацией данного компонента по температуре приписывают знак минус независимо от того является ли этот компонент исходным реагентом или продуктом. В правой части кинетического уравнения скорости тех элементарных стадий, в которых компонент расходуется (т.е. является исходным реагентом) записывается со знаком плюс, а где компонент образуется (т.е. является продуктом) записывается со знаком минус. 3. Сложная последовательная реакция. P; d ; d d ; d d. d Для реакции порядка (реакция элементарная- стадия): d d; g ; Зависимость текущей концентрации от момента времени: e ; ( x); n( x) ; n x ; Время превращения: Степень превращения: Из этого следует: n. x x e.
12 d e d ; Тогда концентрация промежуточного продукта: e e ( ), P. Текущая концентрация конечного продукта: e p e ( ), График Изменение концентрации от времени осуществления химической реакции. Случаи:. если, то:. если, то: Тогда: p ( e ). p ( e ). max n ; ( ). max 4. Сложная параллельная реакция., P d ( ). d Текущая концентрация исходного реагента: e ( ) ; d d dp d n Случаи:. если реакция порядка: ( ). ( ) p p ; ( ) d ; d x. х А — достигнутая степень превращения.. если реакция порядка:
13 3. если реакция порядка: ; ; d ; d x e. d ; d x ; x ; d ; d n M x ( ), M ( x) где М- это отношение начальных концентраций А и, M 4. если реакция n порядка, кроме (n): n ( x) ( n ). Зависимость скорости реакции от температуры. Уравнение Аррениуса: E e T. Логарифмируя данное уравнение от Т до Т и отношения и в итоге получаем: n E ( ), T T где Е это энергия активации химической реакции. Энергия активации это величина энергетического барьера, который нужно преодолеть молекуле, чтобы вступить в химическое взаимодействие (Е). График График E n n y b ax, T где n const — предэкспоненциальный множитель. E tg. КИНЕТИКА ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ. Несмешивающиеся системы- г-тв, ж-тв, г-ж-тв, ж-ж. Где имеется поверхность раздела фаз, там идет реакция. Особенности: прежде чем произойдет химическая реакция должен осуществиться перенос реагентов из ядра потока менее плотной фазы к поверхности более плотной фазы, учет скорости этого переноса очень важен вследствие затрудненности этой стадии, движущей силой которой является диф-.
14 фузия и как правило скорость всего гетерогенного процесса в целом определяется не скоростью химической реакции, а скоростью процесса переноса. Скорость гетерогенного процесса (W ) это количество вещества, прореагировавшего или образовавшегося в единицу времени на единицу поверхности раздела фаз. a b ; dn W. a F d Скорость диффузионных стадий (W g ) это количество вещества, которое продифундировало перпендикулярно поверхности раздела фаз на единичную поверхность раздела фаз. W g dn F d. Так как конечный результат любого ХТП это образование продукта в результате химической реакции, то скорость всего гетерогенного процесса в целом в любом случае не может быть выше, чем скорость реакции. Закон Фика: количество вещества, перенесенное за счет диффузии в единицу времени через единичную поверхность, перпендикулярную к направлению диффузионного потока, пропорционально градиенту концентрации этого вещества в направлении потока: W D g x, где С разность концентраций; х толщина величины диффузионного слоя; Д коэффициент диффузии. D x ; W g, где — коэффициент массоотдачи. При протекании гетерогенного процесса у поверхности раздела фаз, наблюдается расходование исходных компонентов и образование продуктов реакции. Для стационарного протекания процесса необходимо непрерывное пополнение убыли реагентов на поверхности раздела фаз и удаление от нее образовавшихся продуктов. Эти переносы осуществляются за счет диффузии, при наличии перепада концентраций и чем быстрее идет реакция, тем больше будет скорость диффузии, иначе реакция будет тормозиться. Для того, чтобы увеличить скорость диффузии надо иметь меньшую толщину диффузионного слоя, т.е. высокий. Вставить лекцию
15 Гетерогенный процесс в системе газ твёрдое. a b r ss г т г т Существует несколько моделей для описания такого рода моделей. Модель с фронтальным перемещением зоны реакции. Допущения: о глубине протекания процесса судят по изменению объёма твёрдого реагента, принимается что частица твёрдого реагента имеет правильную сферическую форму ив ходе процесса размер твёрдой частицы остаётся неизменным; весь гетерогенный процесс делится на пять основных стадий. стадия : внешняя диффузия газообразного реагента А из ядра потока к поверхности твёрдой частицы через пограничный диффузионный слой ; стадия : внутренняя диффузия газообразного реагента А через слой продукта S и поверхность твёрдого реагента ; стадия 3: ХР между газообразным реагентом и твёрдым реагентом на его поверхности с образованием газообразного продукта и твёрдого продукта S; стадия 4: внутренняя диффузия газообразного продукта через слой твёрдого продукта S; стадия 5: внешняя диффузия газообразного реагента через пограничный слой. Процесс в целом может лимитироваться либо внешней, либо внутренней диффузией, либо собственно ХР. Считают что скорость всего процесса в целом равна скорости лимитирующей стадии. а) Если скорость всего процесса лимитируется скоростью внешней диффузии. r — текущий радиус частицы реагента ; процесса в целом. д в д 5 r — первоночальный радиус частици реагента; — пограничный слой; С Ад — концентрация реагента в ядре потока (действительная); С Аf — концентрация реагента А на поверхности твёрдого реагента. В этом случае на момент заканчивания диффузии реакция заканчивается. Приравниваем скорость диффузии к скорости всего dn в С С * * ; С Ад 4 3 С Ад С Аf Аf в F d Аf Поскольку частица шарообразна, то первоначальное количество реагента равно первоначальному объёму вещества на плотность вещества.
16 4 3 N V r 3 4 dn 3r dr 4 r dr 3 F 4 4 r dr l * * в 4r d r dr d вс вс Ад 3вС r x 3 N 3 V V N N Ад Ад 3 3 r ( ) 3 3 r ( N N N N ( x п ( х ) ) 3 3 ) ( x ) для лимитации общей диффузией Для того чтобы интенсифицировать гетерогенный процесс лимитирующийся внешней диффузией необходимо чтобы время полного превращения было минимальным. Это достигается за счёт уменьшения размеры частицы, максимальный коэффициент массоотдачи, т.е. уменьшение пограничного слоя, максимально возможная концентрация реагента в газовой фазе. б) Если процесс лимитируется внешней диффузией. Изменение концентрации от текущей концентрации будет происходить в слое твёрдого продукта. С Ад п / 3 х x 3 п 6вДС Ад в) Если процесс лимитируется скоростью ХР идущей на поверхности раздела фаз. / 3 п х С Ад п вкс Ад Все расчётные формулы выведены для одной сферической частицы.
17 . ТЕОРЕТИЧЕСКИЕ ОСНОВЫ СОСТАВЛЕНИЯ БАЛАНСОВ ХТП. Материальные и тепловой балансы используют для расчёта ХТП. В зависимости от типа ХТС способы составления балансов различаются. Общим является то, что они описаны на законах сохранения (массы, энергии, импульса). Классификация ХТС: Закрыты и открытые (поточные); Периодические и непрерывные; Стационарные (постоянные во времени) и нестационарные; Гомогенные и гетерогенные. Причины необходимости составления балансов: Для анализа работы отдельных аппаратов, отдельных стадий и всей технологической схемы в целом; Для проектирования аппаратов, реакторов и новых производств; Для расчёта основных технологических показателей (расходные коэффициенты по сырью, пару, материалу, воде, энергии, выход продукта, степень превращения). Законы сохранения в закрытой системе означают, что сумма масс, энергии и импульса внутри системы остаются неизменными, независимо от того, какие процессы внутри неё происходят, т.е. отсутствует обмен веществом, энергией и импульсом системы с окружающей средой. Закон сохранения массы. Для системы в которой нет ХР.. В системе одна фаза и несколько компонентов. Сумма масс компонентов равна массе системы. m. M. Система имеет компонент, несколько фаз. Сумма масс фаз равна массе системы. 3. Система имеет несколько фаз и несколько компонентов. x, y, z — концентрация, доля компонента в фазе. Масса системы равна сумме масс всех фаз. Закрытая система в которой протекает ХР. Если в системе осуществляется ХР, то закону сохранения подчиняются не компоненты, а химические элементы. где стехиометрические коэффициенты. M M M m m x m y m z M M x x M y y M z z x n x M M M x y n M y y M M z z n ( N, O. ) H 4 O O H O( N, O. ) M, z
18 Закон сохранения энергии в закрытой системе. Внутренняя энергия изолированной системы постоянная. Для закрытой системы энтальпия постоянна. Законы сохранения в открытых (поточных) системах. Все системы в которых осуществляются ХТП — поточные. Покоящаяся (закрытая) система — частный, идеальные случай поточной..3. Поток — пространственное премещение какой — либо величины()во времени. С учётом стационарности (нестационарности) его величину можно записать: Обычно оперируют удельной величиной — плотностью потока — векторная величина направление которого совпадает с направлением движения потока, а величина равна значению ве- j личины потока, протекающего через еденичное сечение. Виды потоков. J dh du pdv du, pdv, т. к. dv dh d J нестационарный d J стационарный j F F В технологии любую систему, например, химический реактор, можно однозначно охарактеризовать четырьмя видами потоков: массы, компонента, энтальпии, импульса. J m J m dm d M поток массы стационарный Поток компонента — частный случай потока массы. J для нестационарног о dn J ; J N /, моль / с, кмоль / ч d г / с, кг / ч Поток энтальпии — энергетическая характеристика системы, переходящее в единицу времени количество энтальпии, отнесённое к единице массы вещества. J q dh d( pt) d d ( J q h ), Дж кг * с Поток импульса (количество движения) — характеризуется значением переходящего в единицу времени импульса. J p Вт кг d( mv ) / d, ( J mv / ), кг * м / с p
19 Каждый из выше перечисленных потоков имеет несколько характеристик: конвективная составляющая потока, диффузионная (основная), переходящий поток и источник или сток. Конвективный поток — некоторая однозначно характеризуемая обобщённой плотностью (Г) множество частиц, какой — либо силы из одного места пространства в другое. Г ; F V ГV J dv ГV j F Конвективный Диффузионный Переходящий поток d ГV j m V j m Дgrad J KF m ; j m K j V j Дgrad J K F ; j K J q FT; j q T j q p С TV С l x j q gradt С l x j p VV l x j gradv FV ; V Основной (диффузионный) поток (в чистом виде только внутри твёрдого тела).плотность диффузионного потока пропорциональна градиенту (С/x) величины на участке диффузии. Переходящий поток. Зависимости, выведенные для основного и конвективного потоков, действительны только в дограничной поверхности. В этих пределах функция изменения (концентрации и плотности) неразрывна. Явная форма зависимости, описывающей поток на межфазной поверхности не может быть записана с помощью непрерывной функции, поэтому для описания потока между фазами пользуются эмпирическими формулами. Опыт показывает, что поток между фазами пропорционален площади контакта фаз и разности соответственно концентраций, температур или скоростей внутренней фазы. Источник или сток. В определённых точках пространства могут существовать источники или стоки, вносящие изменения в систему. В случае потока компонентов могут появляться новые компоненты и исчезнуть исходные реагенты. G m — количество вещества, образующееся (израсходованное) в ходе ХР. J p j p
20 G m массы компонента для потоков H энтальпии -grad импульса в случае поточных систем законы сохранения представляются в виде уравнений неразрывности потока. Поток массы. По оси х. V dz dx По оси y и z также V x dzdyd; поток массы, входящий dy ( V x ) ( V dx) dzdyd ; выходящий x ( V x ) dxdzdyd ( x); накопление или убыль вещества x ( y V y ) dxdzdyd ( y); ( z ) dxdzdyd ( z). внутри объёма Согласно законам сохранения сумма накопления или убыли вещества, движущегося в трёх направлениях должно быть равна убыли или накоплению в единице объёма в момент времени. V x V y V ( ) ( ) ( z dxdydzd dxdydzd x y z ( V x ) ( V y ) ( Vz ) x y z dv( V ) Дивергенция плотности потока равна местным изменениям в единице времени. В соответствии с характеристиками потока уравнение неразрывности можно записать: масса : dv( V ) dv( Дgrad ) K Gm компонент : Уравнения dv( V ) dv( Д grad ) K Дамкеллера энтальпия : ( pt) для потоков. dv( С ptv ) dv( gradt ) T H импульс : ( V ) dv( V ) dv( gradv ) V gradp Они представляют собой общие уравнения сохранения для поточных систем..4. Рассмотрим поточную систему в которой отсутствует ХР (на примере потока массы).предположим, что в системе поток вещества движется F x только по оси х. Система гомогенна и скорость соответствует турбулентному режиму. V z
21 dv( Дgrad ), K,, G m онарное движение потока, т.е. во времени не изменя- /, т.к. стациется. т.к. турбулентный режим; т.к. гомогенная система; т.к. ХР отсутствует; dv( V ). dv ( V ) dv( Дgrad ) K G m Отсюда ( V x ), FV x const x FV x const уравнение расхода Рассуждая аналогично приходим к для потока компонента: M вход M выход ( ), закон сохранения массы для открытой системы без ХР. если ещё и ХР, то уравнение () относится к каждому химическому элементу. Для потока тепла: Если в системе нет ХР и она не совершает работы: h — удельная энтальпия, n n N вход N h N h, n Баланс в закрытой в Дж, открытой в Вт. Если система открытая и она производит работу или её нагревают (охлаждают): Q Q — подводимое тепло, L — отвод тепла или совершение работы. Если в системе будет происходить ещё и ХР: Q n N h N h, экзо Q n n n Q экзо и Q эндо — тепло от экзо- и эндотермических реакций соответственно..5. Общие принципы составления материальтного и теплового баланса. Необходимо выразить все поступающие количества в какой — либо одной системе мер и суммировать их, затем все выходящие из системы количества выразить в той же самой системе мер и суммировать их. После этого обе стороны баланса надо сравнить на счёт расхождений. n Nh Nh N выход (), закрытая Дж n n Nh L, поточная Вт Nh L Q эндо,
22 Причины расхождения баланса: На практике работают не с чистыми компонентами, т.к. исходноё сырьё загрязнено; В ходе реального процесса возможны потери; Если в ходе составления баланса необходимо использовать физико — химические данные, по возможности одним справочником; Если баланс составляют на основе данных анализов, то вследствии погрешностей могут возникнуть нестыковки. Материальный баланс — вещественное выражение закона сохранения. Для закрытых систем он составляется в расчёте на технологическую операцию. баланс составляют только в единицу массы. Для открытых (поточных) систем баланс составляют в единицу времени: Виды балансов: По области применения: Баланс части элемента процесса (аппарата, реактора); Баланс всего элемента процесса (отделение абсорбции); Баланс многих элементов прцесса (баланс цеха); Баланс всех элементов процесса (завода); Баланс отрасли страны. По веществам учавствующим в ХТП: Бруто баланс — всех материальных потоков; Частный баланс — одного или нескольких компонентов; Элементный баланс — по химическому элементу. По форме: В виде уравнения; В виде таблици; В виде диаграмм..6. Классификация систем по виду уравнения Данкелера. dv ( V ) dv( Дgrad ) K Gm Закрытая система. Открытая система. При стационарном режиме: Стационарная система. Периодический. Непрерывный. dv( V ), /, dv ( Дgrad ) K G /. dv( V) /,. dv( V ), dv( V ), G вход G выход G вход G выход m /, нестациона рный. /, нестационарный ( пуск и остановка ); /, стационарн ый.
23 Периодический процесс — характеризуется разовой загрузкой исходного реагента, последующей обработкой до заданной степени превращения и одновременной выгрузкой прдуктов из системы (аппарата). Ёмкость реактора с перемешивающим С устройством. С С/= Технологическая переменная = f(), но не места (пространства). С к С = к l С/= С учётом обязательного наличия перемешивающего устройства в аппарате считают, что технологическая переменная в каждый данный момент времени одинакова во всех точках. свойство периодического процесса: технологическая преременная = f(),но не пространства; свойство периодического процесса: для периодического процесса характерно наличие цикличности. Цикл работы аппарата з врезагрузки; з обр выг чист обр — врея обработки, до заданного Х ; — время выгрузки; чист — время очистки аппарата. Определение периодичности процесса соответствует определению нестационарности закрытой системы. Непрерывный процесс может быть осуществлён как в аппарате Х а Х а С С к С С/= l С С С/ Аппарат смешения l С l С l= ёмкостного типа, так и в аппарате трубчатого типа. Технологическая переменная = f(пространства). l С С l Аппарат вытеснения
24 Непрерывный процесс характеризуется постоянным вводом реагента при постоянном выводе продуктов. С/ С/= пуск стац ост С/ пуск — время пуска, в период пуска нестационарный; стац — время стационарного периода работы непрерывного процесса; ост — период остановки. Стационарный режим работы является частным случаем непрерывного процесса. Достоинства непрерывных процессов: Технологические процессы переработки протекают одновременно со вспомогательными и транспортными операциями. Это позволяет обеспечить высокую производительность и исключить простой оборудования; Свойство постоянства переменной в данной точке аппарата во времени значительно чаще автоматизировать процесс и позволяет иметь постоянство качества продуктов и отхода; Минимальные расходные коэффициенты по сырью, теплу, энергии и т.д. (в следствии низкая себестоимость продукта). Достоинства непрерывных = недостатки периодических: В периодическом процессе можно получить продукт более высокого качества; В случае аварийной ситуации: легче остановить, значительно меньше будут потери; Периодические процессы в основном используют для малотоннажных производств; Легко переходить с одного вида продукции на другой..7. использование уравнения Дамкелера для составления математической модели ХТП. dv ( V ) dv( Д grad ) K С dv( V), т. к. закрытая система С к dv( Д grad ), перемешивания принебрег аем диффузионным потоком вседствии Разовая загрузка реагента, обработка до заданной степени превращения, разовая выгрузка продукта. В случае осуществления в реакторе гомогенной реакции, отсутствует переходящий поток раздела фаз, то для этого процесса С/. С С/ / Характеристическое уравнение реактора периодического действия. d
25 В системе осуществляется гетерогенная ХР, в стационарном режиме можно пренебречь диффузионным потоком. dv( V ) ; dv ( Д grad ) ;. K K( С С поверх ) поверх С
26 .8. совместимость понятий при рассмотрении ХТП. Уравнение Дамкелера. Закрытая система Открытая система характерно: отсутствует конвективный характерно: конвективный поток V V поток вещества(dv( ) = ); вещества(dv( ) ); имеет место изменение технологической отсутствует изменение переменной во времени (С/ ). технологической переменной во Периодические, нестационарные. времени (С/ = ). Непрерывный, стационарный. Если в системе высока турбулизация потока, то можно принебреч диффузионным потоком вещества. dv(д grad ) =. Если система гомогенная, то отсутствует переходящий поток вещества K =. Если в системе имеется ХР, обязательно наличие источника или стока.. КАТАЛИЗ В ХИМИЧЕСКОЙ ТЕХНОЛОГИИ. Катализ — изменение скорости ХР или её интенсивности в результате воздействия специальных веществ (катализаторы, ингибиторы). Катализаторы — вещества, которые многократно вступая в промежуточные взаимодействия с исходными реагентами и промежуточными продуктами, изменяют механизм ХР и увеличивают скорость достижения равновесия, при этом по окончание реакции они восстанавливают свои первоначальные свойства. Катализаторами могут быть: газы, жидкости, твёрдые вещества, по этому по агрегатному состоянию различают: гомогенный катализ — все компоненты ХР, включая и катализатор в одной фазе; гетерогенный катализ — есть другая фаза, т.е. есть поверхность раздела фаз. По механизму действия различают следующие процессы: Каталитические реакции — где осуществляются ОВ процессы (Ме, оксиды или сульфиды Ме); Каталитические процессы в которых протекает кислотно — основное взаимодействие (передача ионов Н +, ОН -, катализаторы: кислоты, основания, индифферентные растворы пропитанные ими). Каталитические процессы с автокаталитическими реакциями (промежуточные продукты — катализаторы). Различают положительный (, катализаторы) и отрицательный катализ (, ингибиторы).
27 Сущность ускоряющего или замедляющего воздействия катализатора заключается в изменении реакционного пути, в результате чего изменяется и энергия активации.
28 + Без катализатора +* * Е нк t* + С катализатором +t t* t*+t* t*t+ В промышленности основным видом каталитическокого процесса является гетерогенный катализ с использованием твёрдого катализатора или твёрдого носителя, пропитанного катализатором. t*.. Характеристики катализаторов (на примере твёрдых). Производителльность — количество продукта, полученное в единицу времени с единицы объёма катализатора. Активность — показывает насколько снижает катализатор энергию активации ХР. К Е акт нк Е Е акт К кат T T T нк К е Ккат К е А е К нк Чем больше снижается энергия активации, тем выше активность. Время контактирования. Различают фиктивное и действительное время, м 3 /с V V кат факт кат фикт V, м 3 контактирования. фикт = V /, с; на практике, как правило пользуются фиктивным. факт = V факт t, с. Температура зажигания — минимальная температура при которой каталитический процесс идти с достаточной для практических целей скоростью (чем ниже температура, тем выше активность). ИзбирательносЂь (селективность) — способность катализатора изберательно ускорять целевую реакцию при наличии нескольких побочных. Механическая прочность — характеризует способность катализатора противостоять механическим воздействиям. Зависит от способа изготовления, от пористости зерна катализатора. Отравляемость — снижение его активности под действием малых количеств веществ, называемых ядами (примеси исходных реагентов, продукты
29 реакции). При отравлении катализатора на внешней и внутренней поверхности либо образуется химическое соедениние, либо происходит адсорбция, вследствии чего затрудняется доступ реагента к поверхности катализатора. Различают обратимую (возможна регенерация, при этом образовавшиеся на поверхности вещества удоляются и активность восстанавливается) и необратимую отравляемость катализатора. Яды: H S, соединения s; синильная кислота. Твёрдые катализаторы в промышлености чаще всего выпускают в виде таблеток, гранул, зёрен. Твёрдый католизатор: смесь нескольких компонентов — собственно вещество катализатора (жидкости, Ме, оксиды Ме). Трегеры (носители) — пористые индеферентные вещества на внутреннейц и внешней поверхности которых наносится катализатор (носители искусственные: кокс, керамика, силикагель
30 dt / d t * t * t t * * 3 3 d / d t 3 t 3 3 Е нк Н адс 4 5 Е ист Е каж Н дес.3. Гетерогенный катализ (ГК). По фазовому признаку различают следующие виды ГК: Использование жидкого катализатора, ускоряющего реакцию между двумя несмешивающимися жидкостями; Использование твёрдого катализатора, ускоряющего реакцию между жидкими или газообразными реагентами. Отличие. При ГК промежуточное соединение возникают на поверхности катализатора и перед тем, как комплексы соединяются добавляется стадия адсорбции (десорбции). Оба эти процесса идут с изменением энергии системы. Энергетическая диограмма гетерогенного катализа. — Энергетическое состояние исходных реагентов. Первая стадия процесса на энергетической диаграмме — стадия адсорбция исходных реагентов на поверхности зерна катализатора. — Энергетическое состояние исходных реагентов, адсорбированных на поверхности катализатора. 3 — Адсорбированные промежуточные комплексы на поверхности катализатора. 4 — Продукты, адсорбированные на поверхности катализатора. -3 Е ист — истинная энергия активации каталитической реакции. -3 Е каж — кажущаяся энергия активации. 7 Е ист = Е каж +Н 6 адс 5 — Энергетическое состояние продуктов. Н дес — тепловой эффект десорбции. Физические стадии ГК. — Внешняя диффузия реагирующих веществ из ядра потока к внешней поверхности зерна 3, 4, 5 катализатора.
31 — Внутренняя диффузия реагентов в порах зерна катализатора. 3 — Адсорбция исходных реагентов на внутренней и внешней поверхности с образованием поверхностно активных комплексов состава реагенткатализатор. 4 — Перегруппировка атомов с образованием с образованием комплексов продукт-катализатор. 5 — Десорбция продуктов с внешней и внутренней поверхности зерна катализатора. 6 — Диффузия продуктов в порах зерна катализатора. 7 — Внешняя диффузия продуктов в ядро потока. Общая скорость гетерогенного каталитического процесса определяется скоростями его отдельных стадий и может лимитироваться медленной. Если скорость самой ХР больше скорости диффузии, то скорость всего процесса в целом будет определяться скоростью диффузии, значит кинетика процесса будет описываться уравнениями диффузии. Если скорость диффузии намного больше скорости ХР, то в целом скорость всего процесса будет лимитироваться скоростью ХР, т.е. подчиняться химической кинетике. С учётом неравнодоступности поверхности (внешней и внутренней). Различают случаи: Скорость процесса лимитируется внешней диффузией (, 7). Скорость лимитируется внутренней диффузионной областью (,6). Процесс лимитируется внешней кинетической областью (3, 4). Процесс лимитируется внутренней кинетической областью (3, 4, 5).
32 Влияние технологических факторов на скорость гетерогенного каталитического процесса.. Если процесс лимитируется внешней диффузионной областью, это означает, что концентрация реагирующих веществ даже на поверхности зерна, а тем более в порах, гораздо меньше, чем в ядре потока. Чтобы увеличить скорость необходимо: — увеличить концентрацию потока; — увеличить турбулизацию потока.. Если процесс лимитируется внутренней диффузионной областью. Концентрации реагирующих веществ в ядре потока и на внешней поверхности весьма близки, но в порах концентрация резко падает. Сд С А П В данном случае для интенсификации процесса нужно: либо уменьшить размер зерна катализатора, либо увеличить размер пор, т.е. провести мероприятия, связанные с изготовлением катализатора. В газовых растворах с увеличением давления. 3. Если процесс лимитируется внешней кинетической областью. В этом случае концентрации реагирующих веществ на внешней поверхности катализатора и в ядре потока равны, но вследствие чрезвычайно высокой скорости химической реакции, она идёт только на внешней поверхности зерна. внутр д Скорость процесса будет определяться законами химической кинетики. 4. Если процесс внутренней кинетической областью. Концентрации вещества на поверхности, в ядре потока и внутри пор одинаковы. В этом случае скорость процесса зависит только от скорости химической реакции. В данном случае скорость процесса можно изменять за счёт использования температуры, концентрации, давления. Влияние температуры.. Если прямая реакция эндотермическая, то увеличение скорости процесса достигается при увеличении температуры реакционной смеси. Крайней будет температура, при которой катализатор разрушается. Q С А д С А
33 Ф равновесный действительный Т. Если реакция экзотермическая. Kt Q T з T max ЛОТ Т T max это температура, при которой процесс идёт с максимально возможной скоростью при максимально большом выходе. Эту температуру в процессе перескакивать нельзя. ЛОТ линия оптимальных температур. V см U V см V см U V см U U Линия оптимальных температур показывает, какой выход мы можем достигнуть при данной температуре с максимально возможной скоростью. Это та линия, вдоль которой необходимо осуществлять экзотермический процесс. Способы осуществления экзотермической каталитической реакции по линии оптимальных температур.. Реактор с теплообменной трубкой.
34 Некоторым приближением к линии оптимальных температур является проведение процесса в реакторе вытеснения, находящемся внутри теплообменной трубки, по которым проходит холодный реагент. А С К Д l С О теплообменник С реактор А Д С В Т Ф Д Если зона лежит в.8 max Если факт max, то процесс идёт близко к ЛОТ. С В Т заж ЛОТ Т. Достаточно эффективным способом приближения к оптимальному температурному режиму является проведение процесса в многосекционном реакторе вытеснения, в котором каждая секция работает в адиабатическом режиме, а между секциями имеется промежуточное охлаждение. Объём секции должен быть таким, чтобы на выходе из неё достигалась степень превращения (выход), соответствующая пересечению адиабаты с верхней границей области оптимальных температур. Так как скорость реакции по мере увеличения степени превращения уменьшается, то объём каждой последующей секции должен увеличиваться. холодильник Т Т Т Т 3 Т 3 Т 4 Т вых =Т 4 Т заж Ф Ф Ф 3 Ф 4
35 Ф Ф 4 Ф 3 Т 4 Т 4 Т 3 Ф Т 3 Т Ф Т ЛОТ Т Т заж Т 3. Многосекционный реактор вытеснения с байпасными линиями ввода исходного реагента. холодильник Ф Ф Т заж Ф Ф Ф 3 Ф 4 Ф 4 Ф 3 Ф Ф Т 4 Т 3 Т Т 4 Т 3 Т Т ЛО Т заж Т 4. Осуществление процесса в каскаде реакторов смешения, в каждом из которых поддерживается постоянная температура (изотермические реакторы). Т Т Т
36 Ф Ф Т Т 3 Т Т Т Для каждого из рассматриваемых вариантов возможна дальнейшая оптимизация процесса, которая будет заключаться в расчёте оптимальных объёмов секций, начальных температур, оптимальных расходов, байпасных линий. ХИМИЧЕСКИЕ РЕАКТОРЫ. Химический реактор является одним из основных элементов любой технологической схемы. Химическим реактором называется аппарат, в котором осуществляется ХТП, сочетающий в себе как физические, так и химические явления. Отличием химического реактора от других известных аппаратов является то, что в нём наряду с тепло- и массообменными процессами осуществляется ещё и химическая реакция. Типичные химические реакторы: ) Ёмкостные реакторы с перемешивающими устройствами. Такие реакторы используются для осуществления реакций в гомогенных системах (ж-ж) или в системах г-ж. ) Аппараты трубчатого или колонного типа это могут быть колонны или аппараты барабанного типа. Используются для осуществления реакций в системе г-г, г-ж. Например, промышленные печи, печи с кипящим слоем, электрические печи и т.д. При выборе конструкции и определении размеров реактора, необходимо знать: ) данные о кинетике протекающей химической реакции; ) данные о скорости протекающих тепло- и массообменных процессов. Задаётся: ) Производительность. ) Конечная степень превращения.
37 3) Выбирается математическая модель реактора: периодический, непрерывного действия идеального смешения (РИС); непрерывного действия идеального вытеснения (РИВ). 4) По модели рассчитывается конечное время пребывания реагента в реакторе, объём, геометрические характеристики. Под математической моделью реактора подразумевается функциональная зависимость времени пребывания реагентов в реакторе от начальной концентрации реагентов, конечной степени превращения и скорости химической реакции. f,, ) Такое уравнение называется характеристическим уравнением реактора. ( x Основные требования к промышленным реакторам.. Максимальная производительность реактора.. Максимальная интенсивность осуществления процесса производительность, отнесённая к объёму реактора или площади поперечного сечения. I U 3. Высокий выход целевого продукта и максимально возможная x. 4. Минимальные энергетические и тепловые затраты на осуществление химического превращения и транспортировку реагентов и продуктов через реактор. p I x, В, м 3 /с U при U =const V l p ( ) d VF объёмный расход Производится технико-экономический расчёт. 5. Реактор должен быть легкоуправляем, обеспечивать устойчивость технологического режима и безопасность работы. Это обеспечивается рациональной конструкцией. 6. Низкая стоимость изготовления, лёгкость его обслуживания и ремонта. Технологическая классификация. Конструкции реакторов могут быть сгруппированы по следующим признакам:
38 ) По способу подвода реагентов и отвода продуктов (способ организации процесса): а) периодического действия; б) непрерывного действия; в) полунепрерывного действия. ) По виду перемешивания в пространстве (по режиму движения реакционной смеси): а) ёмкостные (перемешивание механическими, циркуляционными, пневматическими методами); б) трубчатые (длина >>диаметра). 3) По тепловому режиму в реакторе: а) изотермические реакторы (в ходе реакции поддерживается постоянная температура реакционной смеси); б) адиабатические (изолирован от внешней среды по тепловому потоку). 4) По фазовому состоянию реакционной смеси: а) для гомогенных химических реакций б) для гетерогенных химических реакций. Математические модели основных типов химических реакторов.. Характеристическое уравнение идеальных типов изотермических реакторов для осуществления гомогенных процессов. Составление математической модели реактора основывается на законах сохранения. Полное математическое описание реактора возможно при совместном решении следующих дифференциальных уравнений: Навье-Стокса, конвективного массообмена, Дамкелера, теплопередачи. В данных условиях решение такой системы уравнений невозможно, поэтому делают допущения. Составление химических уравнений для математических потоков. Запишем уравнение Дамкелера для потока компонента: dv V dvdgrad ) Для идеальных типов реакторов пренебрегают дифференциальным потоком: dv Dgrad. Реакция гомогенная: dv V Vdv V ) ( ) V const VF ( o U ) l lf ( U o математическая модель химического реактора для гомогенного изотермического процесса
39 N ( o ) U Реактор периодического действия (РПД). С реактор ёмкостного типа с перемешивающим устройством; характеризуется разовой загрузкой компонента, последующей обработкой до заданной Х А, единовременной выгрузкой продукта. Х А С К τ τ τ τ l τ В уравнении ( o ) слагаемое ( o ), U U так как система закрытая. Следовательно,. X X X dx Предположим, что в этом реакторе идёт реакция первого порядка. ; X dx ln( X ) X ln X X ln С
40 Реакторы непрерывного действия. Характеризуются непрерывным вводом исходных реагентов при непрерывном выводе получаемых продуктов. В соответствие с классификацией зависимости от режима движения реакционной среды, РПД подразделяются на: — реакторы вытеснения; — реакторы смешения. В таких реакторах осуществляется стационарный режим осуществления процесса. Реактор идеального вытеснения (РИВ). -d X dx Допущения для модели идеального вытеснения: du K ) в РИВ каждый элемент объёма реакционной массы движется вдоль оси реактора, не смешиваясь с предыдущими и последующими объёмами, т.е. осуществляется поршневой режим движения элемента объёма. В реальности этот режим не соблюдается. l ) состав элемента объёма последовательно не изменяется при движении вдоль оси реактора, вследствие прохождения химической реакции 3) время пребывания каждого элемента объёма в реакторе одинаковое l 4) гидродинамический режим в реакторе вытеснения характеризуется тем, что каждый элемент объёма движется только в одном направлении, т.е. полностью отсутствует обратное перемешивание. Это значит, что по сечению реактора предполагается постоянство всех технологических параметров: С,, 5) реактор не имеет конструктивных приспособлений для перемешивания и характеризуется большим отношением длины к диаметру. В целом, все эти допущения приводят к идеальности структуры движения потока в реакторе. N ( o ) U Так как технологическая переменная изменяется в пространстве, записываем уравнение материального баланса для элемента объёма du с последующим интегрированием по всему объёма реактора.
41 С учётом X и при условии, что степень превращения увеличивается в каждом элементе объёма, уравнение закона сохранения для объёма du : X ( X dx ) du dx du U K du X U dx X U dx ; — среднее время пребывания реагента в реакторе. Вследствие принятых допущений, каждый элемент объёма может быть рассмотрен как реактор периодического действия, время пребывания реагентов в котором равно среднему времени пребывания элемента объёма в реакторе. Если в РИВ осуществляется реакция первого порядка. ; X dx ln( X ) X С X Если реакция параллельная. S d d А Так как ( ) X ( dx X ( ) ) ln( X ) Реактор идеального смешения (РИС). С С К Допущения: ) Считается, что в РИС исходная реакционная смесь мгновенно перемешивается с реакционной массой внутри реактора, приобретая такую же концентрацию, как и на выходе из реактора. Следовательно, во всех точках аппарата концентрации одинаковы.
42 С С К ) Так как концентрации одинаковы, то равны и скорости реакции во всех точках аппарата. 3) Реактор ёмкостного типа с перемешивающим устройством. Таким образом, в реакторе такого типа отсутствует изменение технологической переменной, как в пространстве, так и во времени. Поэтому от дифференциального метода можно отказаться. Составим уравнение материального баланса на весь аппарат в целом. ( o ) U X X U o U С X Если осуществляется реакция первого порядка. ; X X ( X ) X X ( ) ; l РПД РИВ U X Сравнение трёх типов реакторов. С dx X dx С К τ τ τ l С К ln( X ) ln( X ) l
43 РИС С X С С К С К X X l В сравнении с РПД, реакторы непрерывного действия всегда имеют преимущества по эффективности осуществления химической реакции (см. преимущества непрерывных процессов). То есть любую химическую реакцию выгоднее осуществлять в непрерывном режиме. Поэтому необходимо сравнить эффективность для РНД. Сравним время пребывания реагентов в РИВ и РИС для реакции первого порядка. РИС X РИВ ( X ) ln( X ) X РИС РИВ.5.5 РИС РИВ Выводы:. При любой степени превращения, время пребывания реагента в РИС всегда больше, чем в РИВ, следовательно, РИВ обладает большей эффективностью, чем РИС. U. Так как, то необходимый объём РИС всегда больше объёма РИВ при одинаковой.5.8 X конечной степени превращения. Если объёмы РИС и РИВ одинаковы, то при одинаковой производительности в РИВ мы достигнем большей степени превращения. U U ( РИС РИВ РИС РИВ ) тем больше, чем выше порядок реакции. Однако некоторые реакторы перемешивания широко применяются в химической технологии, особенно в виде каскада реакторов смешения. Объясняется это простотой конструкции реактора, доступностью узлов, лёгкостью регулирования параметров процесса, лёгкостью чистки аппарата в случае, когда реакции идут с отложением твёрдых осадков. Реакторы перемешивания широко используются в таких процессах как полимеризация, сульфирование, нитрование, производство пластмасс, каучуков. РИВ используются широко для осуществления газовых реакций.
44 Конечные концентрации и время пребывания в РИС и РИВ для некоторых типов химических реакций. Тип реакции Кинетическое уравнение РИВ РИС (РПД) d d ) ln( X С X X d d С a a a d d Если М, М, то X М X М М ) ( ln Если М=, то X X Если М, то X M X X ) )( ( Если М=,то X X ) ( S d d d d S d d ( ) С ) ( ) ( S S
45 S d d d d S d d С ; max ln ) ( S ; max ; max ] [ ) )( ( ) )( ( S ; max
46 Каскад реакторов идеального смешения. В промышленности по технологическим соображениям часто требуется обеспечить осуществление реакции при интенсивном перемешивании и такую степень превращения, которую в единичном реакторе смешения достичь невозможно. В таких случаях используют цепь последовательно соединённых РИС, то есть каскад. С С К =С С К =С 3 С К С С С К =С С К =С 3 С К m, m число реакторов С l С С К l С С К Если суммарный объём РИС, включенный в каскад, будет равен объёму РИВ, то при m степень превращения для m реакторов будет равна
47 степени превращения РИВ. Чем больше ступеней изменения концентрации, тем каскад реактора ближе к режиму РИВ.
48 4. РЕАЛЬНЫЕ ХИМИЧЕСКИЕ РЕАКТОРЫ. Отличием реальных химических реакторов от моделей идеальных является отсутствие в них идеальной структуры движения потока, то есть имеет место обратное продольное перемешивание, приводящее к искажению тех допущений, при которых были составлены математические модели. Причины не идеальности реальных реакторов: ) вследствие конструктивных недостатков в реальных реакторах могут возникать застойные зоны, что приводит к тому, что элементы объёма реакционной смеси находятся в реакторе разное время, что приводит к различной скорости реакции в различных точках аппарата. ) Часть реакционной смеси может не принимать участия в реакции из-за наличия внутри реакции байпасов (проскоков). 3) Наличие трения при движении реакционной смеси. 4) В реакторе наряду с застойными зонами могут иметь место зоны Рис.4.. Застойные зоны. циркуляции. Критерием приближением реального реактора к той или иной модели идеального служит критерий Боденштейна это отношение вещества, переносимого конвективным потоком к количеству вещества, переносимого за счёт продольной диффузии. VL O, (4.) Д если В о стремится к бесконечности, то реактор будет относится к РИВ, и, наоборот, при В о стремящемся к нулю, реактор РИС. Практически граничная величина данного критерия равна, если ниже то РИС, выше РИВ.
49 4..Масштабирование реальных химических реакторов. В ходе проектирования химического производства, по окончании изучения микро- и макрокинетики процесса, после выбора типа будущего химического реактора возникает необходимость в использовании этих данных для проектирования промышленного аппарата, то есть переносу данных моделей на натуру, что называется масштабированием. Сущность сводится к нахождению условий, при которых возможен непосредственный перенос опытных данных, полученных для данной системы с одного масштаба на другой, то есть с модельной установки на аппарат промышленного масштаба. Масштабирование физических и химических процессов, протекающих в аппарате можно осуществлять с применением принципов физического моделирования. При физическом моделировании используют критерий геометрического подобия, физического подобия и химического подобия, которые могут быть получены из соответствующих дифференциальных уравнений, описывающих рассматриваемый процесс или на основании анализа размерностей, определяющих ход этого процесса. Необходимые для проектирования данные находятся при исследованиях на полупромышленных и опытных установках. Так как для описания строго математических процессов, происходящих в реакторе необходимо решение системы дифференциальных уравнений. Цель применения физического моделирования это достижение в большем масштабе тех оптимальных условий, которые получены на меньшем масштабе. На ход превращений в реакторе оказывают влияние: движение материальных потоков, процессы переноса массы, тепла и, собственно, химическая реакция, поэтому для достижения полного подобия модели и натуры необходимо соблюдать следующее: ) геометрическое подобие. Геометрическое подобие выражают симплексами (отношение длины аппарата к характерному линейному размеру — l/d); ) гидродинамическое подобие. Критериями в данном случае могут быть критерии Рейнольдса (характеризует отношении сил инерции к силам вязкостного трения), Эйлера ( характеризует отношение силы внешнего давления к силе инерции), Грасгофа (характеризует режим движения теплоносителя при свободной конвекции). Vd e ; (4.) 3) подобие процессов теплопереноса. В данном случае используют критерий Нуссельта (характеризует подобие процессов теплопереноса на границе поток стенка). l Nu ; (4.3)
50 4) подобие процессов массопереноса. Критерием является диффузионный Нуссельт (характеризует отношение переходящего потока к диффузионному потоку). l Nu ; (4.4) 5) химическое подобие. Критерии химического подобия могут быть найдены из общих уравнений массовых и тепловых балансов системы, в которой дополнительно осуществляется ещё и химическая реакция, то есть из уравнения Дамкелера. V dvä grad Д dv ; (4.5) V x V x y V y z z Vgrad V l ; (4.6) dv x y z Ä l Ägrad Ä ; (4.7) l V Äa ; (4.8) Физический смысл: отношение потока компонента, образующегося вследствие химической реакции к конвективному потоку компонента. l Дa, (4.9.) Д Физический смысл: отношение потока компонента, образующегося вследствие химической реакции к диффузионному потоку компонента. Да и Да обеспечивают подобие массопереноса, вследствие химической реакции. H l V T p Да 3, (4.) Физический смысл: тепловой поток, образующийся вследствие химической реакции к конвективному тепловому потоку. H l Да4, (4.) T Физический смысл: отношение потока тепла, образующегося вследствие химической реакции к диффузионному потоку тепла. Для достижения полного подобия физических и химических процессов, происходящих в модели и в натуре, необходимо и достаточно равенство величин критериев физического и химического подобия, в сходных точках пространства.
51 4..Типовые конструкции химических реакторов. В следствии больших различий в химических реакторах их классификация достаточно условна, тем не менее за основу классификации принимают следующие: ) режим движения реакционной среды (по массовым потокам), ) вид поверхности теплообменника, 3) фазовое состояние реагентов и продуктов. По конструктивным формам основные типы реакторов группируются так:. трубчатые (по типу теплообменника),. колонные (включая аппараты с неподвижным и движущимся слоем), 3. реакторы типа реакционной камеры с перемешивающим устройством и без него, 4. прочие печи (типы). Типы конструкций для проведения гетерогенных процессов: — реакции Г/Ж, Г/Ж/Т (барботажные колонны, колонны с насадкой), — реакции Ж/Т (аппараты с неподвижным слоем, аппараты со взвешенным слоем аппараты с мешалками), — реакции Г/Т (аппараты со взвешенным кипящим слоем, аппараты с фильтрующим слоем, аппараты с движущимся твёрдым слоем).
52 4.3.Реакторы для проведения гомогенных реакций в жидкой фазе. Особенность: в зависимости от условий осуществления химической реакции такие процессы могут быть проведены в реакторах периодического, полупериодического и непрерывного действия. Периодические реакторы, как правило, используются в экспериментальных, опытных и малотоннажных производствах. Реакторы непрерывного действия используются для крупнотоннажных производств. Для жидкофазных реакций в большинстве случаев используют реакторы смешения, реже вытеснения. Это связано с тем, что молекулярная диффузия в жидкой фазе протекает медленно и необходимо интенсивное перемешивание реагентов (чтобы увеличить эффективность). На конструкцию реакторов оказывает большое влияние вязкость реагентов и продуктов (обычное перемешивающее устройство используется в случае небольшой вязкости). Рис.4.. Реактор с пропеллерной мешалкой: вал; мешалка; 3 водяная рубашка. Рис Реактор с пневматическим перемешиванием. барботер; выход воздуха и загрузка жидкости; 3 вывод продукта Рис.4.4. Установка со струйноцуркуляционным смешением: реактор струйно-эжекторного смешения; приёмник; 3 теплообменник. Рис Схема трубного реактора типа труба в трубе: внутренняя труба; внешняя труба; 3 колено
53 4.4.Реакторы для проведения реакций в системе газ/жидкость. Реакторы для проведения такого рода процессов, как правило, конструируются по типу адсорбционных аппаратов. Они просты в эксплуатации, в основном, это реакторы непрерывного действия, где газ непрерывно контактирует с жидкой фазой. Поскольку реакция идёт на поверхности раздела фаз, то важным способом интенсификации процесса является получение высокоразвитой поверхности раздела фаз. Характер поверхности раздела может быть разным, это либо непрерывный характер (в этом случае плёночные или насадочные реакторы), либо поверхность прерывистая (в данном случае реакторы пенные, различные типы барботажных колонн). В данных реакторах протекают гетерогенные процессы Ж Г Г Ж Рис Схема устройства барботажного реактора с колпачковыми тарелками и внутренними переливами (а), и с ситчатыми тарелками. Колпачковая тарелка; колпачок; 3 переливная труба; 4 патрубок для газа;5 ситчатая тарелка(решетка); 6 сливной порог Рис.4.7. Схема барботажного реактора с насадкой. На рис приведён РИВ, хотя отдельно на тарелках происходит смешение, а на рис.4.7. аппарат в целом РИВ. Реактор с пневматическим перемешиванием также подходит для осуществления данных реакций.
http://docplayer.com/50251168-Kurs-lekciy-b3-b-5-obshchaya-himicheskaya-tehnologiya-himicheskaya-tehnologiya.html