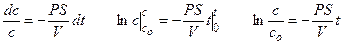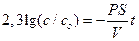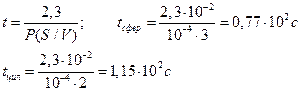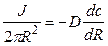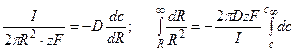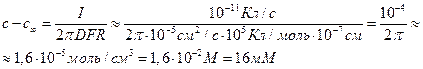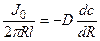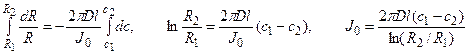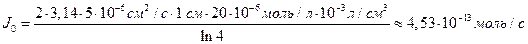Диффузия ионов и неэлектролитов
Диффузия представляет собой спонтанное движение растворенного вещества в сторону понижения концентрации. Диффузионные законы определяют движение незаряженных веществ в объеме (на любых расстояниях при отсутствии конвекции), перенос ионов в неперемешиваемых слоях у поверхности мембран, а также движение ионов на малых расстояниях.
Формула Стокса–Эйнштейна связывает коэффициент диффузии D с температурой T, вязкостью среды η и радиусом диффундирующих частиц r (k – константа Больцмана). Например, вязкость воды при 20°С составляет ηH2O= 10 –3 Па∙с (1 Па = 1 Н/м 2 ).
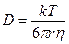
Пользуясь (4.1), можно оценить коэффициент диффузии в воде для малых молекул с радиусом
0,2 нм (10 –5 см 2 /с) или для молекул другого размера. На движение ионов в растворе влияет электрическое поле. Коэффициент диффузии иона зависит от его заряда (z):
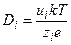
где u – подвижность иона, имеющая размерность м 2 ·с –1 ·В –1 (см 2 ·с –1 ·В –1 ), е – заряд электрона. Например, подвижности ионов K + и Na + равны 7,6·10 –4 и 5,2·10 –4 см 2 ·с –1 ·В –1 , соответственно. Из (4.1) и (4.2) получаем уравнение для расчета подвижности иона по его радиусу и заряду.
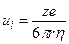
Подвижность численно равна скорости движения ионов (см/с) при напряженности поля 1 В/см.
Законы Фика описывают скорость диффузии вещества, а также пространственное распределение концентрации диффундирующего вещества в различные моменты времени.
Первый закон Фика связывает поток вещества J с коэффициентом диффузии D и градиентом концентрации (dc/dx). Размерность потока – моль∙см –2 ∙с –1 ).
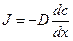
В случае диффузии через тонкую мембрану
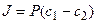
где P=Dg/h – проницаемость, h – толщина мембраны, g – коэффициент распределения вещества между водной и липидной фазами, а 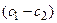
Второй закон Фика описывает направление изменений концентрации вещества во времени (dc/dt) в зависимости от знака второй производной (d 2 c/dx 2 ), определяющей вогнутость или выпуклость профиля концентрации по координате x:
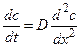
Из (4.6) в частности следует, что в случае одномерной стационарной диффузии (т.е. при dc/dt=0) профиль концентрации линеен: 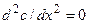
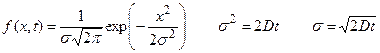
где x – координата, f(x,t) – функция распределения, σ – среднеквадратичное отклонение для нормального распределения вещества относительно исходной точки при x = 0, σ 2 – дисперсия, а t – время. Область, расположенная между координатами ±σ, содержит более 68% от общего количества диффундирующего вещества. Согласно уравнению Эйнштейна, величина σ, обозначаемая также 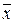
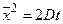
где 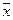
Пример 4.1. После инъекции в клетку некоторого вещества до концентрации co, клетку отмывают средой, не содержащей этого вещества. Какое время инкубации необходимо, чтобы внутренняя концентрация вещества понизилась в 10 раз, если проницаемость мембраны для этого вещества составляет 10 –4 см/с? Решить задачу для клетки сферической формы с диаметром 200 мкм и для цилиндрической клетки с диаметром 200 мкм и длиной 1 см.
Решение: При записи первого закона Фика учтем, что диффузия происходит через тонкую мембрану и, что концентрация во внешнем растворе равна нулю.
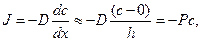
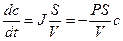
Решение этого дифференциального уравнения описывает кинетику изменения концентрации вещества внутри клетки:
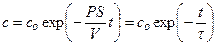
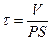
Уравнение решают методом разделения переменных и интегрирования по времени от нуля до t при соответствующем изменении концентрации от co до c.
Для ответа на вопрос задачи удобно перейти к десятичным логарифмам:
Отношение S/V определяется геометрией клетки. Для сферы и цилиндра оно составляет соответственно
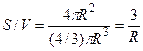
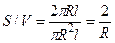
С учетом условия задачи c/co = 0,1 и R = 0,01 см, находим искомое время t:
Аналогичный подход используется для случаев, когда в момент времени t = 0 в наружный раствор добавляют проникающее вещество, которое начинает поступать внутрь клетки, причем наружная концентрация остается постоянной (co = const) из-за большого объема среды по сравнению с объемом клеток. В таком опыте моменту времени t = 0 соответствует внутренняя концентрация с = 0, а произвольному моменту времени t соответствует внутренняя концентрация с. В этом случае интегрирование дифференциального уравнения приводит к следующему решению:
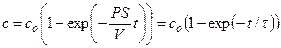
Пример 4.2. Предположим, что через калиевый канал с устьем R = 10 Å протекает ток I силой 10 пА (рис. 4.1.). При этом концентрация К + в устье повышается по сравнению с объемом раствора. Найти концентрацию в области устья канала, если концентрация К + в объеме составляет 10 мМ. При расчете принять, что коэффициент диффузии К + в воде
Решение: На выходе из канала суммарный поток переносимых ионов диффундирует во всех направлениях, ограничиваемых полусферой. Выделим элемент поверхности полусферы и запишем поток через единицу поверхности, пользуясь первым законом Фика.
Суммарный поток вещества J связан с электрическим током I соотношением 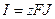
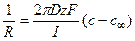
Следовательно, перепад концентрацией между устьем канала и объемом раствора составит
Соответственно, концентрация в устье канала cx составит 26 мМ.
Пример 4.3. Концентрация Са 2+ в питательном растворе на расстоянии 300 мкм от поверхности корня составляет 100 мкМ, а у поверхности корня с диаметром 200 мкм – 80 мкМ. Оценить диффузионный поток Са 2+ к поверхности корня на 1 см его длины (моль·с –1 ), а также поток Са 2+ на единицу поверхности корня (моль·см –2 ·с –1 ) в предположении, что коэффициент диффузии D = 5·10 –6 см 2 /с.
Решение: Обозначим суммарный диффузионный поток для сегмента корня длиной l символом J0. Поток Са 2+ направлен радиально из объема среды к центру корня. Поток через единичный участок цилиндрической поверхности неперемешиваемого слоя на расстоянии R от центра корня составит J0/(2πRl). Запишем уравнение первого закона Фика в радиальных координатах:
Решая уравнение, находим формулу для расчета потока по концентрациям на разном удалении от центра корня (концентрации с1 и с2 для радиальных расстояний R1 и R2).
В расчете на единицу поверхности корня поток составит
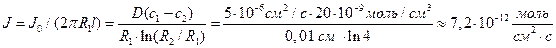
Кинетика диффузионно-контролируемых химических реакций
Кинетика диффузионно-контролируемых химических реакций
1. Основные понятия кинетики диффузионно-контролируемых химических реакций
Феноменологическое описание методов и проблем диффузионной кинетики довольно широко и полно обсуждено в ряде отечественных и зарубежных монографий 2. В этих работах основное внимание уделено формулировке уравнений переноса в рамках онзагеровской термодинамики и методам решения уравнений диффузионной кинетики.
Большинство проводимых в настоящее время исследований реакций в жидких растворах основано на предположении о применимости к описанию диффузии молекул в растворе макроскопических законов диффузии Фика. Диффузия молекулы в растворе, рассматриваемая как процесс хаотических блужданий, после большого числа блужданий описывается законами Фика, если в уравнении Фика заменить концентрацию функцией плотности вероятности. Экспериментально обнаружено, что законы Фика становятся применимыми уже по прошествии 10
13 с после того, как молекула начала диффундировать. Это позволяет заключить, что уравнения диффузии, выведенные из законов Фика, являются хорошим приближением для описания кинетики диффузионных процессов.
Теория кинетики реакций, контролируемых диффузией, была впервые сформулирована Смолуховским. Ее основная идея заключается в том, что скорость реакции может определяться медленным диффузионным движением, необходимым для сближения партнеров по реакции, после чего реакция протекает почти мгновенно. Из многих применений этой теории упомянем рост коллоидных или аэрозольных частиц, осаждение, катализ и тушение флуоресценции. Она была также применена к исследованию горения, в котором роль диффундирующих частиц играет окислитель, распространяющийся в среде – капле горючего. Теория Смолуховского была усовершенствована Дебаем, который дополнительно ввел в нее учет возможных взаимодействий. Наиболее общая математическая формулировка этой теории дана Вилемским и Фиксманом [7], которые применили ее для описания цепных реакций в полимерах [8].
2. Диффузия. Законы Фика
Диффузией называется процесс переноса вещества, обусловленный самопроизвольным выравниванием его концентрации в первоначально неоднородной системе. В результате процесса диффузии устанавливается одинаковый химический потенциал каждого компонента во всех элементах объема системы. Если в пределах всей системы температура одинакова, то диффузия приводит к самопроизвольному выравниванию концентраций. В тех случаях, когда в системе имеется температурный или какой-либо другой градиент, влияющий на значение химического потенциала вещества, диффузия может привести даже к еще большему увеличению разности концентраций.
Процессы диффузии описываются законами Фика. Первый закон Фика, который описывает стационарную диффузию, устанавливает связь между количеством вещества 


В более общем виде диффузия характеризуется потоком Ji, равным массе вещества, проходящей за единицу времени через условную единичную поверхность, располагаемую перпендикулярно направлению потока:

где – масса i вещества, переносимая за время через поверхность, площадь которой равна S; Di – коэффициентом диффузии. Знак минус перед 
Второй закон Фика описывает изменение общей концентрации диффундирующего вещества в каждой точке среды:

где 

В декартовых координатах оператор Лапласа имеет вид:

В цилиндрических координатах:

В сферических координатах:

Выражение (4) фактически является уравнением материального баланса
Для диффузии в одном направлении (одномерная диффузия) второй закон Фика записывается в следующем виде:

Отметим, что величина наблюдаемого потока зависит не только от процесса диффузии, но и от действия на частицы внешних сил. Если внешняя сила Fх, направленная вдоль оси х, сообщает частице скорость wx, то возникает дополнительная составляющая потока, равная ci ∙wx. С ее учетом поток вещества определяется уравнением:

В этом же случае вместо уравнения, выражающего второй закон Фика, применяется уравнение Фоккера-Планка:

Коэффициент диффузии является константой скорости диффузионного процесса. Он численно равен количеству вещества (в молях), проходящему через единицу площади (1 см2) за единицу времени (1 с) при градиенте концентрации, равном единице (т. е. изменению концентрации в 1 моль/см3 на расстоянии в 1 см). Размерность коэффициента диффузии:


Величина коэффициента диффузии чаще всего оценивается из экспериментальных данных, однако его можно оценить из ряда известных соотношений.
Коэффициент диффузии молекул в газовой фазе равен:

где 


Коэффициент диффузии для кристалла, в котором диффундирующее вещество скачками перемещается по узлам правильной решетки, можно оценить по соотношению:

где 

Для оценки коэффициента диффузии сферических частиц в растворах, размеры которых гораздо больше, чем у молекул растворителя, применяется формула Стокса–Эйнштейна:

где R — универсальная газовая постоянная; T— температура; NA — число Авагадро; 

Коэффициент диффузии в сильно разбавленном растворе электролита
можно рассчитать по соотношению:

rде R =8,314 Дж/(моль∙К)– газовая постоянная; T–температура; 


Зависимость коэффициента диффузии от температуры описывается формулой:

где 
3. Методы решения уравнений Фика
Решение стационарного уравнения Фика сводится к решению дифференциального уравнения:
которое справедливо при условии независимости распределения концентрации вещества во времени. Искомое решение должно удовлетворять двум граничным условиям. Граничные условия могут быть заданы:
· в форме Дерихле

то есть в виде величины концентрации 

· в форме Неймана

т. е. в виде значения диффузионного потока через границу в точке 
· в интегральной форме

в том случае, если количества вещества в изучаемом объекте известно.
б) В случае нестационарной диффузии необходимо решать уравнение:

В этом случае кроме граничных условий искомое решение должно удовлетворять начальному условию:

Выбор граничных условий определяет и конечное выражение, полученное при решении уравнения (1.20). Рассмотрим несколько случаев.
1) Граничное условие Смолуховского.
Идея метода Смолуховского сводится к учету химической реакции посредством введения соответствующего граничного условия при решении уравнения (1.20). Так называемое граничное условие Смолуховского относится к случаю, когда молекулы А и В при столкновении немедленно вступают в реакцию.
Рассмотрим вязкую среду, содержащую в единице объема С0 шарообразных частиц одинакового радиуса RA. Пусть движение каждой частицы носит броуновский характер и может быть описано диффузионным уравнением с коэффициентом диффузии DА. Полагаем, что при столкновении двух частиц происходит «мгновенная» реакция, выводящая обе частицы из рассматриваемой системы, т. е. изучается бимолекулярная необратимая реакция А+А
Для решения этой задачи Смолуховский использует прием, состоящий в предварительном рассмотрении новой вспомогательной задачи. Представим себе, что одна из частиц (ее радиус RA) закреплена, а остальные частицы, не сталкивающиеся в процессе броуновского движения, могут исчезнуть только за счет попадания на сферу радиуса RA – поверхность выделенной частицы. Будем считать, что поверхность сферы действует как идеальный сток (поглощающий экран), т. е. любая попавшая на эту сферу частица мгновенно поглощается. При этом возможны различные предположения о самой выделенной частице – либо она выбывает из системы частиц при столкновении с другой частицей, либо поглощает прибывающие частицы, не выбывая из системы. Именно последний случай и рассматривает Смолуховский. При этом закрепленная частица действует как сток бесконечной емкости (эта частица – ее обозначим символом В – фактически является частицей другого вида, нежели подвижные частицы А), причем число стоков должно быть много меньше полного числа частиц А. Поэтому реакция броуновских частиц А с частицами-стоками В является уже мономолекулярной:
А + (В)
Соответствующую задачу о диффузии частиц к стокам бесконечной емкости можно рассматривать макроcкопически, и тогда она сводится (при малой концентрации стоков В, когда «воздействия» их на систему частиц А можно считать независимыми) к задаче о поглощающем центре. Изложим эту задачу.
Локальная концентрация частиц А в окрестности поглощающей сферы
с (r,t) будет зависеть только от времени t и расстояния r между центром поглощающей сферы и центром рассматриваемой частицы. Распределение концентрации частиц А будет описываться уравнением для нестационарной диффузии:
с начальным условием


где R — сумма радиусов подвижной и неподвижной частиц.
Поскольку поглощающая частица является идеальным стоком, в качестве граничного условия можно принять


Второе граничное условие


не адекватно сформулированной выше задаче, поскольку, вообще говоря, число частиц в системе убывает со временем. Тем не менее, рассмотрение такой модельной задачи позволяет найти подход к решению исходной задачи, так как при малой концентрации ловушек резервуар активных частиц можно считать неисчерпаемым.
Если система является сферически-симметричной, то для r>R, решение уравнения (1.23) дает изменение концентрации каждого компонента в форме соотношений:


где 

Чтобы решить уравнение (1.28), положим сА=сАr. Это позволяет написать вместо уравнения (1.28):

Решение уравнения (1.29) при начальных и граничных условиях (1.24) – (1.26) методом Лапласа в изображениях имеет вид:

где величина 



Решение этого уравнения методом Лапласа позволяет найти концентрацию сВ (подробное решение приведено в [9] ):

Наибольший интерес представляет выражение для потока J(t) частиц через поглощающую сферу радиуса R:
Таким образом, скорость бимолекулярной диффузионно-контролируемой реакции, равное числу столкновений между молекулами А и В в единицу времени описывается выражением:

где 


Как следует из уравнения (1.33), при установлении стационарного режима (

При установлении стационарного состояния концентрации компонентов будут равны:

2) Радиационное граничное условие.
В случае когда столкновения между молекулами А и В могут не приводить к реакции, обычно предполагается, что скорость реакции на реакционной сфере (радиусом Rс) равна потоку молекул через поверхность этой сферы. Это граничное условие называется радиационным.
В этом случае мы по-прежнему имеем дело с дифференциальными уравнениями (1.27) и (1.29), а следовательно, и с решением 


Подстановка выражения (1.30) в уравнение (1.37) дает:

Отсюда следует, что для 

Применяя к уравнению (1.39) обратное преобразование Лапласа, находим:

где 
С учетом того, что 

Подстановка выражения (1.41) в уравнение (1.27) дает:

Интегрируя это уравнение, находим


где 


В случае, когда отношение у мало, в приближении первого порядка по 

Это показывает, что, когда скорость химической реакции мала по сравнению со скоростью диффузии, мы имеем дело с обычной кинетикой реакции первого порядка. И наоборот, когда 
Проведенный выше вывод справедлив только для реакций между сферически симметричными молекулами или атомами.
4. Вращательная диффузия
Помимо рассмотренной выше поступательной диффузии, обеспечивающей равномерное распределение концентрации в объеме системы, существует также вращательная диффузия, приводящая к равномерному распределению осей частиц по координатным углам.
Вращательную (угловую) диффузию описывает второе уравнение Фика (1.3) с оператором Лапласа в сферических координатах. Угловая часть
оператора в случае аксиально-симметричных задач (

где 



Для ансамбля случайно ориентированных частиц 

Время вращательной корреляции молекул при вращательной диффузии равно:

Вращательная диффузия молекул может влиять на скорость химической реакции за счет взаимной ориентации молекул в комплексе столкновения. Если время разделения пары при поступательном движении больше времени вращательной корреляции молекул в паре

где 

Если время разделения пары за счет поступательного движения много меньше времени вращательной корреляции молекул в паре, то скорость реакции зависит от ориентационного фактора 

Тема 2. Описание кинетики диффузионно-контролируемых реакций
1. На основе теории активных столкновений
Рассмотрим механизм реакций в растворах на основе теории столкновений. Механизм реакций в растворе значительно сложнее, чем в газе, так как молекулы исходных веществ сталкиваются не только между собой, но и с молекулами растворителя. Поэтому двум реагирующим молекулам трудно встретиться. Для этого они должны продиффундировать сквозь слой растворителя. Но зато, если они сблизятся и образуют так называемую пару столкновений, то им труднее разойтись, так как этому препятствуют окружающие их молекулы растворителя (так называемый клеточный эффект).
Этот сложный механизм можно заменить более простой кинетической схемой, состоящей из двух последовательных стадий. Например, для элементарной бимолекулярной реакции в растворе

где первая химическая реакция протекает с константой скорости k1 в прямом направлении и с константой скорости k-1 в обратном направлении; (АВ) — пара столкновения; Р — продукт реакции (или один из продуктов); с1, с2, сз и с4 – концентрации соответственно веществ А, В (АВ) и Р в молях в 1 м3 раствора.
Для того чтобы образовалась пара столкновения (АВ), нужно, чтобы вещества А и В продиффундировали навстречу друг другу через слой растворителя, который их разделяет; поэтому константа скорости k1 имеет диффузионный характер. При стационарном протекании процесса скорость образования и распада пары столкновения одинакова и


и скорость реакции равна

Рассматривая эту реакцию как простую бимолекулярную (без учета пары столкновения)

Получаем формальное выражение для скорости реакции:

Сравнивая правые части в уравнениях (2.4) и (2.6), получаем выражение для константы скорости:

В первом предельном случае при 

где 
Во втором предельном случае при

Лимитирующей стадией является диффузия веществ А и В навстречу друг другу через раствор. Во втором предельном случае имеется простая связь между константой скорости k3 и коэффициентами диффузии в растворе реагентов А и В.
Предположим сначала для простоты, что молекула А неподвижна, а молекула В диффундирует к ней через сферический слой раствора (рис. 2.1).
Тогда поток диффузии вещества В через поверхность сферы радиуса r к молекуле А определяется формулой:

где D2 – коэффициент диффузии вещества В; 


Рис.1.1. Схематическое изображение диффузионного механизма кинетики реакции в растворе.
Чтобы определить поток J, разделим переменные r и с2 и проинтегрируем уравнение (1.10) от R* до ∞ и от 0 до с2:

где R* — расстояние между молекулами А и В при образовании пары столкновения; полагаем, что на расстоянии меньше R с2 = 0.
Для простоты полагаем, что раствор достаточно разбавленный и в просессе диффузии молекул В к молекуле А через слой раствора они не встречаются с другими молекулами А и поэтому поток J имеет постоянное значение.
В результате интегрирования (2.11) получаем:

Скорость реакции, контролируемая диффузией, определяется скоростью потока молекул В к молекуле А. При этом скорость реакции w равна числу пар столкновений, которые образуются в 1 с в 1 м3 раствора:

где 
Подставляя значение J из (2.12) в (2.13), определяем скорость диффузионно контролируемой химической реакции как:

где 
Приравнивая правые части уравнений (2.14) и (2.6) получим формулу для расчета k3:

Это выражение можно преобразовать, если для расчета D1 и D2 использовать соотношение Стокса-Эйнштейна:



где 


где k – постоянная Больцмана.
Таким образом, в рассмотренном предельном случае (
2. Влияние растворителя на скорость реакций в растворе. Солевые эффекты.
При применении теории абсолютных скоростей реакции к кинетике реакций в растворах нужно учитывать влияние растворителя на реагирующие частицы, так как при этом изменяются энергия активации, стерический фактор и трансмиссионный коэффициент. С помощью формального термодинамического подхода можно приближенно учесть влияние растворителя на скорость реакции через коэффициенты активности реагентов.
Рассмотрим сначала влияние растворителя на элементарную реакцию между молекулами. При этом учтем, что закон скорости связан с концентрациями реагирующих веществ, а константа равновесия – с активностями молекул. Поэтому основное уравнение теории абсолютных скоростей реакций будем выражать через концентрации.
Для бимолекулярной элементарной реакции

константа скорости равна:

Но термодинамическая константа равновесия в растворе выражается через активности:


Подставляя уравнение (2.22) в (2.20) получаем:

При 

где 

С этим случаем мы встречаемся, например, когда одна и та же реакция может проводиться как в газовой фазе (k0), так и в растворе (k).
Если исходные вещества А и В являются молекулами и, кроме того принять 

означает, что для бимолекулярных реакций между молекулами константы скорости реакции при проведении ее в газовой фазе и в растворе различны.
Для мономолекулярной реакции

рассуждая аналогично, получаем выражение: 
рассуждая аналогично, получаем выражение:

Если вещество А находится в растворе в молекулярной форме и принимая 
Опыт во многих случаях подтверждает теорию. Например, мономолекулярная реакция разложения оксида азота (
В случае бимолекулярных элементарных реакций перенос реакции из газовой фазы в раствор, а также изменение природы растворителя, как правило, заметно влияют на константу скорости реакции в соответствии с предсказанием теории абсолютных скоростей реакций.
Важное подтверждение теория абсолютных скоростей реакций получила для реакций между ионами в растворах сильных электролитов, так как в этом случае коэффициенты активности могут быть вычислены из теории сильных электролитов Дебая – Хюккеля. Если раствор электролита разбавленный, то коэффициенты активности можно выразить приближенно с помощью предельного закона Дебая — Хюккеля:

где А — теоретический коэффициент, который для водных растворов равен 0,509; 
Если в реакции (1.26) исходные вещества А и В являются ионами с зарядами 





Таким образом, из теории активированного комплекса следует, что если в бимолекулярной реакции в растворе участвуют два иона с одинаковыми зарядами (

Биологические мембраны. Биоэлектрогенез (лекция 5)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Описание презентации по отдельным слайдам:
Лекция 5
Биологические мембраны; Биоэлектрогенез
Ростов-на-Дону
2012
Содержание лекции №5
Биологические мембраны и их физические свойства.
Уравнения простой диффузии и электродиффузии. Уравнение Фика. Уравнение Нернста-Планка.
Виды пассивного транспорта.
Понятие об активном транспорте ионов через биологические мембраны.
Потенциал покоя и потенциал действия
и их физические свойства
В каждой клетке есть плазматическая мембрана, которая ограничивает содержимое клетки от наружной среды, и внутренние мембраны, которые формируют различные органоиды
клетки:
митохондрии,
Что есть мозг клетки?
Клетка- мельчайшая структурная единица живого организма
лизосомы
и т.п.
Она состоит из органических молекул, которая имеет толщину 6-10 нм и видима только посредством электронного микроскопа.
Биологическая мембрана (БМ) – это клеточная граница, которой свойственна полупроницаемость.
БМ –это глико – липо — протеидный комплекс
Как понимать полупроницаемость?
Что она дает?
Схема строения клетки , реконструированная по данным электронной микроскопии.
ВОПРОС:
Через биологическую мембрану происходит обмен:
вещество
энергия
клетка
окружающая среда
in
out
БМ – это кожа клетки
in
Клеточные сообщества существуют только благодаря передаче информации от клетки к клетке. Если информационные процессы угнетены
онкозаболевания организм нажимает кнопку на самоуничтожение.
информация
Общие
Механическая
Барьерная
Матричная
Специфические
Транспортная
Рецепторная
Генерация
БП
Принимает участие в
информационных
процессах в живой
клетке
Функции биологических мембран
Структура биологических мембран
БМ = липиды + белки
40%
Из липидной части наиболее важны для структуры фосфолипиды.
Основа фосфолипида – трехатомный
глицерин. К нему присоединяются жирные кислоты.
0,8 нм
1/4
3/4
Полярная часть, где фосфатная группа. «Любит воду». Гидрофильная часть.
Гидрофобная часть. «Хвосты» не любят взаимодействовать с водой.
Физико-химическое свойство фосфолипидов – амфофильность.
Насыщенная жирная кислота
Ненасыщенная жирная кислота
В воде молекулы фосфолипидов автоматически собираются в бислой (bilayer)
Бислой – это
каркас для БМ
Самосборка
Самовосстановление
Мембранные белки (большие глобулы).
На 1 молекулу белка приходится 80-90 молекул фосфилипидов.
Электростатические
взаимодействия
Периферические
Пример: ферменты, рецепторы
Схема расположения молекулы родопсина в биологической мембране (α – спираль, пронизывающая 7 раз фосфолипидный каркас)
Интегральные белки
Периферические белки
Какие белки легче удалить? А для каких нужен детергент?
Схематическое строение БМ
Поверхностные белки
толщина мембраны
Липидный бислой
Различные формы молекулярного движения в БМ
Вращение
Латеральная
диффузия
Перемещение молекул в пределах одной стороны бислоя.
ФЛИП-ФЛОП= перемещение молекул поперек БМ.
Один раз в 2 недели.
В 109 медленнее
Физические свойства БМ
Текучесть ≈ const
Жидкокристаллическая
структура
С = 1 мкФ/см2
БМ — конденсатор
Электросопротивление
105 Ом/см2
гораздо больше, чем у
технических изоляторов
Поверхностный заряд
Отрицательный.
Препятствует слипанию
клеток крови
εлипидов = 2,2
Плотность липидного
бислоя 800 кг/м3 .
Меньше, чем у H2O
Вязкость
η = 100 мПа٠с
(оливковое масло)
Модуль упругости
Е=109 Па
1. Жидкокристаллическая структура
Кристалл
твердый
жидкий
Жидкокристаллическая структура (ЖК)
транспорт
скелет
Фазовый переход при температуре 370 С
Обусловлена необычайно высокой подвижностью мембранных компонентов.
Жидкий кристалл Твердый кристалл
Мембрана сохраняется в ЖК состоянии благодаря температуре клетки и химическому составу жирных кислот.
2. Текучесть ≈ const
3. Вязкость
БМ как ЖК структура характеризуется определенной вязкостью.
η = 100 мПа٠с
(оливковое масло)
На вязкость клеточных мембран влияет содержание в них холестерина.
При повышении содержания холестерина
вязкость . Исчезают
транспортные свойства.
Как влияет?
Бляшки холестерина
в артериях
4. Поверхностный заряд на мембране.
Продуктивность клетки, т.е. ее энергия является измеряемой величиной. Здоровая клетка обладает напряжением 70-90 мВ.
В зависимости от здоровья, напряжение снижается до 20-30 мВ В связи с этим мы чувствуем усталость и изнуренность.
Вся патология на мембранном уровне!
Уменьшение вязкости БМ – причина разжижжения БМ при злокачественных опухолях – при лейкозе.
Вязкость меняется при многих заболеваниях, под действием ионизирующего Э/М излучения , ряда фармпрепаратов.
Вязкость БМ уменьшается при тиреотоксикозе,
а также под действием наркотических веществ, например, хлороформа.
Две стороны мембраны, наружная и внутренняя, различаются и по составу и по функциям.
Эта структурная асимметрия мембран приводит к векторной направленности процессов переноса.
Академик Владимиров Ю.А.
Пассивный транспорт – это перенос веществ через биологическую мембрану без затраты энергии.
Транспорт «под горку»- down hill
Диффузия молекул
Электродиффузия ионов
Уравнение
ФИКА
Уравнение НЕРНСТА -ПЛАНКА
ВИДЫ ПАССИВНОГО ТРАНСПОРТА
Диффузия –это самопроизвольный процесс проникновения массы вещества из области большей концентрации в область с меньшей концентрацией в результате теплового хаотичного движения молекул.
Параметры диффузии
ПЛОТНОСТЬ
ПОТОКА
ВЕЩЕСТВА:
in
out
Уравнения простой диффузии и электродиффузии
Плотность потока
вещества – это количество вещества в единицу времени через единицу площади.
Математическое описание процесса диффузии дал физиолог Фик в 1855 г.
Уравнение Фика является основой конструирования ряда биотехнических систем, например, в аппаратах:
«Искусственная
почка»
Экстракорпорального кровообращения
описывает пассивный транспорт неэлектролитов
C out
C in
C out
C in
in
out
Плотность потока вещества через биологическую мембрану прямо пропорциональна градиенту концентрации
in
D – коэффициент диффузии [м2/с]
Коэффициент диффузии D зависит от природы вещества и температуры и характеризует способность вещества к диффузии.
U=Um NA
U= v/F
D=UmRT
Где — подвижность диффундирующих молекул, выраженная для моля.
Um
Так как
grad C определить трудно, то для описания диффузии веществ через мембрану используют более простое уравнение.
NA
-число Авогадро
R- универсальная газовая постоянная
Т – термодинамическая температура
Уравнение диффузии для мембраны
Где Р- коэффициент проницаемости
in
out
C in
C out
Это более простое уравнение предложено Коллендером и Берлундом.
Плотность потока вещества через биологическую мембрану прямо пропорциональна разности концентраций внутри и снаружи клетки.
Коэффициент проницаемости
C out
C in
где l – толщина БМ
D- коэффициент диффузии
К- коэффициент распределения между липидной и водной фазами.
Р – зависит от температуры, природы вещества, от свойств БМ, ее функционального состояния.
Нет проницаемости мембраны вообще, а есть разная проницаемость БМ для тех или иных веществ.
Уравнения электродиффузии
Перенос ионов
зависит
от двух градиентов
градиента концентрации
grad C
электрического градиента
grad φ.
grad μ
μ
Уравнение Нернста – Планка
Уравнение Нернста – Планка описывает пассивный транспорт ионов
Z – валентность иона
F = 96500 Кл/моль – число Фарадея
C – молярная концентрация
Um – подвижность ионов для моля
Разновидности пассивного транспорта
Простая физическая диффузия (O2, CO2, N2, яды, лекарства).
Через белок-канал (ионы).
Облегченная диффузия
(с носителем).
(АК,моносахариды, глюкоза)
Виды транспорта с носителем
Существуют системы переносчиков, которые
способны транспортировать более одного вещества
μ
out
Понятие об активном транспорте ионов через биологические мембраны
C2=С1
in
C1
Up hill- в горку
Активный транспорт – это перенос веществ (ионов) через БМ, связанный с затратой химической энергии (энергия метаболизма) из области МЕНЬШЕГО ! электрохимического потенциала в область большего электрохимического потенциала.
ВОПРОС: Что будет через некоторое время, если пассивный транспорт?
C1
C2
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 920 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 20 человек из 11 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 36 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 585 263 материала в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 24.12.2020
- 132
- 0
- 03.12.2020
- 70
- 0
- 28.11.2020
- 64
- 0
- 22.11.2020
- 420
- 8
- 16.11.2020
- 142
- 0
- 19.08.2020
- 74
- 0
- 11.08.2020
- 302
- 2
- 10.07.2020
- 96
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 19.08.2020 827
- PPTX 4.7 мбайт
- 5 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Макаренко Наталья Валерьевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 1 год и 1 месяц
- Подписчики: 0
- Всего просмотров: 22977
- Всего материалов: 225
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Рособрнадзор не планирует переносить досрочный период ЕГЭ
Время чтения: 0 минут
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
В школах Хабаровского края введут уроки спортивной борьбы
Время чтения: 1 минута
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Получите новую специальность со скидкой 10%
Цена от 4900 740 руб. Промокод (до 23 февраля): Промокод скопирован в буфер обмена ПП2302 Выбрать курс Все курсы профессиональной переподготовки
http://pandia.ru/text/78/193/68855.php
http://infourok.ru/biologicheskie-membrany-bioelektrogenez-lekciya-5-4878627.html