Гидролиз ацетата натрия
CH3COONa — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Молекулярное уравнение
CH3COONa + HOH ⇄ CH3COOH + NaOH
Полное ионное уравнение
CH3COO — + Na + + HOH ⇄ CH3COOH + Na + + OH —
Сокращенное (краткое) ионное уравнение
CH3COO — + HOH ⇄ CH3COOH + OH —
Среда и pH раствора ацетата натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Диссоциация слабых электролитов
При диссоциации слабого бинарного электролита в растворе устанавливается равновесие.
CH3COOH 
При этом, если начальная концентрация электролита равна С, а степень диссоциации a, то
для a 2 и
Приведенное уравнение выражает закон разбавления Оствальда, согласно которому степень диссоциации слабого электролита растет с разбавлением раствора.
Добавление в раствор слабых электролитов одноименных ионов вызывает смещение равновесия реакции диссоциации в сторону ее уменьшения (эффект одноименного иона).
Электролитическая диссоциация воды
Процесс ионизации воды протекает по уравнению:
Н2О 
Константа равновесия процесса диссоциации воды можно записать в виде:
Концентрация молекул воды – постоянная величина, которую можно рассчитать по уравнению:
[H2O]= n(H2O)/1л = 1000 
где 0,9971г/мл -плотность воды, 18,015 г/моль -молярная масса воды.
Объединяя две постоянные величины в одной части уравнения, получим:
K[H2O] = 1,8×10 — 16 × 55,5 = 10 — 14 = [H + ] × [OH — ] = KH2O – ионное произведение воды.
Ионное произведение воды увеличивается с увеличением температуры:
| t,°C | 10 | 22 | 30 | 100 |
| KH2O | 0,4×10 — 14 | 1,0×10 — 14 | 1,9×10 — 14 | 74×10 — 14 |
В нейтральном растворе концентрации ионов водорода и гидроксид-ионов равны: [H + ] = [OH — ] = 
В кислом растворе [Н + ] > [OH — ]; [H + ] >10 — 7 моль/л.
В щелочном растворе [H + ] — ]; [H + ] — 7 моль/л.
Зная концентрацию одного из ионов, например [Н + ] и ионное произведение воды, можно рассчитать концентрацию ионов [OH — ] и, наоборот.
Пользоваться в расчетах такими малыми величинами концентраций ионов( 10 -9 , 10 -13 моль/л и т.д.) неудобно, поэтому используют их отрицательные десятичные логарифмы. Отрицательный логарифм концентрации ионов водорода (или отрицательный логарифм активности ионов водорода) называют водородным показателем,рН:
Зная, что [H + ] × [OH — ]= 10 -14 , получим: рН + рОН = 14
В нейтральном растворе при 22 о С рН = рОН = 7.
В кислом растворе рН 7.
Кислотно-основные индикаторы – это вещества, меняющее окраску в определенной области значения ph раствора. Индикаторами могут быть слабые органические кислоты или основания, молекулы и ионы которых имеют разную окраску.
Область перехода окраски некоторых индикаторов
Область перехода окраски,
Буферные растворы
Буферные растворы используют для поддержания постоянной величины рН в исследуемом растворе при добавлении к нему небольших количеств сильной кислоты, сильного основания или при разбавления раствора.
В качестве буферных растворов обычно используют смеси растворов слабых кислот или слабых оснований и их солей или смеси солей многоосновных кислот различной степени замещения. В таблице приведены примеры наиболее часто используемых буферных растворов и величины рН, которые они поддерживают:
| Состав буферного раствора | Название буфера | рН |
| Смесь СН3СООН и СН3СООNа | Ацетатный буфер | 4,7 |
| Смесь NаН2РО4 и Nа2НРО4 | Фосфатный буфер | 6,5 |
| Смесь NН4ОН и NН4С1 | Аммиачный буфер | 9,25 |
Буферная система может связывать как ионы Н + , так и ОН — приливаемых сильных кислот и оснований в слабые электролиты, незначительно изменяя величину рН раствора.
Пример: Ацетатный буферный раствор содержит смесь CH3COOH и CH3COONa. Диссоциация слабого электролита – уксусной кислоты – отражается уравнением реакции: CH3COOH 

Ka= 
При добавлении ацетата натрия концентрация ионов CH3COO 



Ka= 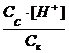
[H + ] = Ka 
pH = –lg[H + ] = pKa – lg ( 
Таким образом, рН буферных растворов не зависит от концентраций компонентов, а определяется их отношением.
При добавлении небольших количеств сильных кислот и оснований компоненты буферного раствора реагируют с ними, переводя их в слабые электролиты:
CH3COOH + NaOH = CH3COONa + H2O (концентрация соли увеличивается на концентрацию добавленной щелочи, а концентрация кислоты уменьшается на ту же величину):
pH = –lg[H + ] = pKa — lg ( 
CH3COONa + HCl = CH3COOH + NaCl,
pH = –lg[H + ] = pKa — lg ( 
Так как отношение концентраций изменяется меньше, чем их сумма или разность, общее значение рН изменяется незначительно.
Количество сильной кислоты или сильного основания, которые нужно добавить к буферному раствору для изменения рН одного литра его раствора на единицу, называют буферной емкостью ( B ). Она может быть вычислена относительно кислоты (B а) или основания (Bb).
Ba =
Bb =
где Ba и Bb – буферные емкости по кислоте и основанию соответственно; Ca и Cb – концентрации добавленных кислоты и основания; pH 1 и pH 2 – исходные и конечные значения рН раствора; Va and Vb – объемы добавленных сильных кислоты и основания.
Примеры решения задач
Пример 26. Рассчитайте pH 0.01 M раствора NaOH.
Решение . Так как NaOH является сильным электролитом, то он полностью диссоциирует в растворах:
[OH — ] = C(NaOH) = 10 — 2 моль/л.
[H + ] = 10 -14 /[OH — ] = 10 -1 2 моль/л.
Пример 27. Рассчитайте pH 0.01 M раствора of CH3COOH.
Решение. Уксусная кислота – слабый электролит, диссоциирующий обратимо: CH3COOH 
Согласно закону разбавления Оствальда, 
Константа диссоциации уксусной кислоты– табличная величина, которая равна K(CH3COOH) = 1.75×10 — 5 , поэтому

pH = –lg [H + ] = –lg (4.18×10 -4 ) = 4 – lg(4.18) = 3.38.
Пример 28. Рассчитайте pH буферного раствора, содержащего 0.01 моль/л CH3COOH и 0.1 моль/л CH3COONa.
Решение. CH3COOH 
pH = –lg [H + ] = –lg (1.75×10 -6 ) = 6 – lg(1.75) = 5.76.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df09d091b7c7180 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://lektsii.org/17-24933.html
http://gomolog.ru/reshebniki/11-klass/rudzitis-i-feldman-2019/19/zadanie-2.html









