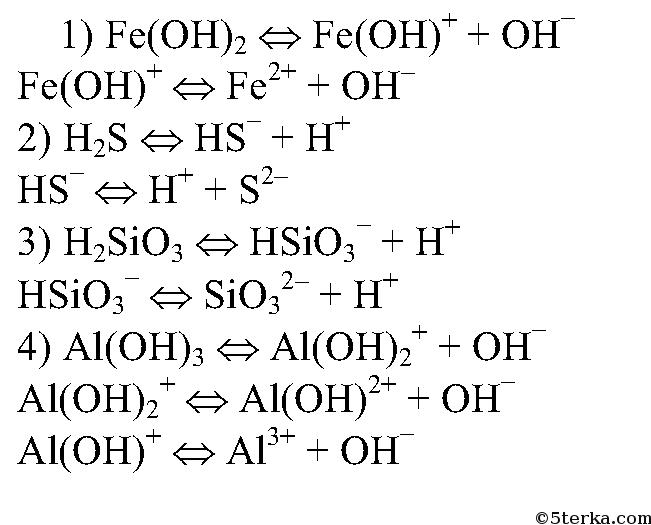2. Напишите уравнения электролитической диссоциации слабых электролитов: Fe(OH)2, H2S, H2SiO3, Al(ОН)3.
задача №2
к главе «Глава 17. Электролиты. §17.4 Сильные и слабые электролиты».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Уравнение диссоциации h2s в водном растворе
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Сероводород. Сульфиды
«Тогда услышал я (о, диво!), запах скверный,
Как будто тухлое разбилося яйцо,
Или карантинный страж курил жаровней серной.
Я, нос себе зажав, отворотил лицо. «
I. Строение молекулы сероводорода
II. Физические свойства
Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде (в 1V H2O растворяется 3V H2S при н.у.); t°пл. = -86°C; t°кип. = -60°С.
Влияние сероводорода на организм:
Сероводород не только скверно пахнет, он еще и чрезвычайно ядовит. При вдыхании этого газа в большом количестве быстро наступает паралич дыхательных нервов, и тогда человек перестает ощущать запах – в этом и заключается смертельная опасность сероводорода.
Насчитывается множество случаев отравления вредным газом, когда пострадавшими были рабочие, на ремонте трубопроводов. Этот газ тяжелее, поэтому он накапливается в ямах, колодцах, откуда быстро выбраться не так-то просто.
Посмотрите видео-фильм: “Опасный сероводород черного моря”
III. Получение
IV. Химические свойства
1. Раствор H2S в воде – слабая двухосновная кислота. Диссоциация происходит в две ступени:
H2S → H + + HS — (первая ступень, образуется гидросульфид — ион)
HS — → 2H + + S 2- (вторая ступень)
Сероводородная кислота образует два ряда солей — средние (сульфиды) и кислые (гидросульфиды):
NaHS – гидросульфид натрия;
2. Взаимодействует с основаниями:
H2S (избыток) + NaOH → NaНS + H2O
3. H2S проявляет очень сильные восстановительные свойства:
при нагревании реакция идет по — иному:
4. Сероводород окисляется:
5. Серебро при контакте с сероводородом чернеет:
Потемневшим предметам можно вернуть блеск. Для этого в эмалированной посуде их кипятят с раствором соды и алюминиевой фольгой. Алюминий восстанавливает серебро до металла, а раствор соды удерживает ионы серы.
6. Качественная реакция на сероводород и растворимые сульфиды — образование темно-коричневого (почти черного) осадка PbS:
Загрязнение атмосферы вызывает почернение поверхности картин, написанных масляными красками, в состав которых входят свинцовые белила. Одной из основных причин потемнения художественных картин старых мастеров было использование свинцовых белил, которые за несколько веков, взаимодействуя со следами сероводорода в воздухе (образуются в небольших количествах при гниении белков; в атмосфере промышленных регионов и др.) превращаются в PbS. Свинцовые белила – это пигмент, представляющий собой карбонат свинца (II). Он реагирует с сероводородом, содержащимся в загрязнённой атмосфере, образуя сульфид свинца (II), соединение чёрного цвета:
При обработке сульфида свинца (II) пероксидом водорода происходит реакция:
при этом образуется сульфат свинца (II), соединение белого цвета.
Таким образом реставрируют почерневшие масляные картины.
7. Реставрация:
V. Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора растворимой соли сероводородной кислоты, например, сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для всех щелочных и щелочноземельных металлов известны также гидросульфиды M + HS и M 2+ (HS)². Гидросульфиды Са²+ и Sr 2+ очень нестойки. Являясь солями слабой кислоты, в водном растворе растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.), часто проходит необратимо с выпадением в осадок нерастворимого гидроксида.
Сульфиды применяются в технике, например, полупроводники и люминофоры (сульфид кадмия, сульфид цинка), смазочные материалы (дисульфид молибдена) и др.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь, молибденит).
1. Получение сульфидов
1) Многие сульфиды получают нагреванием металла с серой:
2) Растворимые сульфиды получают действием сероводорода на щелочи:
3) Нерастворимые сульфиды получают обменными реакциями:
2. Химические свойства сульфидов
1) Растворимые сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют щелочную реакцию:
S 2- + H2O → HS — + OH —
2) Сульфиды металлов, стоящих в ряду напряжений левее железа (включительно), растворимы в сильных кислотах:
3) Нерастворимые сульфиды можно перевести в растворимое состояние действием концентрированной HNO3:
VI. Задания для закрепления
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cu →CuS →H2S →SO2
Задание №2
Составьте уравнения окислительно-восстановительных реакций полного и неполного сгорания сероводорода. Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель для каждой реакции, а так же процессы окисления и восстановления.
Задание №3
Запишите уравнение химической реакции сероводорода с раствором нитрата свинца (II) в молекулярном, полном и кратком ионном виде. Отметьте признаки этой реакции, является ли реакция обратимой?
Задание №4
Сероводород пропустили через 18%-ый раствор сульфата меди (II) массой 200 г. Вычислите массу осадка, выпавшего в результате этой реакции.
Задание №5
Определите объём сероводорода (н.у.), образовавшегося при взаимодействии соляной кислоты с 25% — ым раствором сульфида железа (II) массой 2 кг?
Напишите уравнения диссоциации следующих электролитов H2S, (NH4)2SO4, Co(OH)NO3, K2HPO4, Fe(NO3)3, в разбавленном водном
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,292
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,160
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://kardaeva.ru/89-dlya-uchenika/9-klass/193-serovodorod-sulfidy
http://www.soloby.ru/1140225/%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D0%B8-%D1%81%D0%BB%D0%B5%D0%B4%D1%83%D1%8E%D1%89%D0%B8%D1%85-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82%D0%BE%D0%B2-%D1%80%D0%B0%D0%B7%D0%B1%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%BD%D0%BE%D0%BC