1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
Как известно из курса физики, электрическим током называют упорядоченное движение заряженных частиц. В случае металлов, электропроводность обеспечивается подвижными электронами в кристалле, слабо связанными c ядрами атомов, что позволяет им направленно двигаться под действием разности потенциалов.
Кроме металлов, существуют также вещества растворы или расплавы которых проводят электрический ток. Такие вещества называют электролитами.
Электролиты — вещества, расплавы или водные растворы которых проводят электрический ток.
Но за счет чего обеспечивается электрическая проводимость расплавов и растворов электролитов?
Рассмотрим такое соединение как хлорида натрия. Это вещество характеризуется ионным строением. В узлах его структурной решетки находятся попеременно в шахматном порядке катионы натрия и анионы хлора:
Как можно видеть, заряженные частицы, которые могли бы быть обеспечивать электрическую проводимость присутствуют, но статичны, т.е. неподвижны в узлах решетки. Поэтому, чтобы электрический ток смог протекать через хлорид натрия, нужно еще и обеспечить «подвижность» ионов, из которых он состоит.
Как известно, для одного и того же вещества наиболее подвижны составляющие его частицы в том случае, когда он находится в жидком, а не в твердом агрегатном состоянии. Поэтому для того, чтобы хлорид натрия смог проводить электрический ток, его необходимо расплавить, т.е. превратить в жидкость. В результате сообщения энергии кристаллу хлорида натрия в виде большого количества теплоты частично разрушаются ионные связи Na + Cl − , т.е. происходит диссоциация на свободные подвижные ионы:
Na + Cl − ↔ Na + + Cl −
Однако, добиться диссоциации хлорида натрия можно не только его плавлением, но также и его растворением в воде. Но каким образом, это становится возможным? Ведь для того чтобы произошло разрушение кристаллической решетки требуется сообщить ей энергию, что и происходило при расплавлении. Откуда же берется энергия на разрушение решетки в случае растворения?
При помещении кристалла NaCl в воду его поверхность подвергается «облепливанию» молекулами воды или гидратации, в результате которой, ионам в структурной решетке сообщается энергия, достаточная для выделения из структурной решетки и «отправления в свободное плавание» в «оболочке» из молекул воды:
или более упрощенно:
NaCl ↔ Na + + Cl − (участвующие в гидратации кристалла NaCl и ионов молекулы воды не записываются)
Если энергия, выделяющаяся при гидратации кристалла, меньше энергии кристаллической решетки, то его растворение и диссоциация становятся невозможными. Например, поверхность кристалла сульфата бария, помещенного в водную среду, также покрывается молекулами воды, но выделяющаяся в результате этого энергия недостаточна отрыва ионов Ba 2+ и SO4 2- из кристаллической решетки и, как следствие, становится невозможно его растворение (на самом деле возможно, но в крайне малой степени, т.к. абсолютно нерастворимых веществ не бывает).
Аналогичным образом диссоциация осуществляется также гидроксидами металлов. Например:
Помимо веществ ионного строения, электролитически диссоциировать способны также и некоторые вещества молекулярного строения с ковалентным полярным типом связи, а именно кислоты. Как и в случае ионных соединений, причина образования ионов из электронейтральных молекул кроется в их гидратации. Существование гидратированных ионов энергетически более выгодно, чем существование гидратированных молекул. Например, диссоциация молекулы соляной кислоты выглядит примерно следующим образом:
Гидратация катионов водорода настолько сильна, что можно говорить не просто о катионе водорода, окружённом молекулами воды (как это было с катионами натрия), а о полноценной частице – ионе гидроксония H3O + , содержащей три полноценные ковалентные связи H-О, одна из которых образована по донорно-акцепторному механизму. Таким образом, уравнение диссоциации соляной кислоты правильнее записывать так:
Тем не менее, даже в этом случае, чаще всего, уравнение диссоциации соляной кислоты, впрочем, как и любой другой, записывают, игнорируя явное участие в диссоциации кислот молекул воды.
Диссоциация многоосновных кислот протекает ступенчато, например:
Таким образом, как мы уже выяснили, к электролитам относят: соли, кислоты и основания.
Для описания способности электролитов к электролитической диссоциации используют величину, которая называется степенью диссоциации (α).
Степень диссоциации – отношение числа продиссоциировавших частиц, к общему числу растворенных частиц.
Что такое электролитическая диссоциация
Давно известно, что некоторые растворы проводят электрический ток (такие растворы получили название электролитов), а некоторые — не проводят (неэлектролиты).
Кроме электропроводности электролиты и неэлектролиты имеют много других отличий. При одинаковой молярной концентрации электролиты (по сравнению с неэлектролитами) обладают:
- более высокой температурой кипения;
- более низкой температурой замерзания;
- более высоким осмотическим давлением;
- более низким давлением пара растворителя.
Такое большое различие в свойствах растворов ученые объясняют тем фактом, что в электролитах при растворении образуется гораздо большее кол-во частиц, которые еще и обладают зарядом, хотя, в общем, раствор электролита нейтрален.
Впервые теорию электролитической диссоциации (разделения) сформулировал в 1887 г. шведский ученый С. Аррениус, ее основные положения заключались в следующем:
- электролиты, растворяясь в воде, диссоциируют (распадаются) на положительно (катионы) и отрицательно (анионы) заряженные ионы;
- под воздействием внешнего электрического поля катионы в растворе электролита начнут двигаться к катоду (отрицательному электроду), анионы — к аноду (положительному электроду);
- электролитическая диссоциация является обратимым процессом — параллельно с распадом молекул на ионы идет обратный процесс ассоциации (ионы соединяются в молекулы), в результате чего в растворе устанавливается динамическое равновесие.
Через несколько лет, в 1891 г., русский ученый И. Каблуков внес существенные уточнения в теорию Аррениуса, введя понятие сольватации катионов и анионов (формирование химических связей между растворителем и растворяемым веществом).
| Электролитической диссоциацией (ионизацией) называют процесс распада электролитов на ионы в водном растворе (расплаве) |
Ионами называют атомы (группы атомов), которые имеют заряд (положительный — анионы или отрицательный — катионы).
| Растворы электролитов нейтральны потому, что общая сумма зарядов анионов всегда равна общей сумме зарядов катионов |
Механизм электролитической диссоциации
Электролиты бывают двух видов: раствором с ионной связью и раствором с ковалентной связью.
Растворители, в которых протекает процесс диссоциации, обязательно состоят из полярных молекул.
Механизм диссоциации электролитов с ионной и ковалентной связью различен.
Диссоциация хлорида натрия
Хлорид натрия является веществом с ионной связью, в узлах кристаллической решетки NaCl находятся ионы натрия и хлора.
Рис. 1. Кристаллическая решетка хлорида натрия.
При погружении поваренной соли в воду на первой стадии растворения (диссоциации NaCl) полярные молекулы воды под действием электростатического притяжения приклеиваются своей отрицательной стороной к катионам натрия (Na + ), а положительной стороной к анионам хлора (Cl — ):
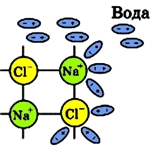
Рис. 2 Притяжение полярных молекул воды к ионам NaCl.
По мере склеивания молекул воды с ионами натрия и хлора происходит ослабление ионных связей Na + с Cl — :
Кристаллическая решетка постепенно разрушается, в результате чего, освободившиеся ионы переходят в раствор, в котором они тут же связываются с молекулами воды — такие ионы называются гидратированными.
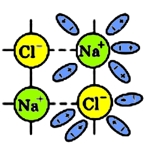
Рис. 3 Ослабление ионных связей хлорида натрия.
Ионные связи хлорида натрия разрываются и гидратированные ионы переходят в раствор:
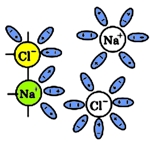
Рис. 4 Переход гидратированных ионов натрия и хлора в раствор.
В водном растворе диссоциация ионных соединений всегда протекает полностью.
Диссоциация хлороводорода
Хлороводород является веществом с ковалентной полярной связью.
Под воздействием молекул воды ковалентные связи поляризуются еще больше и становятся связями ионными, после чего происходит процесс, описанный выше:
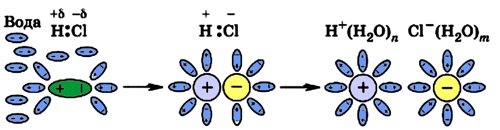
Рис. 5 Диссоциация полярной молекулы HCl.
Из вышесказанного можно сделать вывод, что электролитическая диссоциация возможна в полярных растворителях (вода, этиловый спирт). При диссоциации в первую очередь разрываются наиболее полярные связи (самая большая разность в электроотрицательности атомов, составляющих связь; см. Понятие электроотрицательности).
Растворитель выполняет не только роль разделения катионов и анионов растворяемого вещества, но также замедляет обратный процесс ассоциации ионов в исходную молекулу, поскольку сольватированные (гидратированные) ионы окружены «прилипшими» молекулами растворителя, что мешает сближению (под воздействием кулоновского электростатического притяжения) и воссоединению в молекулу катионов и анионов. Кол-во молекул растворителя, находящихся в гидратной оболочке ионов, зависит от природы ионов, концентрации и температуры раствора.
Одно из главных отличий диссоциации электролитов с полярной связью от диссоциации электролитов с ионной связью заключается в том, что такая диссоциация может быть частичной — это зависит от полярности связей в молекулах электролитов.
Уравнения электролитических диссоциаций записываются следующим образом:
Электролитическая диссоциация протекает за счет энергии, выделяемой в процессе разрушения кристаллической решетки растворяемого вещества во время взаимодейтсвия молекул растворителя с веществом. Следует сказать, что диссоциация может протекать и без растворителя, например, при высокой температуре, когда образуется расплав вещества (энергия для разрушения кристаллической решетки берется из внешнего источника высокой температуры).
ИТОГ : Электролитическая диссоциация — это процесс распада вещества (электролита) на ионы (в растворах под воздействием полярных молекул растворителя; в расплавах — под воздействием высокой температуры).
Свойства ионов
Атомы элементов и их ионы — это далеко не «родственники». По своим физическим и химическим свойствам ионы сильно отличаются от нейтральных атомов, из которых они образовались.
Такие сильные различия между атомами и их ионами объясняются разным электронным строением.
При наличии в растворе нескольких электролитов они диссоциируют в сторону образования: 1) осадков; 2) газов; 3) слабых электролитов.
- пример диссоциации с образованием осадков:
- пример диссоциации с образованием газов:
- пример диссоциации с образованием слабых электролитов:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Теория
электролитической
диссоциации
Цели. Сформировать у учащихся понятие «электролитическая диссоциация» на основе атомно-молекулярного учения, теории электролитической диссоциации С.Аррениуса и гидратной теории растворов Д.И.Менделеева. Вскрыть причину электропроводности растворов, обсудить значение и применение теории.
Оборудование и реактивы. Пробирки, два мерных цилиндра, пипетки, прибор для проверки электрической проводимости растворов, стаканы, стеклянные палочки;
вода, концентрированные серная и уксусная кислоты, твердые гидроксид натрия, хлорид натрия, сульфат меди(II), 100 мл раствора метилоранжа в ацетоне, растворы сульфата меди(II), хлорида натрия, гидроксида кальция, нитрата бария, хлорида бария, нитрата серебра, соляной кислоты, карбоната натрия, хлорида магния, хлорида алюминия, цинк гранулированный, железо – порошок, алюминий гранулированный.
План изложения темы
- Свойства водных и неводных растворов различных классов неорганических соединений.
- Растворение в воде с точки зрения электронной теории.
- Диссоциация электролитов в растворе.
- Степень электролитической диссоциации. Слабые и сильные электролиты.
ХОД УРОКА
Учитель. Известно ли вам, что вещества растворяются не только в воде, но и в других растворителях? Если да, то приведите примеры. (Учащиеся приводят примеры растворения веществ.)
Выясним, нужен ли растворитель для протекания реакции и важна ли в этом случае природа растворителя. Возьмем концентрированную серную кислоту и опустим в нее цинк. Произойдет ли реакция? (Проводит лабораторный опыт.)
Ученик. Цинк реагирует с концентрированной серной кислотой при нагревании. При этом выделяется газ SO2 (пишут на доске уравнение реакции):
Учитель. Выделяется ли водород? А теперь перельем содержимое пробирки (из опыта) в пробирку с водой, очень осторожно. Реакция пошла, выделяется много тепла. Обратите внимание, без воды реакция почти не шла, хотя вода при обычных условиях не взаимодействует с цинком.
Проделаем еще один опыт. Смешаем сначала твердые вещества: гидроксид натрия и сульфат меди(II), а затем их растворы. Реакция между твердыми реагентами не происходит, а в растворе образуется голубой осадок. Запишите в тетрадях уравнение химической реакции:
2NaOH + CuSO4 = Cu(OH)2 
Из результатов опытов сделаем вывод, что вода в химических реакциях вовсе не пассивная среда. Под ее влиянием вещества испытывают изменения. Вода заставляет электролиты распадаться на ионы.
Рассмотрим процесс растворения электролитов в воде. Для этого придется вспомнить, что такое валентность и какие виды химической связи вам известны.
Ученики отвечают на поставленные вопросы. При рассмотрении ионной связи акцентируем внимание на модели кристаллической решетки хлорида натрия. Ковалентную полярную связь повторяем на примере строения молекул воды.
Учитель. В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1.
Молекула воды полярна и
представляет собой диполь
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na + и Сl – из кристалла в раствор происходит образование гидратов этих ионов. (Далее веду объяснение по рисунку (рис. 2, см. с. 36) учебника: Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.: Просвещение, 1999, с. 4.) А как реагируют с молекулами воды полярные молекулы электролита? Рассмотрим это на примере соляной кислоты (рис. 3,
см. с. 36).
Рис. 2.
Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na + ;
б – гидратация (окружение молекулами воды) ионов Na + и Сl –
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными.
Рис. 3.
Диссоциация молекул HCl
на ионы в водном растворе
Наличие ионов в растворах кислот, щелочей и солей можно доказать реакциями обмена. Проведем следующие опыты:
взаимодействие сульфата меди(II) c:
а) нитратом бария;
б) хлоридом бария;
в) гидроксидом натрия;
г) гидроксидом кальция;
взаимодействие нитрата серебра с:
д) соляной кислотой;
е) хлоридом натрия.
Запишем уравнения химических реакций:
а) СuSO4 + Ba(NO3)2 = Cu(NO3)2 + BaSO4
б) СuSO4 + BaСl2 = CuCl2 + BaSO4
в) СuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
г) СuSO4 + Сa(OH)2 = CaSO4 + Cu(OH)2
д) AgNO3 + HCl = HNO3 + AgCl
е) AgNO3 + NaCl = NaNO3 + AgCl
На основании этих реакций можно сделать следующие выводы:
1) ионы металлов, гидроксильные группы и кислотные остатки реагируют в водных растворах как самостоятельно существующие частицы;
2) гидроксильные группы, кислотные остатки, атомы водорода кислот и атомы металлов солей являются теми электрически заряженными частицами, которые находятся в растворах кислот, щелочей и солей.
Запишем определение понятия: «Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении».
Поскольку число молекул воды, которое присоединяют ионы, неизвестно, то процесс диссоциации кислоты, щелочей и солей упрощенно изображают так:
Многоосновные кислоты и кислые соли диссоциируют ступенчато. Чтобы показать неполную диссоциацию молекул и ионов, не относящихся к сильным электролитам, используют знак обратимости «
H2SO4 = H + + 



NaHSO4 = Na + + 



Cледует не допускать ошибок при написании уравнений диссоциации нерастворимых и малорастворимых веществ, которые практически не диссоциируют на ионы или диссоциируют в малой степени:
CaCO3 
СaSO4 

Основные термины, рассматриваемые в теории электролитической диссоциации, – это «электролиты» и «ионы».
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов, обладающие положительным (катионы) или отрицательным (анионы) зарядом. Ионы отличаются от атомов как по строению, так и по свойствам. Для примера сравним свойства атомарного и молекулярного хлора со свойствами иона. Рассмотрим их отношение к металлам, водороду, ионам серебра. Свойства металлического натрия сравним со свойствами ионов натрия. (Ученики приводят примеры и рассказывают о свойствах атомов Cl, молекулы Cl2 и ионов Сl – , а также о свойствах металлического Na и ионов Na + в составе солей.)
Рис. 4.
Прибор для проверки
электропроводности растворов
Общий и характерный признак ионов – наличие электрических зарядов. Ток проводят только те растворы, в которых содержатся ионы. Сравним электропроводность растворов кислот, щелочей, солей, сахара, спирта при помощи прибора для изучения электропроводности растворов (рис. 4). Мы видим, что диссоциация происходит не во всяком растворе. На основании ионной теории сформулируем новые определения кислот, оснований и солей как сложных веществ, образующих при диссоциации в воде особые ионы. При диссоциации кислот в качестве катионов отщепляются только ионы H + . При диссоциации оснований в качестве анионов отщепляется только ионы ОН – . Средние соли диссоциируют на катионы металлов и анионы кислотных остатков.
Попробуем ответить на такой вопрос: все ли электролиты в одинаковой степени распадаются на ионы? Сравним электропроводность концентрированных растворов хлорида натрия и уксусной кислоты. В растворе соли лампочка загорается ярко, а в уксусной кислоте – очень слабо. Разбавим растворы, добавив к ним воды. Электропроводность раствора хлорида натрия не изменяется, а в растворе уксусной кислоты лампочка горит ярче. Хлорид натрия даже в концентрированных растворах диссоциируют полностью. Молекулы же уксусной кислоты в концентрированных растворах почти не диссоциируют. При разбавлении уксусной кислоты число диссоциированных молекул увеличивается, равновесие диссоциации смещается вправо:
СН3СООН 
Вещества с ионной кристаллической решеткой полностью диссоциируют на ионы в водных растворах. Отношение числа диссоциированных молекул (n) к общему числу молекул (N), находящихся в растворе, называют степенью диссоциации (

Общие свойства кислот обусловливаются наличием ионов Н + в растворе. Активность кислоты (сильный или слабый электролит) зависит от концентрации ионов Н + в растворе.
Демонстрационный опыт. В два стакана нальем по 50 мл раствора метилоранжа в ацетоне. В первый стакан добавим 1–2 капли концентрированной серной кислоты, появляется малиновое окрашивание. Чтобы во втором стакане появилась такая же окраска, придется добавить в 10 раз больше (10–20 капель) уксусной кислоты, т.к. степень диссоциации кислоты CH3COOH незначительная и концентрация ионов водорода в ней невелика.
Вывод. Сила кислот и оснований определяется их степенью диссоциации.
http://prosto-o-slognom.ru/chimia/04_dissotsiatsiya.html
http://him.1sept.ru/2004/26/35.htm




