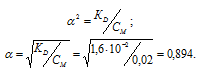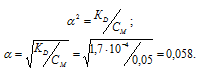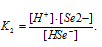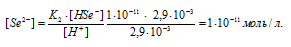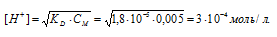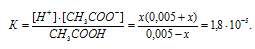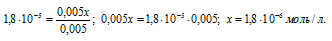Написать ступенчатые диссоциации сернистой кислоты ; гидроксида кальция.
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,261
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Расчет степени диссоциации сернистой кислоты и других кислот
Задача 511.
Вычислить концентрацию ионов [H + ] в 0,02М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
Решение:
K1(H2SO3) = 1,6 . 10 -2 .
Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = 
Ответ: 0,018 моль/л.
Задача 512. ( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Вычислить концентрацию ионов [H + ], [HSe — ] и [Se 2- ] в 0,05 М растворе H2Se.
Решение:
Уравнение диссоциации H2Se имеет вид:
Константа диссоциации H2Se равна 1,7 . 10 4 . Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = [HSe — ] = 
Уравнение диссоциации H2Se по второй ступени имеет вид:
Тогда выражение константы диссоциации иона HSe — будет иметь вид:
Ответ: [H + ] = [HSe — ] = 2,9 . 10 -3 ; [Se 2- ] = 1 . 10 -11 .
Задача 513.
Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
Решение:
Исходную концентрацию ионов H + в растворе (до добавления ацетата натрия( рассчитаем по уравнению:
Концентрацию ионов водорода в растворе после добавления соли обозначим через x. Тогда, концентрация недиссоциированных молекул кислоты будет равна (0,005 –x). Концентрация ацетат-ионов будет слагаться из двух величин: из концентрации, создаваемой диссоциацией молекул кислоты (CH3COOH ⇔ CH3COO — + H + ), и концентрации, обусловленной диссоциацией в растворе соли (CH3COONa ⇔ CH3COO — + Na + ). Первая из этих величин равна x, а вторая – 0,005 моль/л; общая концентрация ионов CH3COO — равна, следовательно, (0,005 + x) моль/л. Подставив значения концентраций в выражение для константы диссоциации уксусной кислоты, получим:
Так как в присутствии одноимённых ионов CH3COO — диссоциация уксусной кислоты подавляется, то степень её диссоциации мала и значением x можно пренебречь. Тогда последнее выражение упростится, получим:
При сравнении исходной концентрации ионов водорода с рассчитанной, находим, что прибавление к раствору кислоты соли вызвало уменьшение концентрации ионов водорода в 167 раз:
( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Константа диссоциации сернистой кислоты по первой ступени равна 1,3∙10–2, а по второй 0,6∙10–7. Чему равны степени диссоциации сернистой кислоты a1 и a2 в децимолярном растворе и водородный показатель






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Константа диссоциации сернистой кислоты по первой ступени равна 1,3∙10 –2 , а по второй 0,6∙10 –7 . Чему равны степени диссоциации сернистой кислоты a 1 и a 2 в децимолярном растворе и водородный показатель этого раствора?
Решение:
Так как α>0,05, то расчет степени диссоциации нужно производить по строгой формуле:
| Если вам нужно решить химию, тогда нажмите ➔ помощь по химии. |
| Похожие готовые решения: |
- Раствор хлорида калия с моляльностью 1 моль/кг кристаллизуется при –3,36 °С. Определите изотонический коэффициент раствора и кажущуюся степень диссоциации растворенного вещества.
- Вычислите молярную концентрацию и моляльность раствора хлорида калия, если массовая доля KСI в этом растворе 24 %, а плотность раствора 1,62 г/мл.
- Напишите ионные и молекулярные уравнения для следующих реакций: а) CuO + H2SO4; в) Cu(OH)2 + HNO3; б) AgNO3 + FeCl3; г) Pb(OH)2 + NaOH.
- К раствору FeCl3 добавили: а) HCl; б) NaOH; в) ZnCl2; г) Na2CO3; д) Zn; е) H2O. В каких случаях гидролиз хлорида железа (III) усилится? Составьте молекулярные и ионно-молекулярные уравнения
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://buzani.ru/zadachi/khimiya-glinka/1175-stepen-dissotsiatsii-sernistoj-kisloty-zadachi-511-513
http://natalibrilenova.ru/konstanta-dissotsiatsii-sernistoj-kislotyi-po-pervoj-stupeni-ravna-1310-2-a-po-vtoroj-0610-7-chemu-ravnyi-stepeni-dissotsiatsii-sernistoj-kislotyi-a1-i-a2-v-detsimolyarnom-rastvore-i-vodorodnyij-pokazatel/