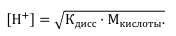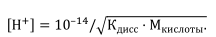Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Уравнение диссоциации серной кислоты и метилоранж
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
I. Электролитическая диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
1. Электролитическая диссоциация одноосновных кислот
Кислоты состоят не из ионов, а из молекул.
Возникает вопрос – как же тогда кислота диссоциирует, т. е как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в растворах кислот именно при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде, но для этого запишем строение молекул хлороводорода и воды.
Обе молекулы образованы ковалентной полярной связью. Электронная плотность в молекуле хлороводорода смещена к атому хлора, а в молекуле воды – к атому кислорода. Молекула воды способна оторвать катион водорода от молекулы хлороводорода, при этом образуется катион гидроксония Н3О + .
В уравнении реакции электролитической диссоциации не всегда учитывают образование катиона гидроксония – обычно говорят, что образуется катион водорода.
Тогда уравнение диссоциации хлороводорода выглядит так:
HCl⇄H + + Cl —
При диссоциации одного моля хлороводорода образуются один моль катиона водорода и один моль хлорид — анионов.
2. Электролитическя диссоциация многоосновных кислот
Многоосновные кислоты диссоциируют ступенчато.
Рассмотри процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две стадии.
I–я стадия диссоциации
На первой стадии отрывается один катион водорода и образуется гидросульфат-анион.
II — я стадия диссоциации
На второй стадии происходит дальнейшая диссоциация гидросульфат — анионов.
Эта стадия является обратимой, то есть, образующиеся сульфат — ионы могут присоединять к себе катионы водорода и превращаться в гидросульфат — анионы. Это показано знаком обратимости.
Существуют кислоты, которые даже на первой стадии диссоциируют не полностью – такие кислоты являются слабыми. Например, угольная кислота Н2СО3.
Н3РО4 ↔ Н + + Н2РО4 — (первая ступень) – дигидроортофосфат ион
Н2РО — 4 ↔ Н + + НРO4 2- (вторая ступень) – гидроортофосфат ион
НРО 2- 4 ↔ Н + + PО4 З- (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей.
II. Электролитическая диссоциация оснований
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH — )
Диссоциация амфотерных оснований (амфолитов)
Щёлочи – это основания, растворимые в воде
Это основания щелочных и щелочноземельных металлов :
LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также NН4ОН
Амфолиты — это электролиты, которые при диссоциации одновременно образуют катионы водорода (H + ) и гидроксид-ионы ( OH — )
Примеры уравнений диссоциации щелочей
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 -> Bа(ОН) + + OH — (первая ступень)
Ba(OH) + ↔ Ba 2+ +OH — (вторая ступень)
Примеры уравнений диссоциации амфолитов
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением:
Нерастворимые в воде основания практически не подвергаются электролитической диссоциации, так как в воде они практически нерастворимы, а при нагревании – разлагаются, так что расплав их получить не удается.
III. Электролитическая диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH + 4) и анионы кислотных остатков.
Например, диссоциация средних солей :
Кислые же и основные соли диссоциируют ступенчато:
Диссоциация кислых солей
Диссоциация основных солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg(OH)Cl -> Mg(OH) + + Cl —
Mg (OH) + ↔ Mg 2+ + OH —
IV. Тренажеры
Тренажёр №2 — Катионы и анионы
Интерактивное задание LearningApps.org по теме: “Химические свойства растворов кислот»
V. Памятки
Памятка – Определение солей
VI. Задания для закрепления
Задание №1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
Задание №2. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: Ca(OH)2, Na2CO3, Na3PO4, HNO3, KOH, Ba(OH)2, H2SO3, Ca(NO3)2, Ca3(PO4)2, H2S, NaOH, HBr
Кислотно-основное титрование. Индикаторы, техника титрования
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Кислотно-основное титрование
Основные понятия кислотно-основного титрования
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Техника титрования
Основные понятия кислотно-основного титрования
Метод кислотно-основное титрование базируется на реакциях взаимодействия между кислотами и основаниями, т. е. на реакции нейтрализации:
Рабочими растворами метода являются растворы сильных кислот (HCl, H2S, НNО3 и др.) или сильных оснований (NaOH, КОН, Ва(ОН)2 и др.). В зависимости от титрованного раствора (титранта) кислотно-основное титрование подразделяют на ацидиметрию, если титрантом является раствор кислоты, и алкалиметрию, если используют в качестве титранта раствор основания.
Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo вещества в растворе титранта становится строго эквивалентным количеству определяемого вещества согласно уравнению химической реакции, называют точкой эквивалентности.
Точку эквивалентности устанавливают различными способами. В методах ручного анализа преимущественно используют изменение окраски индикатора, добавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,04 мл (2 капли) титранта. Это то количество вещества в растворе титранта, которое необходимо для взаимодейcтвия его с индикатором.
Если для приготовления растворов используют вещества, которые не являются стандартными, то проводят их стандартизацию. Например растворы кислот можно стандартизовать по стандартным веществам — натрия тетраборат Na2B4О7 ∙10Н2О, натрия карбонат Nа2СО3 ·10Н2О или по стандартным растворам NaOH, КОН; а растворы оснований — по щавелевой кислоте Н2С2О4 ∙2Н2О, янтарной кислоте Н2С4Н4О4 или по стандартным растворам HCl, H2SO4 , НNО3 .
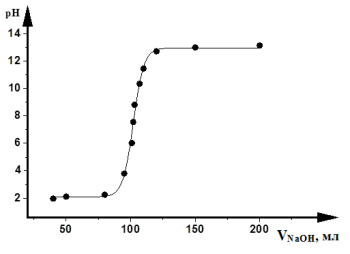
Кривые кислотно-основного титрования выражают зависимость изменения рН раствора от объема добавленного титранта (рис. 3.4).
Рис. 3.4. Кривая кислотно-щелочного титрования
При расчете рН необходимо знать состав титриметрической смеси. Для упрощения вычислений (что не приводит к заметным ошибкам) не учитывают разбавление раствора в процессе титрования и используют понятие «концентрация», а не «активность». Кривые титрования представляют в виде графика зависимости рН от объема добавленного титранта или объема избытка определяемого вещества и избытка титранта.
В начале титрования рН изменяется очень медленно. Кривая (см. рис. 3.4) показывает, в частности, что если оттитровать половину имеющегося количества кислоты (50 мл), рН раствора изменится незначительно по сравнению с исходным, если оттитровать 90 % (90 мл), то и тогда уменьшение рН составит лишь одну единицу. С уменьшением концентрации оставшейся кислоты изменение рН при титровании становится более резким. Оттитровывание кислоты от 90 до 99 % вызывает изменение рН на три единицы. Также на единицу возрастает рН при оттитровывании от 99 до 99,9 %, т. е. на 0,9 %. Титрование остатка кислоты (0,1%) приводит к изменению рН на целых 3 единицы. Введение избытка в 0,1 % NaOH по сравнению с эквивалентным количеством вызывает изменение рН также на 3 единицы, и рН раствора становится равным 13,0.
Кривая титрования сильного основания сильной кислотой представляет собой зеркальное отображение кривой титрования сильной кислоты сильным основанием. При титровании сильной кислотой сильного основания и наоборот до точки эквивалентности рН раствора определяется концентрацией неоттитрованной щелочи или кислоты, а после точки эквивалентности — концентрацией добавленной кислоты или щелочи. В точке эквивалентности раствор нейтрален.
Скачок титрования — это резкое изменение рН в области точки эквивалентности. Факторы, влияющие на величину и положение скачка титрования (на величину скачка титрования влияют все факторы, от которых зависят значения рН):
- ● константа диссоциации титруемого вещества;
- ● концентрация титруемого вещества;
- ● концентрация титранта;
- ● температура;
- ● ионная сила.
Чем меньше концентрация титруемого вещества и титранта, тем меньше скачок. Практически невозможно оттитровать сильные протолиты концентрацией 10 –4 М, а слабые — концентрацией 10 –2 М. При изменении температуры сильно изменяется константа автопротолиза воды, входящая во многие формулы расчета рН. В результате при увеличении температуры скачок уменьшается и смещается в более кислую область. Ионная сила влияет незначительно.
В рассматриваемом случае расчет рН проводят по следующим формулам:
● Для сильной кислоты, например HCl, рН определяется концентрацией ионов водорода: [H+] = M кислоты.
● Для сильного основания, например КОН [H+] = 10 –14 / Mщелочи. Часто проводят титрование с использованием слабых электролитов.
При титровании слабой кислоты сильным основанием чем слабее кислота, тем больше значение рН в начале титрования. Следовательно, ветвь кривой титрования (рис. 3.5) до точки эквивалентности смещается в щелочную область. После достижения точки эквивалентности образуется сильное основание, следовательно, значение рН резко смещается в щелочную область. При дальнейшем титровании кривая изменяется незначительно.
В ходе титрования раствора уксусной кислоты сильным основанием значение pH все время остается выше, чем при тех же концентрациях соляной кислоты. В результате этого скачок на кривой начинается с более высокого значения рН. Заканчивается он, как и в первом случае, при рН = 10, так как титрование производят тем же раствором 0,1 моль/л NaOH.
Рис. 3.5. Ход титрования слабой кислоты сильным основанием
При титровании слабой кислоты сильным основанием pH раствора кислоты вычисляют с учетом ее константы диссоциации:
Интервал скачка рН на кривой титрования 0,1 мольл уксусной кислоты раствором 0,1 мольл NaOH значительно уже предыдущего случая. Он простирается от рН = 7,8 до рН = 10.
При титровании слабого основания сильной кислотой интервал скачка уменьшается в щелочной области рН. Рассчитывается рН в этом случае следующим образом:
При титрование слабой кислоты слабым основанием (или наоборот) сужение интервала скачка рН происходит и в кислотной, и в щелочной областях рН. Вследствие этого интервал скачка рН на кривой вовсе исчезает. Пример — нейтрализация раствора 0,1 моль/л СН3СООН раствором 0,1 моль/л NН4ОН. Кривая титрования не имеет скачка рН. Поэтому нельзя ожидать и резкого изменения окраски индикаторов. Титрование слабой кислоты слабым основанием вообще невозможно.
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Индикаторы — вещества, которые резко реагируют на изменение концентрации определяемого компонента или титранта вблизи точки эквивалентности. В методах кислотно-основного титрования для определения конечной точки титрования используют кислотноосновные индикаторы (табл. 3.1). Это органические вещества, способные видимо и обратимо изменять свою окраску в растворе при изменении рН среды.
Кислотно-основные индикаторы изменяют свою окраску в области интервала перехода независимо от того, достигнута ли точка эквивалентности. Правильно выбранный индикатор изменяет окраску в области скачка титрования. У неправильно выбранного индикатора изменение окраски может происходить задолго до наступления точки эквивалентности или после нее.
Таблица 3.1 Характеристики кислотно-основных индикаторов
Выбирают индикатор с помощью кривой титрования. Для этого на график наносят интервал перехода индикатора. У правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования. Если такого перекрывания нет, то индикатор для данного титрования не подходит. Значение рН, при котором заканчивается титрование с данным индикатором, называют показателем титрования и обозначают рТ. Показатель титрования находится обычно в середине интервала перехода индикатора. Существуют различные теории индикаторов, каждая из которых по-своему объясняет поведение кислотно-основных индикаторов в кислых и щелочных средах.
Ионная теория индикаторов. В связи с тем, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, любой индикатор диссоциирует в растворе согласно уравнению:
HInd = Н+ + Ind — (бесцветный — малиновый).
Окраска раствора, в котором индикатор находится в молекулярной форме (HInd), отличается от окраски раствора, в котором индикатор находится в ионной форме (Ind − ). Молекулы фенолфталеина HInd бесцветны, а его анионы Ind − окрашены в малиновый цвет. Достаточно к раствору, содержащему фенолфталеин, прибавить 1−2 капли щелочи, как введенные ОН – ионы станут связывать катионы Н+ с образованием слабого электролита — молекул воды. При этом равновесие диссоциации индикатора сместится вправо, и накопление анионов Ind − вызовет окрашивание раствора в малиновый цвет. То есть переход одной окраски, присущей молекулярной форме кислотно-основного индикатора, в другую, свойственную его ионной форме, происходит под влиянием Н+ или ОН − -ионов, т. е. зависит от рН раствора.
Хромофорная теория индикаторов. Поведение индикаторов, объясняемое ионной теорией индикаторов, дополняется хромофорной теорией, согласно которой изменение окраски индикаторов связано с изменением структуры их молекул, внутримолекулярной перегруппировкой, вызываемой действием Н+ или ОН − -ионов. По хромофорной теории в процессе изменения рН раствора меняется строение молекул кислотно-основных индикаторов. Это явление обусловливается бензоидно-хиноидной таутомерией. При изменении рН среды раствора или при диссоциации хромофоры могут перегруппировываться. Перемена окраски у индикаторов является результатом изменений в их внутреннем строении. У одноцветных индикаторов окраска изменяется в связи с появлением или исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие. Типичным одноцветным индикатором является фенолфталеин. При рН –4 , у лакмуса Кд = 10 –8 , а у фенолфталеина Кд = 10 –9 . Следовательно, фенолфталеин является наиболее слабой органической кислотой из этих индикаторов.
Изменение окраски индикаторов происходит при прибавлении к любому раствору любой кислоты или щелочи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и величины рН. Перемена окраски у индикаторов также связана с изменением рН раствора. Однако каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений рН. Объясняется это тем, что окраска индикатора зависит от соотношения концентраций его диссоциированной и недиссоциированной форм, т. е.
При рН = 7, [Н+] = 1 –7 , а [HInd] / [Ind−] = 10 –7 / 10 –9 , т. е. при рН = 7 на каждые 100 бесцветных молекул фенолфталеина приходится лишь один окрашенный ион, следовательно, раствор бесцветный.
Если к раствору фенолфталеина прибавить щелочь и довести рН раствора до 8, то соотношение [HInd] / [Ind−] = 10 –8 /10 –9 уменьшится в 10 раз и раствор станет бледно-розовым. При рН = 9 соотношение [HInd] / [Ind−] = 10 –9 /10 –9 = 1,0, т. е. в растворе присутствуют равные количества бесцветных молекул индикатора и окрашенных в красный цвет ионов, при этом раствор приобретает розовую окраску. Следовательно, цвет водного раствора индикатора определяется соотношением концентрации его молекулярной и ионной форм, отличающихся различной окраской, и зависит от [Н+].
Техника титрования
Правильное определение точки эквивалентности при титровании зависит не только от выбора индикатора, но и от порядка титрования. По методу нейтрализации титруют растворы кислот растворами оснований или наоборот. Этот порядок следует учитывать при выборе индикатора. Например, если титруют кислоту основанием и в качестве индикатора используют метиловый оранжевый (или метиловый красный), то розовая окраска индикатора от избыточной капли щелочи должна перейти в желтую.
Такое изменение окраски гораздо хуже улавливается глазом, чем переход ее из желтой в розовую. Поэтому с метиловым оранжевым (или метиловым красным) рекомендуют титровать растворы оснований растворами кислот. С фенолфталeином удобнее титровать растворы кислот растворами оснований, так как при этом бесцветный раствор становится малиновым.
Следует заметить, что при использовании индикаторов для фиксирования конечной точки титрования возможно появление индикаторной ошибки. Она образуется в случае несовпадения рН раствора в точке эквивалентности и рТ индикатора. Если такое несовпадение имеет место, то раствор обычно либо несколько перетитровывают, либо, наоборот, недотитровывают. Для уменьшения индикаторной ошибки титрование проводят с так называемым свидетелем. В запасную коническую колбу (или стакан) наливают дистиллированную воду в количестве, приблизительно равном объему жидкости, получающейся в конце титрования. Прибавляют к воде столько же капель индикатора, например метилового оранжевого, сколько и к титруемому раствору, и приливают из бюретки 1−2 капли кислоты, вызывающей слабое порозовение раствора. Приготовленный таким образом свидетель используют в качестве образца при титровании, добиваясь, чтобы окраска анализируемого раствора и свидетель была одинакова. С помощью свидетель вводят также поправку в результаты титрования на прибавленный избыток кислоты, т. е. из затраченного ее объема вычитают объем двух капель (0,04 мл), использованных на окрашивание индикатора в свидетель.
Правильное определение точки эквивалентности зависит от количества прибавленного индикатора. Иногда стараются прилить побольше индикатора, полагая, что большая интенсивность окраски раствора облегчит определение точки эквивалентности. Но чем больше прибавлено индикатора, тем труднее заметить изменение окраски, так как оно будет происходить медленнее. Для установления конечной точки титрования имеет значение не столько яркость окраски раствора, сколько четкость ее изменения. Опытным путем найдено, что на 10–15 мл анализируемого раствора следует брать одну каплю раствора индикатора, а на 25 мл — не более двух капель.
Таким образом, результат объемного определения зависит не только от выбора индикатора, но также от его взятого количества и от принятого порядка титрования.
http://kardaeva.ru/89-dlya-uchenika/9-klass/138-elektroliticheskaya-dissotsiatsiya-kislot-shchelochej-i-solej
http://farmf.ru/lekcii/kislotno-osnovnoe-titrovanie-indikatory-tehnika-titrovaniya/