Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
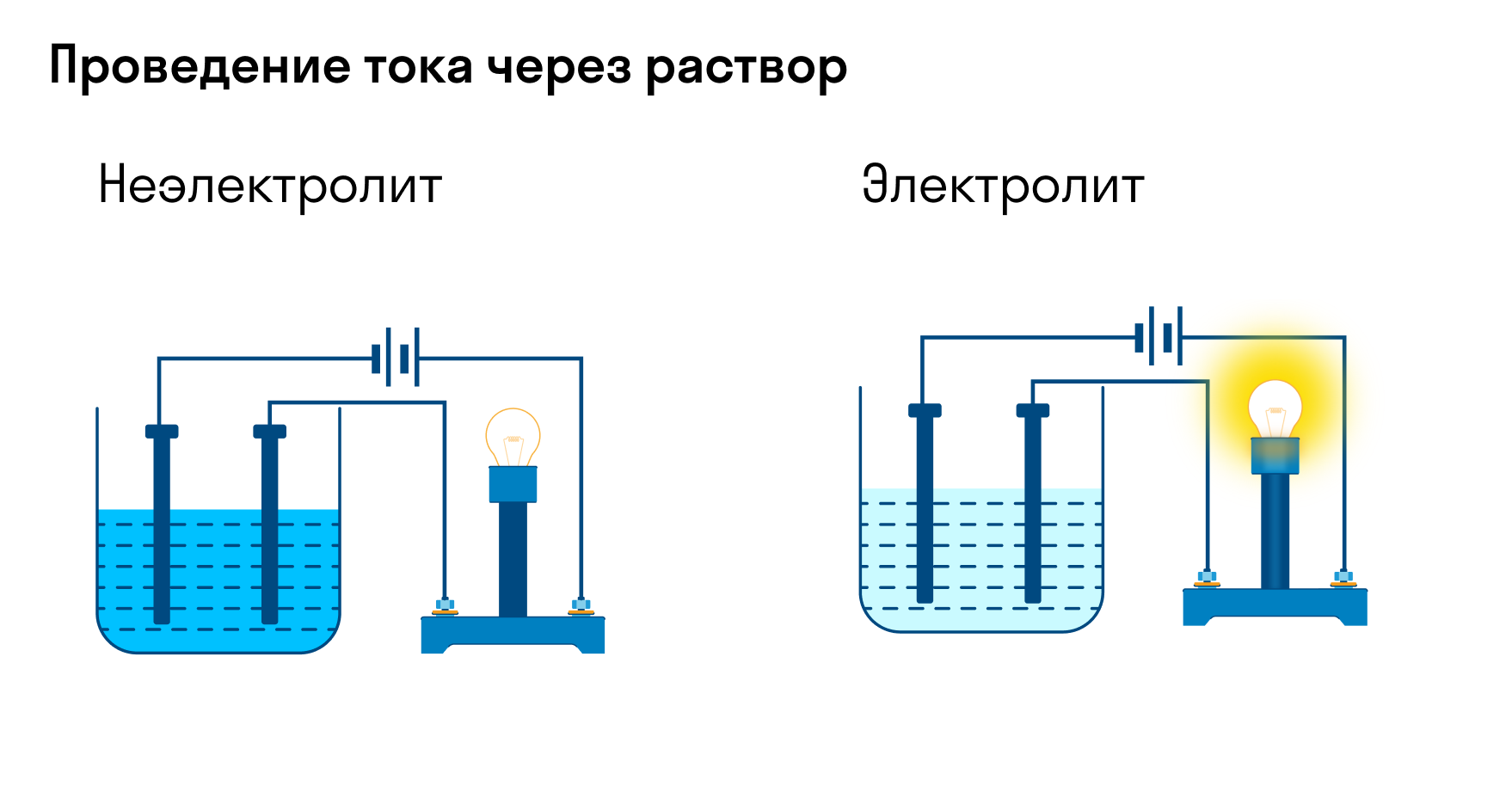
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Растворы; электролитическая диссоциация; гидролиз солей
Электронное учебное пособие
Растворы; электролитическая диссоциация; гидролиз солей
В результате изучения данной темы вы узнаете:
В результате изучения данной темы вы научитесь:
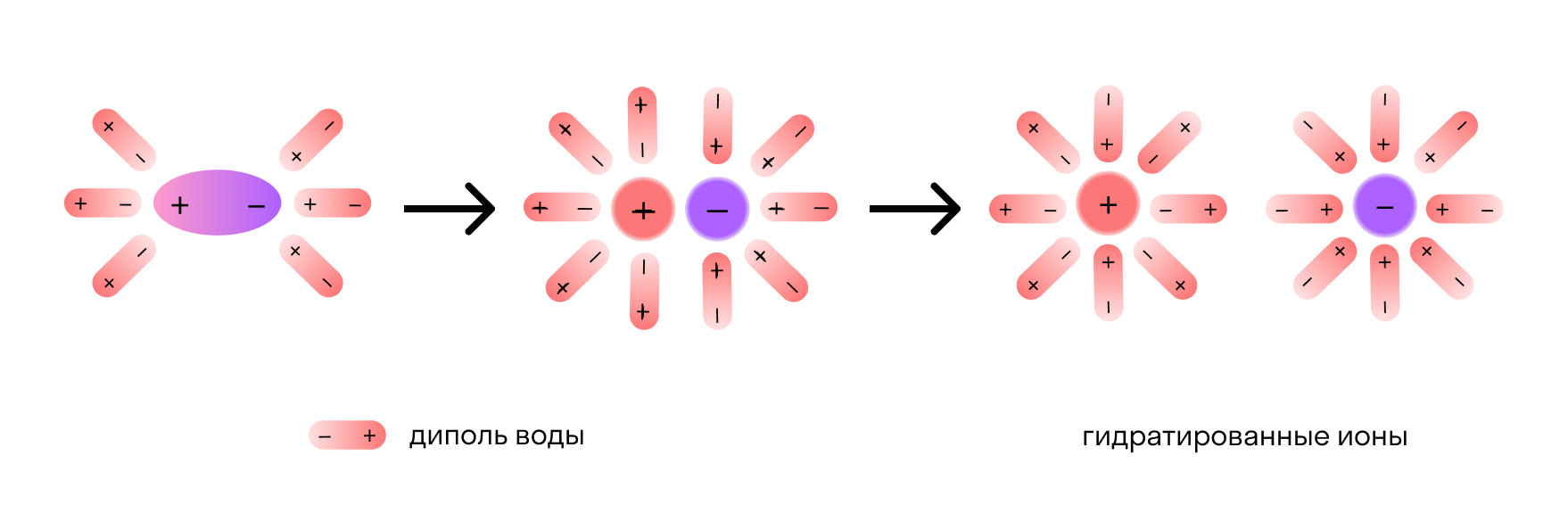
Учебные вопросы:9.1. Растворы и их классификацияРастворами называют гомогенные системы, в которых одно вещество распределено в среде другого (других) веществ. Растворы состоят из растворителя и растворенного вещества (веществ). Эти понятия условны. Если одним из составляющих растворов веществ является жидкость, а другими — газы или твердые вещества, то растворителем обычно считают жидкость. В других случаях растворителем считают тот компонент, которого больше. Газообразные, жидкие и твердые растворы В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы. Газообразным раствором является, например, воздух и другие смеси газов. Морская вода — наиболее распространенный жидкий раствор различных солей и газов в воде. К твердым растворам принадлежат многие металлические сплавы. Истинные и коллоидные растворы По степени дисперсности различают истинные и коллоидные растворы (коллоидные системы). При образовании истинных растворов растворенное вещество находится в растворителе в виде атомов, молекул или ионов. Размер частиц в таких растворах равен 10 –7 — 10 –8 см. Коллоидные растворы относятся к гетерогенным системам, в которых частицы одного вещества (дисперсная фаза) равномерно распределены в другом (дисперсионная среда). Размер частиц в дисперсных системах находится в пределах от 10 –7 см до 10 –3 и более см. Следует отметить, что здесь и далее везде мы будем рассматривать истинные растворы. Ненасыщенные, насыщенные и пересыщенные растворы Процесс растворения связан с диффузией, т. е. с самопроизвольным распределением частиц одного вещества между частицами другого. Так, процесс растворения твердых веществ, имеющих ионное строение, в жидкостях можно представить следующим образом: под влиянием растворителя разрушается кристаллическая решетка твердого вещества, а ионы распределяются равномерно по всему объему растворителя. Раствор останется ненасыщенным до тех пор, пока в него может переходить еще некоторое количество вещества. Раствор, в котором вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в состоянии равновесия с твердой фазой растворяемого вещества, называется насыщенным. Растворимость данного вещества равна его концентрации в насыщенном растворе. При строго определенных условиях (температура, растворитель) растворимость есть величина постоянная. Если растворимость вещества увеличивается с ростом температуры, то охлаждая насыщенный при более высокой температуре раствор, можно получить пересыщенный раствор, т.е. такой раствор, концентрация вещества в котором выше концентрации насыщенного раствора (при данных температуре и давлении). Пересыщенные растворы очень неустойчивы. Легкое сотрясение сосуда или введение в раствор кристаллов вещества, находящегося в растворе, вызывает кристаллизацию избытка растворенного вещества, и раствор становится насыщенным. Разбавленные и концентрированные растворы Не следует путать ненасыщенный и насыщенный растворы с разбавленным и концентрированным. Понятия разбавленный и концентрированный растворы – относительные и между ними нельзя провести четкой границы. Они определяют соотношение между количествами растворенного вещества и растворителя. В общем случае, разбавленные растворы – это растворы, содержащие небольшие количества растворенного вещества по сравнению с количеством растворителя, концентрированные – с большим содержанием растворенного вещества. Например, если при 20 o С растворить в 100 г воды 25 г NaCl, то полученный раствор будет концентрированным, но ненасыщенным, поскольку растворимость хлорида натрия при 20 o С составляет 36 г в 100 г воды. Максимальная масса AgI, которая растворяется при 20 o С в 100 г Н2О равна 1,3·10 –7 г. Полученный при этих условиях раствор AgI будет насыщенным, но очень разбавленным. 9.2. Физическая и химическая теория растворов; тепловые явления при растворенииФизическая теория растворов была предложена В. Оствальдом (Германия) и С. Аррениусом (Швеция). Согласно этой теории частицы растворителя и растворенного вещества (молекулы, ионы) равномерно распределяются по всему объему раствора вследствие процессов диффузии. При этом между растворителем и растворенным веществом отсутствует химическое взаимодействие. Химическая теория была предложена Д.И. Менделеевым. Согласно представлениям Д.И. Менделеева между молекулами растворяемого вещества и растворителем происходит химическое взаимодействие с образованием неустойчивых, превращающихся друг в друга соединений растворенного вещества с растворителем – сольватов. Русские ученые И.А. Каблуков и В.А. Кистяковский объединили представления Оствальда, Аррениуса и Менделеева, заложив тем самым основу современной теории растворов. Согласно современной теории в растворе могут существовать не только частицы растворенного вещества и растворителя, но и продукты физико-химического взаимодействия растворенного вещества с растворителем – сольваты. Сольваты – это неустойчивые соединения переменного состава. Если растворителем является вода, их называют гидратами. Сольваты (гидраты) образуются за счет ион-дипольного, донорно-акцепторного взаимодействий, образования водородных связей и т.д. Например, при растворении NaCl в воде между ионами Na + , Cl – и молекулами растворителя возникает ион-дипольное взаимодействие. Образование гидратов аммиака при его растворении в воде происходит за счет образования водородных связей. Гидратная вода иногда настолько прочно связывается с растворенным веществом, что выделяется вместе с ним из раствора. Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами, а вода, входящая в состав таких кристаллов, называется кристаллизационной. Примерами кристаллогидратов является медный купорос CuSO4·5H2O, алюмокалиевые квасцы KAl(SO4)2·12H2O. Тепловые эффекты при растворении В результате изменения структуры веществ при переходе их из индивидуального состояния в раствор, а также в результате происходящих взаимодействий изменяются свойства системы. На это указывают, в частности, тепловые эффекты растворения. При растворении происходят два процесса: разрушение структуры растворяемого вещества и взаимодействие молекул растворенного вещества с молекулами растворителя. Взаимодействие растворенного вещества с растворителем называется сольватацией. На разрушение структуры растворяемого вещества затрачивается энергия, а взаимодействие частиц растворенного вещества с частицами растворителя (сольватация) – процесс экзотермический (идет с выделением теплоты). Таким образом, процесс растворения может быть экзотермическим или эндотермическим, в зависимости от соотношения этих тепловых эффектов. Например, при растворении серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата калия – сильное охлаждение раствора (эндотермический процесс) . 9.3. Растворимость и ее зависимость от природы веществРастворимость – наиболее изученное свойство растворов. Растворимость веществ в различных растворителях колеблется в широких пределах. В табл. 9.1 приведена растворимость некоторых веществ в воде, а в табл. 9.2 – растворимость йодида калия в различных растворителях. Таблица 9.1.Растворимость некоторых веществ в воде при 20 o С Теория электролитической диссоциацииО чем эта статья: Что такое электролитическая диссоциацияКак известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы. В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль. Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий. Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией. Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя). Схема электролитической диссоциации: KA ⇄ K + (катион) + A — (анион). Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na + + Cl — . Механизм электролитической диссоциацииПри контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается. Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na + и анионами хлора Cl — , которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы. Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы. После распада хлорида натрия образовавшиеся ионы Na + и Cl — окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными. Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными. Сущность процесса электролитической диссоциации передает схема: Электролиты и неэлектролитыХотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты. Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи. Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи. Степень диссоциацииВ зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах. Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей. Если в растворе на ионы распадаются все 100% электролита, . По силе электролиты делятся на следующие группы: источники: http://chemege.ru/rastvory-el-diss-gidroliz-solej/ http://skysmart.ru/articles/chemistry/teoriya-elektroliticheskoj-dissocziaczii |