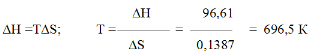Работы, изменения внутренней энерги, энтальпии и энтропи
Изобарный процесс, протекает при постоянном давлении. Уравнение изобарного процесса Р=const.
В соответствии с уравнением политропы Рv n = const политропа превращается в изобару Р=const при показателе политропы n=0.
Теплоемкость изобары cp при n=0 соответствует выражению c=cvк=cp .
Доля теплоты, идущая на увеличение внутренней энергии в изобарном процессе, соответствует величине a=1/к.
Кроме уравнения Р=const, для изобарного процесса можно записать уравнение Tv n-1 = const, которое при n=0 превращается в уравнение T/v=const.
Таким образом, основные величины, характеризующие изобарный процесс, будут представлены выражениями
Р=const, T/v=const, n=0, c=cp, a=1/к.
Теплота изобарного процесса соответствует выражению
а работа изменения объема – выражению
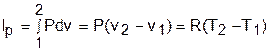
Изменение внутенней энергии, энтальпии и энтропии в изобарном процессе соответствует выражениям
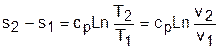
Изохорный процесс, протекает при постоянном объеме.
Уравнение изохорного процесса v=const.
В соответствии с уравнением политропы 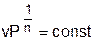
Теплоемкость изохоры при n=±¥ соответствует выражению c=cv. Доля теплоты, идущая на увеличение внутренней энергии в изохорном процессе, соответствует величине a = 1.
Кроме уравнения v=const, для изохорного процесса можно записать уравнение TP (1-n)/n = const, которое при n=±¥ превращается в уравнение T/P=const.
Таким образом, основные величины, характеризующие изохорный процесс, будут представлены выражениями
v = const, T/P = const, n = ±¥, c = cv, a = 1.
Теплота изохорного процесса соответствует выражению
а работа изменения объема равна нулю, т.к. dv=0:
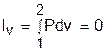
Изменение внутенней энергии, энтальпии и энтропии в изохорном процессе соответствует выражениям
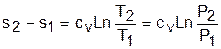
Изотермический процесс, протекает при постоянной температуре. Уравнение изотермического процесса T=const.
В соответствии с уравнением политропы Tv n-1 =const политропа превращается в изотерму Т=const при показателе политропы n=1.
Теплоемкость изотермы при n=1 равна бесконечности: cт=±¥. Доля теплоты, идущая на увеличение внутренней энергии в изотермическом процессе, равна нулю (a = 0).
Кроме уравнения Т=const, для изотемического процесса можно записать уравнение Pv n = const, которое при n=1 превращается в уравнение Pv=const.
Таким образом, основные величины, характеризующие изотермический процесс, будут представлены такими выражениями:
T = const, Pv = const, n = 1, cт = ±¥, a = 0.
Теплота изотермического процесса равна работе, т.к. изменение внутренней энергии идеального газа при Т=const равно нулю:
а работа изменения объема определяется по уравнению
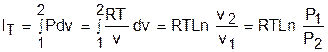
Изменение внутенней энергии и энтальпии в изотермическом процессе для идеального газа равно нулю:
а изменение энтропии определяется выражением
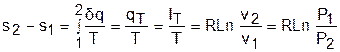
Адиабатный процесс – это процесс без теплообмена с окружающей средой, т.е. для него dq = 0 или q = 0.
Уравнение адиабатного процесса соответствует выражению s=const, т.к. dq=Tds=0 при ds=0. Поэтому адиабатный процесс имеет еще одно название – изоэнтропный процесс.
Теплоемкость адиабаты равна нулю (сs=0), т.к. температура в этом процессе изменяется, а dq=cdT=0.
Показатель политропы при сs=0 будет соответствовать выражению n=cp/cv=к, т.е. показатель политропы в адиабатном процессе равен коэффициенту Пуассона.
Доля теплоты, идущая на увеличение внутренней энергии в адиабатном процессе, равна бесконечности (a=±¥).
Таким образом, основные величины, характеризующие адиабатный процесс, будут представлены выражениями
s = const, Pv к = const, n = к, cs = 0, a = ±¥.
Теплота адиабатного процесса равна нулю, следовательно, для идеального газа в адиабатном процессе работа равна изменению внутренней энергии, взятой с обратным знаком:
Изменение энтальпии в адиабатном процессе ведется традиционно – h2-h1=cp(T2-T1), а изменение энтропии в этом процессе равно нулю – s2-s1=0.
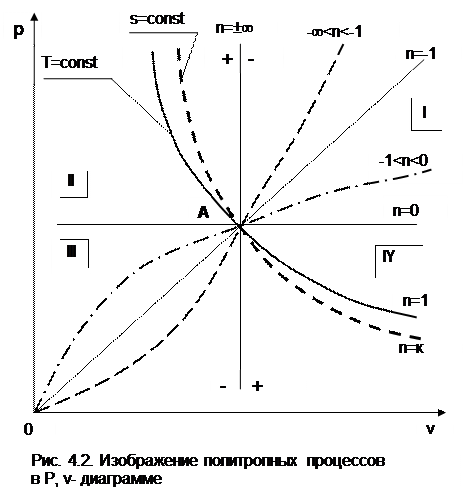
4.3. Изображение политропных процессов
в Р,v и T,s- диаграммах
Политропа в Р,v- диаграмме
На рис.4.2 изображены характерные политропные процессы в Р,v- координатах. Все процессы проведены через общую точку А, что позволяет наглядно сопоставить изображение политроп с различными значениями показателя политропы n.
Показатель политропы определяет характер процесса. В Р,v- координатах политропа описывается уравнением Рv n =const, в соответствии с которым основные процессы будут представлять:
изобара – горизонтальная прямая, n=0, Р=const;
изохора – вертикальная прямая, n=±¥, v=const;
изотерма – равнобокая гипербола с осями асимптот в виде осей координат Р и v, т.к. при n=1 уравнение изотермы p=const/v, причем константа – величина положительная;
адиабата – неравнобокая гипербола, т.к. при n=к>1 уравнение адиабаты Р=const/v к , адиабата круче изотермы.
Политропы при 0 n представляют собой гиперболы, крутизна которых возрастает с увеличением показателя n. Самая крутая из них – изохора (n=¥), а самая пологая – изобара (n=0). Все политропы с положительным показателем n>0 располагаются во II и IV квадрантах относительно точки А.
Политропы с 1 |q|, т.е. в этом случае будет увеличение внутренней энергии (Du=q-l>0) и температуры газа при отводе от него теплоты.
Политропы с отрицательным показателем -¥ -n проходят через начало координат, причем если
 |
n = -1 – это прямая линия,
-1 Т1. Кроме этого, исходя из уравнения изобары Т2/Т1=v2/v1, изотермы в P,v- диаграмме находятся одна над другой (или одна правее другой) по
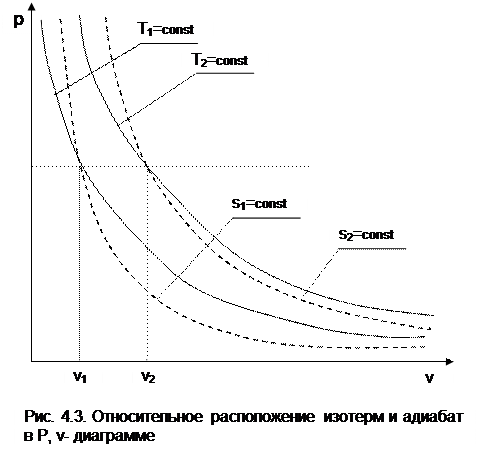 |
возрастающей, т.к. Т2>T1 только при v2>v1.
Для двух адиабат s1=const и s2=const расстояние между ними по оси v можно оценить по любой изобаре P=const. Исходя из уравнений адиабатного и изобарного процессов,
следует, что точке на данной изобаре с большим объемом будет соответствовать большее значение энтропии, т.е. при v2>v1 будет s2>s1. Следовательно, в Р,v- диаграмме адиабаты (изоэнтропы) чем выше (или правее), тем большее значение энтропии им соответствует.
Для изоэнтропы s2 в уравнении Pv к =const=А2 константа А2 будет больше, чем константа А1 изоэнтропы s1 в уравнении Pv к =const=А1, поскольку при Р=const Pv2 к -Pv1 к =А2-А1>0. Выразив объем из уравнения адиабаты v=const/P 1/к , получим расстояние между двумя адиабатами вдоль оси v в виде выражения
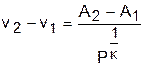
Из этого выражения видно, что с увеличением давления расстояние между адиабатами вдоль оси v в P,v- диаграмме уменьшается, т.е. адиабаты в Р,v- диаграмме не являются эквидистантными кривыми, хотя на всем своем протяжении не пересекаются друг с другом.
Политропа в T,s- диаграмме
Для политропного процесса идеального газа изменение энтропии определяется уравнением (4.13):
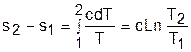
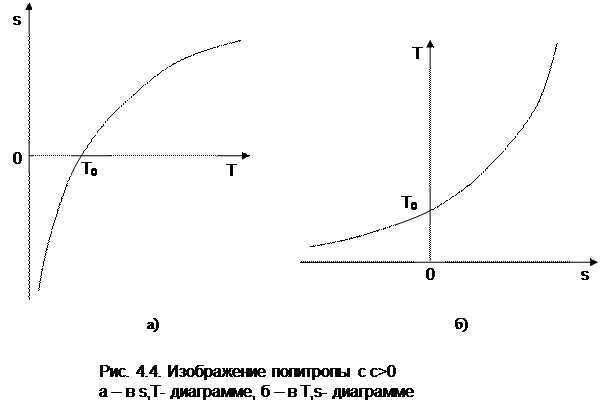 |
Изображение политропы в Т,s- диаграмме ведется в соответствии с этим уравнением при фиксации начала отсчета энтропии (рис.4.4).
В общем случае начало отсчета энтропии so=0 можно зафиксировать любой парой независимых параметров состояния. Для упрощения анализа политропы зафиксируем so=0 точкой, находящейся на нашей политропе при температуре То. В этом случае второй параметр состояния, определяющий so=0, при расчете абсолютного значения энтропии не потребуется, т.к. он определен своим местонахождением на данной политропе. При необходимости его несложно определить через параметры любой точки на данной политропе, воспользовавшись одним из уравнений политропы, включающим температуру, например
Таким образом, расчетное выражение абсолютного значения энтропии можно представить в виде
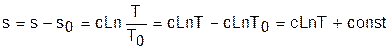
Выражение (4.31) соответствует логарифмической кривой. При положительной теплоемкости c>0 эта кривая в s,T- координатах изображена на рис. 4.4, а. Та же кривая в Т,s- координатах (перевернутых) показана на рис. 4.4, б. Таким образом, в Т,s- координатах политропа представляет логарифмическую кривую.
Политропа с отрицательной теплоемкостью представляет собой логарифмику в виде зеркального отражения политропы с такой же, но положительной теплоемкостью относительно оси Т (рис.4.5).
 |
Причем, если подкасательная любой точки политропы (подкасательная в Т,s- координатах соответствует теплоемкости данной точки процесса) расположена слева от нее, то теплоемкость этой политропы положительная (c>0), если подкасательная расположена справа от точки – теплоемкость политропы отрицательная (с cv. Самая крутая политропа – адиабата, для нее теплоемкость равна нулю. Самая пологая политропа – изотерма, для нее теплоемкость равна бесконечности.
Политропы, проходящие через II и IV квадранты, имеют отрицательную теплоемкость.
Процессы идеальных газов с одинаковыми показателями политропы в T,s- диаграмме представляют собой эквидистантные по оси s кривые (непересекающиеся, с одинаковым расстоянием друг от друга по оси s). На рис.4.7 изображены в Т,s- диаграмме две политропы идеального газа А1А2 и В1В2 с одинаковым показателем n и соответственно с одинаковыми теплоемкостями. Доказать, что эти политропы эквидистантны несложно. Достаточно рассмотреть расстояние между ними вдоль оси s по двум произвольным изотермам Т1 и Т2. Поскольку теплоемкости этих процессов одинаковые, то изменение энропии на интервале температур Т1-Т2 в этих процессах тоже одинаковое и соответствует отрезкам
А1С1 = В1С2 = 
В прямоугольнике С1А2В2С2 противоположные стороны равны (А2В2=С1С2), равны и отрезки А1С1 и В1С2 (А1С1 = В1С2), следовательно, равны и отрезки А1С1 и В1С2 (А1С1 = В1С2). Расстояние между этими политропами по иси s можно рассчитать по формуле оределения изменения энтропии изотермического процесса (4.13) при любой температуре:
s2 — s1
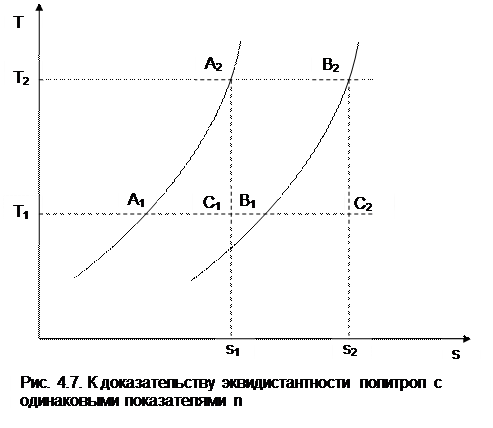 |
= sB — sA = А1В1 = А2В2 = 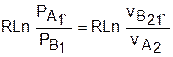
Изобары и изохоры являются частными случаями политроп, следовательно, и они представляют в Т,s- диаграмме эквидистантные по оси s кривые. В Т,s- координатах (рис.4.8) изобары находятся одна над другой по возрастающей, а изохоры одна под другой по возрастающей, т.к. если брать расстояние между ними по изотерме, оно будет равно положительной разности энтропий,
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Энергетика химических процессов. Энтальпия, законы термодинамики
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Энергетика химических процессов
- 5.1. Общие понятия
- 5.2. Внутренняя энергия. Первый закон термодинамики
- 5.3. Энтальпия системы. Тепловые эффекты химических реакций
- 5.4. Термохимические расчеты
- 5.5. Химическое сродство. Энтропия химических реакций. Энергия Гиббса
- 5.6. Второй и третий законы термодинамики
Глава 5 . Энергетика химических процессов
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
5.1. Общие понятия. При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция. Состояние системы характеризуется термодинамическими параметрами (р, Т, с и др.). При изменении параметров меняется и состояние системы. В термодинамике свойства системы рассматриваются при ее равновесном состоянии. Термодинамическое состояние системы называют равновесным в том случае, когда его термодинамические параметры одинаковы во всех точках системы и не изменяются самопроизвольно (без затраты работы) во времени. Термодинамика изучает переходы системы из одного состояния в другое. Но переходы должны осуществляться при термодинамическом равновесии с окружающей средой, т.е. очень медленно, а в идеале — бесконечно медленно. При этом могут изменяться все параметры состояния системы, либо некоторые параметры остаются без изменения. Если процессы перехода системы происходят при постоянстве каких-то параметров системы, то они называются:
а) изобарическими (р = const);
б) изохорическими (Т= const);
в) изотермическими (Т = const);
г) изобарно-изотермическими (р,T – const) и т.д.
Термодинамика изучает возможность или невозможность самопроизвольного перехода системы из одного состояния в другое и энергетические эффекты этих переходов. Скорость и механизм процессов перехода — это области химической кинетики.
5.2. Внутренняя энергия. Первый закон термодинамики. При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а те, которые сопровождаются поглощением теплоты, — эндотермическими. Теплота реакции является, таким образом, мерой изменения свойств системы, и знание ее может иметь большое значение при определении условий протекания той или иной реакции.
При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы — закона сохранения материи. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии и на совершение работы А:
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики:
Уравнение означает, что теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.
Внутренняя энергия системы U — это общий ее запас, включающий энергию поступательного и вращательного движений молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия — полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии U веществ неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, т.е. ее изменение однозначно определяется начальным и конечным состояниями системы и не зависит от пути перехода, по которому протекает процесс:
где: U – изменение внутренней энергии системы при переходе из начального состояния U1 в конечное U2. Если U2 > U1, то U> 0.
Если U2 0 (Н2 > Н1). В дальнейшем тепловые эффекты всюду выражаются через H.
5.4. Термохимические расчеты. Термохимические расчеты основаны на законе Гесса, позволяющее рассчитать энтальпию химической реакции: тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект реакции (Нx.p.) равен сумме теплот образования Нобр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции:
Пример 1. При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОС13 и хлороводород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции.
Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp, равные изменению энтальпии системы Н. Значение Н приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно.
Если в результате реакции выделяется теплота, то Н 1 /2О2= 2СО2(г)+3Н2О(ж); ∆Hх.р.= -1559,87 кДж
Вычислите теплоту образования этана, если известны теплоты образования СO2(г) и Н2O(ж) (см. табл. 15).
Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях.
Обычно теплоту образования относят к стандартному состоянию, т.е. 25° С (298 К) и 1,01310 5 Па и обозначают через.Так как тепловой эффект с температурой изменяется незначительно, то в дальнейшем индексы опускаются и тепловой эффект обозначается через Н. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
исходя из следующих данных:
На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) — на 3, а затем сумму этих уравнений вычитают из уравнения (а):
∆H =-1559,87-2(-393,51)-3(-285,84)= +84,67 кДж;
Так как теплота образования равна теплоте разложения с обратным знаком, то .
К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
Учитывая, что теплоты образования простых веществ условно приняты равными нулю
Пример 3. Реакция горения этилового спирта выражается термохимическим уравнением
Вычислите тепловой эффект реакции, если известно, что молярная теплота парообразования С2Н5OН(ж) равна +42,36 кДж, а теплоты образования С2Н5OН(г), СO2(г), Н2O(ж) см. табл. 15.
Решение. Для определения Н реакции необходимо знать теплоту образования С2Н5OН(ж). Последнюю находим из данных:
Вычисляем H реакции, применяя следствие из закона Гесса:
5.5. Химическое сродство. Энтропия химических реакций. Энергия Гиббса. Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты.
Реакция, идущая при данной температуре с выделением теплоты, при другой температуре проходит с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации), к уменьшению Н; с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением, а вторая — с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией.
Энтропия S, так же как внутренняя энергия U, энтальпия Н, объем V и др., является свойством вещества, пропорциональным его количеству. S, U, H, V обладают аддитивными свойствами, т.е. при соприкосновении системы суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п.— ведут к уменьшению энтропии. Энтропия является функцией состояния, т.е. ее изменение зависит только от начального (S1) и конечного (S2) состояний и не зависит от пути процесса:
Так как энтропия увеличивается с повышением температуры, то можно считать, что мера беспорядка равна TS. Энтропия выражается в Дж/(моль.К).
Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS). При р = const и Т = const общую движущую силу процесса, которую обозначают G, можно найти из соотношения
где: величина G называется изобарно-изотермическим потенциалом или энергией Гиббса.
Мерой химического сродства является убыль энергии Гиббса (G), которая зависит от природы вещества, его количества и температуры.
Энергия Гиббса является функцией состояния, поэтому
Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения G. Если G 0, процесс самопроизвольно проходить не может. Чем меньше G, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором G = 0 и H= TS.
Из соотношения G = H – TS видно, что самопроизвольно могут протекать и процессы, для которых H>0 (эндотермические). Это возможно, когда S>0, но |TS| > |H| и тогда G 0.
5.6. Второй и третий законы термодинамики. Для систем, которые не обмениваются с окружающей средой ни энергией, ни веществом (изолированные системы), второй закон термодинамики имеет следующую формулировку: в изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии: AS > 0.
Второй закон термодинамики имеет статистический характер, т.е.
справедлив лишь для систем, состоящих из очень большого числа
частиц.
Однако, если в системе протекает химическая реакция, то система обменивается энергией с окружающей средой, т.е. не является изолированной. Химические реакции обычно сопровождаются изменением как энтропии, так и энтальпии.
В отличие от других термодинамических функций, можно определить не только изменение, но абсолютное значение энтропии. Это вытекает из высказанного в 1911 г. М. Планком постулата, согласно которому «при абсолютном нуле энтропия идеального кристалла равна нулю». Этот постулат получил название третьего закона термодинамики.
Пример 1. В каком состоянии энтропия 1 моль вещества больше при одинаковой температуре: в кристаллическом или парообразном?
Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше объема 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
Решение. ВычислимΔG 0 298 прямой реакции. Значения ΔG 0 298соответствующих веществ приведены в табл. 16. Зная, что ΔG есть функция состояния и что ΔG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим ΔG 0 298процесса:
∆G 0 298 = 2 (-137,27) +2 (0) – (-50,79-394,38) = +170,63 кДж
То, что ΔG 0 298> 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном 1,013 ∙ 10 5 Па (760 мм рт. ст. = 1 атм).
Стандартная энергия Гиббса образования ΔG 0 298некоторых веществ
| Вещество | Состояние | ΔG 0 298, кДж/моль | Вещество | Состояние | ΔG 0 298, кДж/моль |
| ВаСО3 | к | -1138,8 | FeO | к | -244,3 |
| СаСО3 | к | -1128,75 | Н2О | ж | -237,19 |
| Fе3O4 | к | -1014,2 | Н2O | г | -228,59 |
| ВеСО3 | к | -944,75 | PbO2 | к | -219,0 |
| СаО | к | -604,2 | СО | г | -137,27 |
| ВеО | к | -581,61 | СН4 | г | -50,79 |
| NaF | к | -541,0 | NO2 | г | +51,84 |
| ВаО | к | -528,4 | NO | г | +86,69 |
| СО2 | г | -394,38 | C2H2 | г | +209,20 |
| NaCl | к | -384,03 | |||
| ZnO | к | -318,2 |
Стандартные абсолютные энтропии ΔS 0 298 некоторых веществ
| Вещество | Состояние | ΔS 0 298, Дж/(моль.К) | вещество | Состояние | ΔS 0 298,Дж/(моль.К) |
| С | Алмаз | 2,44 | Н2O | г | 188,72 |
| С | Графит | 5,69 | N2 | г | 191,49 |
| Fe | к | 27,2 | NН3 | г | 192,50 |
| Ti | к | 30,7 | СО | г | 197,91 |
| S | Ромб | 31,9 | с2H2 | г | 200,82 |
| TiO2 | к | 50,3 | O2 | г | 205,03 |
| FeO | к | 54,0 | H2S | г | 205,64 |
| H2O | ж | 69,94 | NO | г | 210,20 |
| Fе2О3 | к | 89,96 | CO2 | г | 213,65 |
| NH4C1 | к | 94,5 | C2H4 | г | 219,45 |
| СН3ОН | ж | 126,8 | Cl2 | г | 222,95 |
| Н2 | г | 130,59 | NO2 | г | 240,46 |
| Fе3O4 | к | 146,4 | РС13 | г | 311,66 |
| СН4 | г | 186,19 | PCl5 | г | 352,71 |
| НС1 | г | 186,68 |
Пример 3. На основании стандартных теплот образования (см. табл. 15) и абсолютных стандартных энтропий веществ (табл.17) вычислите ΔS 0 298 реакции, протекающей по уравнению
Решение. ∆G 0 = ∆H 0 – TS 0 ; ∆H и ∆S – функции состояния, поэтому
∆Н 0 х.р.=∑ ∆Н 0 прод – ∑ ∆Н 0 исх ; ∆S 0 x.p.= ∑S 0 прод – ∑ S 0 исх
∆Н 0 х.р.=(-393,51+0) – (110,52 – 285,84) = +2,85 кДж
∆S 0 x.p.=(213,65+130,59)-(197,91+69,94) = +76,39 = 0,07639 кДж/(моль∙К);
∆G 0 = +2,85 – 298 ∙ 0,07639 = – 19,91 кДж
Пример 4. Реакция восстановления Fе2О3 водородом протекает по уравнению
Возможна ли эта реакция при стандартных условиях, если изменение энтропии S=0,1387 кДж/(мольК)? При какой температуре начнется восстановление Fе2О3?
Решение. Вычисляем ∆G 0 реакции:
∆G = ∆Н-Т∆S = 96,61 – 298 ∙ 0,1387 = +55,28 кДж
Так как ∆G > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой∆G=0:
Следовательно, при температуре 696,5 К начнется реакция восстановления Fе2О3 Иногда эту температуру называют температурой начала реакции.
Пример 5. Вычислите ∆H 0 , ∆S и ∆G 0 реакции, протекающей по уравнению
Возможна ли реакция восстановления Fе2О3 углеродом при 500 и 1000 К?
Решение. ∆H 0 xp и ∆S 0 xp находим из соотношений (1) и (2) (см. разделы «Энергетика химических процессов. Термохимические расчеты» и «Химическое сродство»):
∆Н 0 x.p.= [3(-110,52)+2 ∙ 0] – [- 822,10 + 3 ∙ 0] = -331,56+822,10 = +490,54 кДж
∆S 0 x.p.=(2 ∙ 27,2+3 ∙ 197,91) – (89,96+3 ∙ 5,69) = 541,1 Дж/(моль ∙ К)
Энергию Гиббса при соответствующих температурах находим из соотношения
http://energoworld.ru/theory/osnovnyie-termodinamicheskie-protsessyi/
http://farmf.ru/lekcii/energetika-himicheskih-protsessov-entalpiya-zakony-termodinamiki/