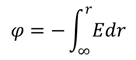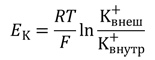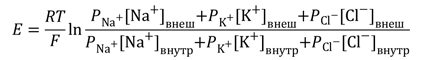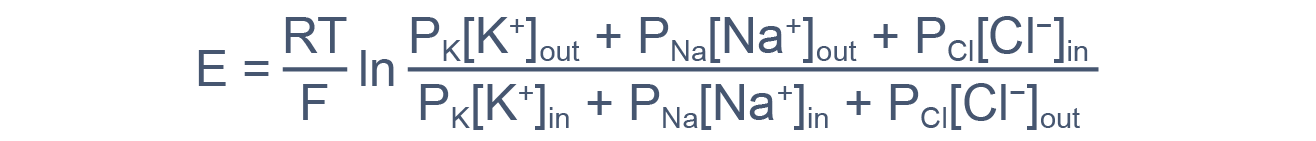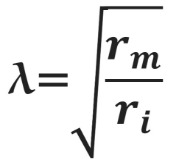2_1 Мембранный потенциал покоя кратко (доцент Сазонов В.Ф.)
Введение
Зачем нам нужно знать, что такое потенциал покоя?
Что такое «животное электричество»? Откуда в организме берутся «биотоки»? Как живая клетка, находящаяся в водной среде, может превратиться в «электрическую батарейку»?
— На эти вопросы мы сможем ответить, если узнаем, как клетка за счёт перераспределения электрических зарядов (заряженных частиц — ионов) создаёт себе электрический потенциал на мембране.
Как работает нервная система? С чего в ней всё начинается? Откуда в ней берётся электричество для нервных импульсов?
— На эти вопросы мы также сможем ответить, если узнаем, как нервная клетка создаёт себе электрический потенциал на мембране.
Итак, понимание того, как работает нервная система, начинается с того, что надо разобраться, как работает отдельная нервная клетка — нейрон.
В основе работы нейрона с нервными импульсами лежит перераспределение электрических зарядов на его мембране и изменение величины электрических потенциалов. Но чтобы потенциал изменять, его нужно для начала иметь. Поэтому можно сказать, что нейрон, готовясь к cвоей нервной работе, создаёт на своей мембране электрический потенциал, как возможность для такой работы.
Таким образом, наш самый первый шаг к изучению работы нервной системы — это понять, каким образом перемещаются электрические заряды в нервных клетках и как за счёт этого на мембране появляется электрический потенцил. Этим мы и займёмся, и назовём этот процесс появления электрического потенциала у нейронов — формирование потенциала покоя.
Определение
В норме, когда клетка готова к работе, у неё уже есть электрический потенциал на поверхности мембраны. Он называется мембранный потенциал покоя.
Потенциал покоя — это разность электрических потенциалов между внутренней и наружной сторонами мембраны, когда клетка находится в состоянии физиологического покоя. Его средняя величина составляет -70 мВ (милливольт).
«Потенциал» — это возможность, он сродни понятию «потенция». Электрический потенциал мембраны — это её возможности по перемещению электрических зарядов, положительных или отрицательных. В роли зарядов выступают заряженные химические частицы — ионы натрия и калия, а также кальция и хлора. Из них только ионы хлора заряжены отрицательно (-), а остальные — положительно (+).
Таблица 1. Физико-химические свойства ионов натрия и калия
Равновесный потенциал, мВ
Предельная температура гидратации, ºС
По таблице видно, что натрий и калий в ионизированном состоянии не отличаются друг от друга по заряду, мало отличаются по размеру и числу создаваемых ими координационных связей, но существенно отличаются по величине предельной температуры, то есть той температуры, выше которой разрешена их гидратация (Тпред). Для натрия она составляет +20°С, а для калия +70°С. Таким образом, по крайней мере в диапазоне температур выше +20°С, в котором функционируют большинство живых организмов, натрий легко взаимодействует с молекулами воды, образуя гидратную оболочку, а калий отталкивает воду. Поскольку гидратированный ион натрия близок по размерам к негидратированному иону калия, то в водных растворах ни по заряду, ни по размерам эти ионы не отличаются друг от друга, и наиболее существенным различием для их различения является величина гидрофобности. Количественно эта величина может быть выражена энергией гидратации, которая при комнатной температуре составляет для натрия +1,03 кДж/моль, а для калия – -1,05 кДж/моль. Очевидно, что биологические молекулы могут использовать именно этот параметр для отбора и распознавания этих двух ионов. В частности, липиды хорошо различают Na + и К + , вероятно, именно благодаря различиям в их гидрофобности. Если, например, приготовить пузырьки-везикулы из смеси природных липидов (такой упрощенный прообраз клеточных везикул называют липосомами ), то оказывается, что скорость простой диффузии через их мембраны будет в 3–7 раз выше для калия, чем для натрия (в зависимости от состава липидов, ионной силы и других условий). Так что в обычных условиях натрию всегда труднее, чем калию, перемещаться через клеточную мембрану. А клетке, соответственно, легче сдерживать перемещение через её мембрану натрия, чем калия. Калий неудержим!
Однако, и Na + , и К + потенциально способны перемещаться под действием электрических сил туда, где преобладают не положительные, а отрицательные электрические заряды (отрицательно заряженные частицы — анионы).
Итак, имея электрический потенциал, мембрана может перемещать в клетку или из клетки указанные выше заряженные ионы с помощью электрических сил.
Важно понимать, что в нервной системе электрические заряды создаются не электронами, как в металлических проводах, а ионами — химическими частицами, имеющими электрический заряд. Электрический ток в организме и его клетках — это поток ионов, а не электронов, как в проводах. Обратите также внимание на то, что заряд мембраны измеряется изнутри клетки, а не снаружи.
Если говорить уж совсем примитивно просто, то получается, что снаружи вокруг клетки будут преобладать «плюсики», т.е. положительно заряженные ионы, а внутри — «минусики», т.е. отрицательно заряженные ионы. Можно сказать, что внутри клетка электроотрицательна. И теперь нам всего лишь надо объяснить, как это так получилось. Хотя, конечно, неприятно сознавать, что все наши клетки — отрицательные «персонажи». ((
Сущность
Сущность потенциала покоя — это преобладание на внутренней стороне мембраны отрицательных электрических зарядов в виде анионов и недостаток положительных электрических зарядов в виде катионов, которые сосредотачиваются на её наружной стороне, а не на внутренней.
Внутри клетки — «отрицательность», а снаружи — «положительность».
Такое положение вещей достигается с помощью трёх явлений: (1) поведения мембраны, (2) поведения положительных ионов калия и натрия и (3) соотношения химической и электрической силы.
1. Поведение мембраны
В поведении мембраны для потенциала покоя важны три процесса:
1) Обмен внутренних ионов натрия на наружные ионы калия. Обменом занимаются специальные транспортные структуры мембраны: ионные насосы-обменники. Таким способом мембрана перенасыщает клетку калием, но обедняет натрием.
2) Открытые калиевые ионные каналы. Через них калий может как заходить в клетку, так и выходить из неё. Он выходит в основном.
3) Закрытые натриевые ионные каналы. Из-за этого натрий, выведенный из клетки насосми-обменниками, не может вернуться в неё обратно. Натриевые каналы открываются только при особых условиях — и тогда потенциал покоя нарушается и смещается в сторону нуля (это называется деполяризацией мембраны, т.е. уменьшением полярности).
2. Поведение ионов калия и натрия
Ионы калия и натрия по-разному перемещаются через мембрану:
2) Через постоянно открытые калиевые каналы калий выходит из клетки, но может и возвращаться в неё обратно через них же.
3) Натрий «хочет» войти в клетку, но «не может», т.к. каналы для него закрыты.
3. Соотношение химической и электрической силы
По отношению к ионам калия между химической и электрической силой устанавливается равновесие на уровне — 70 мВ.
1) Химическая сила выталкивает калий из клетки, но стремится затянуть в неё натрий.
2) Электрическая сила стремится затянуть в клетку любые положительно заряженные ионы (как натрий, так и калий).
Формирование потенциала покоя
Попробую рассказать коротко, откуда берётся мембранный потенциал покоя в нервных клетках — нейронах. Ведь, как всем теперь известно, наши клетки только снаружи положительные, а внутри они весьма отрицательные, и в них существует избыток отрицательных частиц — анионов и недостаток положительных частиц — катионов.
И вот тут исследователя и студента поджидает одна из логических ловушек: внутренняя электроотрицательность клетки возникает не из-за появления лишних отрицательных частиц (анионов), а наоборот — из-за потери некоторого количества положительных частиц (катионов).
И поэтому сущность нашего рассказа будет заключаться не в том, что мы объясним, откуда берутся отрицательные частицы в клетке, а в том, что мы объясним, каким образом в нейронах получается дефицит положительно заряженных ионов — катионов.
Куда же деваются из клетки положительно заряженные частицы? Напомню, что это ионы натрия — Na + и калия — K + . Удивительно, но оба этих иона покидают клетку, хотя и разными путями.
С чего начать, чтобы не сбиться и не запутаться? Начнём с калия.
Чтобы легче было запомнить, образно можно сказать так:
«Клетка любит калий!»
или: «клетка копит калий!» (К + )
и «ненавидит натрий» (Na + ).
И что же она, клетка, делает с этими ионами? Она их обменивает друг на друга! С помощью специального обменного насоса.
Натрий-калиевый насос
Дело заключается в том, что в мембране нервной клетки постоянно работают насосы-обменники, образованные специальными белками, встроенными в мембрану. Что они делают? Они меняют «собственный» натрий клетки на наружный «чужой» калий. Из-за этого в клетке оказывается в конце концов недостаток натрия, который ушёл на обмен. И в то же время клетка переполняется ионами калия, который в неё натащили эти молекулярные насосы.
Итак: «Клетка любит калий!« (Хотя об истинной любви здесь, разумеется, не может идти и речи!) Поэтому она и затаскивает калий в себя, несмотря на то, что его итак уже полно. Поэтому она невыгодно обменивает его на натрий, отдавая 3 иона натрия за 2 иона калия (любимого). Поэтому она тратит на этот обмен энергию АТФ. И как тратит! До 70% всех энергозатрат нейрона может уходить на работу натрий-калиевых насосов. Вот что делает любовь, пусть даже не настоящая!
Кстати, интересно, что клетка не рождается с потенциалом покоя в готовом виде. Например, при дифференцировке и слиянии миобластов при формировании мышечного волокна потенциал их мембраны изменяется от -10 до -70 mV, т.е. их мембрана становится более электроотрицательной, она поляризуется в процессе дифференцировки. А в экспериментах на мультипотентных мезенхимальных стромальных клетках (ММСК) костного мозга человека искусственная деполяризация ингибировала дифференцировку клеток (Fischer-Lougheed J., Liu J.H., Espinos E. et al. Human myoblast fusion requires expression of functional inward rectifier Kir2.1 channels. Journal of Cell Biology 2001; 153: 677-85; Liu J.H., Bijlenga P., Fischer-Lougheed J. et al. Role of an inward rectifier K+ current and of hyperpolarization in human myoblast fusion. Journal of Physiology 1998; 510: 467-76; Sundelacruz S., Levin M., Kaplan D.L. Membrane potential controls adipogenic and osteogenic differentiation of mesenchymal stem cells. Plos One 2008; 3 ).
Образно говоря, можно выразиться так:
Создавая потенциал покоя, клетка «заряжается любовью».
Это любовь к двум вещам:
1) любовь клетки к калию,
2) любовь калия к свободе.
Как ни странно, но результат этих двух видов любви — пустота!
Именно она, пустота, создаёт в клетке отрицательный электрический потенциал — потенциал покоя. Точнее, отрицательный потенциал создают пустые места, оставшиеся от убежавшего из клетки калия.
Итак, результат деятельности мембранных ионных насосов-обменников таков:
Натрий-калиевый ионный насос-обменник создаёт три потенциала (возможности):
1. Электрический потенциал — возможность притягивать внутрь клетки любые положительно заряженные частицы (ионы).
2. Ионный натриевый химический потенциал — возможность затягивать внутрь клетки ионы натрия (и именно натрия, а не какого-нибудь другого вещества).
3. Ионный калиевый химический потенциал — возможновть выталкивать из клетки ионы калия (и именно калия, а не какого-нибудь другого вещества).
4. Дефицит натрия (Na + ) в клетке.
5. Избыток калия (K + ) в клетке.
Можно сказать так: ионные насосы мембраны создают разность концентраций ионов, или градиент (перепад) концентрации, между внутриклеточной и внеклеточной средой.
Именно из-за получившегося дефицита натрия в клетку теперь «полезет» этот самый натрий снаружи. Так всегда ведут себя вещества: они стремятся выровнять свою концентрацию во всём объёме раствора.
И в то же время в клетке получился избыток ионов калия по сравнению с наружной средой. Потому что насосы мембраны накачали его в клетку. И он стремится уравнять свою концентрацию внутри и снаружи, и поэтому стремится выйти из клетки.
Тут ещё важно понять, что ионы натрия и калия как бы «не замечают» друг друга, они реагируют только «на самих себя». Т.е. натрий реагирует на концентрацию натрия же, но «не обращает внимания» на то, сколько вокруг калия. И наоборот, калий реагирует только на концентрацию калия и «не замечает» натрий. Получается, что для понимания поведения ионов в клетке надо по-отдельности сравнивать концентрации ионов натрия и калия. Т.е. надо отдельно сравнить концентрацию по натрию внутри и снаружи клетки и отдельно — концентрацию калия внутри и снаружи клетки, но не имеет смысла сравнивать натрий с калием, как это часто делается в учебниках.
По закону выравнивания концентраций, который действует в растворах, натрий «хочет» снаружи войти в клетку. Но не может, так как мембрана в обычном состоянии плохо его пропускает. Его заходит немножко, и клетка его опять тут же обменивает на наружный калий. Поэтому натрий в нейронах всегда в дефиците.
А вот калий как раз может легко выходить из клетки наружу! В клетке его полно, и она его удержать не может. Так вот он и выходит наружу через особые белковые дырочки в мембране (ионные каналы).
Анализ
От химического — к электрическому
А теперь — самое главное, следите за излагаемой мыслью! Мы должны перейти от движения химических частиц к движению электрических зарядов.
Калий заряжен положительным зарядом, и поэтому он, когда выходит из клетки, выносит из неё не только себя, но и «плюсики» (положительные заряды). На их месте в клетке остаются «минусы» (отрицательные заряды). Это и есть мембранный потенциал покоя!
Мембранный потенциал покоя — это дефицит положительных зарядов (положительно заряженных ионов) внутри клетки, образовавшийся за счёт утечки из клетки положительных ионов калия.
Заключение
Рис. Схема формирования потенциала покоя (ПП). Автор благодарит Попову Екатерину Юрьевну за помощь в создании рисунка.
Составные части потенциала покоя
Потенциал покоя — отрицательный со стороны клетки и состоит как бы из двух частей.
1. Первая часть — это примерно -10 милливольт, которые получаются от неравносторонней работы мембранного насоса-обменника (ведь он больше выкачивает «плюсиков» с натрием, чем закачивает обратно с калием).
2. Вторая часть — это утекающий всё время из клетки калий, утаскивающий положительные заряды из клетки. Он дает большую часть мембранного потенциала, доводя его до -70 милливольт.
Калий перестанет выходить из клетки (точнее, его вход и выход сравняются) только при уровне электроотрицательности клетки в -90 милливольт. Но этому мешает постоянно подтекающий в клетку натрий, который тащит с собой свои положительные заряды. И в клетке поддерживается равновесное состояние на уровне -70 милливольт.
Обратите внимание на то, что для создания потенциала покоя нужны затраты энергии. Эти затраты производятся ионными насосами, которые обменивают «свой» внутренний натрий (ионы Na + ) на «чужой» внешний калий (K + ). Вспомним, что ионные насосы являются ферментами АТФазами и расщепляют АТФ, получая из неё энергию на указанный обмен ионов разного типа друг на друга.Тут очень важно понять, что с мембраной «работают» сразу 2 потенциала: химический (концентрационный градиент ионов) и электрический (разность электрических потенциалов по разные стороны мембраны). Ионы перемещаются в ту или иную сторону под действием обеих этих сил, на которые и тратится энергия. При этом один из двух потенциалов (химический или электрический) уменьшается, а другой увеличивается. Разумеется, если рассматривать электрический потенциал (разность потенциалов) отдельно, то не будут учитываться «химические» силы, перемещающие ионы. И тогда может сложиться неверное впечатление о том, что энергия на движение ионо берётся как бы ниоткуда. Но это не так. Необходимо рассматривать обе силы: химическую и электрическую. При этом крупные молекулы с отрицательными зарядами, находящиеся внутри клетки играют роль «статистов», т.к. их не перемещают через мембрану ни химические, ни электрические силы. Поэтому эти отрицательные частицы обычно и не рассматривают, хотя они существуют и именно они обеспечивают отрицательную сторону разности потенциалов между внутренней и наружной сторонами мембраны. А вот шустрые ионы калия, как раз способны к перемещению, и именно их утечка из клетки под действием химических сил создаёт львиную долю электрического потенциала (разности потенциалов). Ведь именно ионы калия перемещают на наружную сторону мембраны положительные электрические заряды, будучи положительно заряженными частицами.
Так что всё дело в натрий-калиевом мембранном насосе-обменнике и последующем вытекании из клетки «лишнего» калия. За счёт потери положительных зарядов при этом вытекании внутри клетки нарастает электроотрицательность. Она-то и есть «мембранный потенциал покоя». Он измеряется внутри клетки и составляет обычно -70 мВ.
Выводы
Говоря образно, «мембрана превращает клетку в «электрическую батарейку» с помощью управления ионными потоками».
Мембранный потенциал покоя образуется за счёт двух процессов:
1. Работа калий-натриевого насоса мембраны.
Новая гипотеза механизма работы Na,K-АТФазы рассматривается здесь: Механизм натрий-калиевого насоса
Работа калий-натриевого насоса, в свою очередь, имеет 2 следствия:
1.1. Непосредственное электрогенное (порождающее электрические явления) действие ионного насоса-обменника. Это создание небольшой электроотрицательности внутри клетки (-10 мВ).
Виноват в этом неравный обмен натрия на калий. Натрия выбрасывается из клетки больше, чем поступает в обмен калия. А вместе с натрием удаляется и больше «плюсиков» (положительных зарядов), чем возвращается вместе с калием. Возникает небольшой дефицит положительных зарядов. Мембрана изнутри заряжается отрицательно (примерно -10 мВ).
1.2. Создание предпосылок для возникновения большой электроотрицательности.
Эти предпосылки — неравная концентрация ионов калия внутри и снаружи клетки. Лишний калий готов выходить из клетки и выносить из неё положительные заряды. Об этом мы скажем сейчас ниже.
2. Утечка ионов калия из клетки.
Из зоны повышенной концентрации внутри клетки ионы калия выходят в зону пониженной концентрации наружу, вынося заодно положительные электрические заряды. Возникает сильный дефицит положительных зарядов внутри клетки. В итоге мембрана дополнительно заряжается изнутри отрицательно (до -70 мВ).
Финал
Калий-натриевый насос создает предпосылки для возникновения потенциала покоя. Это — разность в концентрации ионов между внутренней и наружной средой клетки. Отдельно проявляет себя разность концентрации по натрию и разность концентрации по калию. Попытка клетки выравнять концентрацию ионов по калию приводит к потере калия, потере положительных зарядов и порождает электроотрицательность внутри клетки. Эта электроотрицательность составляет большую часть потенциала покоя. Меньшую его часть составляет непосредственная электрогенность ионного насоса, т.е. преобладающие потери натрия при его обмене на калий.
Видео: Мембранный потенциал покоя (Resting membrane potential)
Формирование мембранного потенциала покоя
- 62994
- 36,8
- 30
- 30
Потенциал покоя. В мембране открыты калиевые ионные каналы постоянного тока, закрыты натриевые каналы, работает насос-обменник (Na + /K + -АТФаза).
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Потенциал покоя — это важное явление в жизни всех клеток организма, и важно знать, как он формируется. Однако это сложный динамический процесс, трудный для восприятия целиком, особенно для студентов младших курсов (биологических, медицинских и психологических специальностей) и неподготовленных читателей. Впрочем, при рассмотрении по пунктам, вполне возможно понять его основные детали и этапы. В работе вводится понятие потенциала покоя и выделяются основные этапы его формирования с использованием образных метафор, помогающих понять и запомнить молекулярные механизмы формирования потенциала покоя.
«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Мембранные транспортные структуры — натрий-калиевые насосы — создают предпосылки для возникновения потенциала покоя. Предпосылки эти — разность в концентрации ионов на внутренней и наружной сторонах клеточной мембраны. Отдельно проявляет себя разность концентрации по натрию и разность концентрации по калию. Попытка ионов калия (K + ) выровнять свою концентрацию по обе стороны мембраны приводит к его утечке из клетки и потере вместе с ними положительных электрических зарядов, за счёт чего значительно усиливается общий отрицательный заряд внутренней поверхности клетки. Эта «калиевая» отрицательность составляет бóльшую часть потенциала покоя (−60 мВ в среднем), а меньшую его часть (−10 мВ) составляет «обменная» отрицательность, вызванная электрогенностью самого ионного насоса-обменника.
Давайте разбираться подробнее.
Зачем нам нужно знать, что такое потенциал покоя и как он возникает?
Вы знаете, что такое «животное электричество»? Откуда в организме берутся «биотоки»? Как живая клетка, находящаяся в водной среде, может превратиться в «электрическую батарейку» и почему она моментально не разряжается?
На эти вопросы можно ответить только в том случае, если узнать, как клетка создаёт себе разность электрических потенциалов (потенциал покоя) на мембране.
Совершенно очевидно, что для понимания того, как работает нервная система, необходимо вначале разобраться, как работает её отдельная нервная клетка — нейрон. Главное, что лежит в основе работы нейрона — это перемещение электрических зарядов через его мембрану и появление вследствие этого на мембране электрических потенциалов. Можно сказать, что нейрон, готовясь к своей нервной работе, вначале запасает энергию в электрической форме, а затем использует ее в процессе проведения и передачи нервного возбуждения.
Таким образом, наш самый первый шаг к изучению работы нервной системы — это понять, каким образом появляется электрический потенциал на мембране нервных клеток. Этим мы и займёмся, и назовём этот процесс формированием потенциала покоя.
Определение понятия «потенциал покоя»
В норме, когда нервная клетка находится в физиологическом покое и готова к работе, у неё уже произошло перераспределение электрических зарядов между внутренней и наружной сторонами мембраны. За счёт этого возникло электрическое поле, и на мембране появился электрический потенциал — мембранный потенциал покоя.
Как известно из физики, электрические заряды (движущиеся и неподвижные) формируют в пространстве электромагнитное поле, которое влияет на тела, обладающие электрическим зарядом. С точки зрения электромагнетизма клеточную мембрану можно представить как плоский конденсатор, заполненный однородным диэлектриком из неполярных молекул. Если конденсатор заряжен, то внутри него возникает электрическое поле, обусловленное поверхностной плотностью заряда. На поверхности мембраны возникают некомпенсированные заряды: положительные у «отрицательной» поверхности и отрицательные — у «положительной» [6].
Таким образом, мембрана оказывается поляризованной. Это означает, что она имеет разный электрический потенциал наружной и внутренней поверхностей. Разность между этими потенциалами вполне возможно зарегистрировать.
В этом можно убедиться, если ввести внутрь клетки микроэлектрод, соединённый с регистрирующей установкой. Как только электрод попадает внутрь клетки, он мгновенно приобретает некоторый постоянный электроотрицательный потенциал по отношению к электроду, расположенному в окружающей клетку жидкости. Величина внутриклеточного электрического потенциала у нервных клеток и волокон, например, гигантских нервных волокон кальмара, в покое составляет около −70 мВ. Эту величину называют мембранным потенциалом покоя (МПП). Во всех точках аксоплазмы этот потенциал практически одинаков.
Ноздрачёв А.Д. и др. Начала физиологии [5].
Ещё немного физики. Макроскопические физические тела, как правило, электрически нейтральны, т.е. в них в равных количествах содержатся как положительные, так и отрицательные заряды. Зарядить тело можно, создав в нем избыток заряженных частиц одного вида, например, трением о другое тело, в котором при этом образуется избыток зарядов противоположного вида. Учитывая наличие элементарного заряда (e), полный электрический заряд любого тела можно представить как q = ±N×e, где N — целое число.
Потенциал электростатического поля φ определяется как отношение потенциальной энергии W пробного заряда q к величине этого заряда: φ = W/q, откуда следует, что потенциал численно равен потенциальной энергии, которой обладает в данной точке поля единичный положительный заряд. Единицей измерения потенциала служит вольт (1 В) [4]. В некоторых случаях потенциал электрического поля нагляднее определяется как физическая величина, численно равная работе внешних сил против сил электрического поля E при перемещении единичного положительного точечного заряда из бесконечности в данную точку. Последнее определение удобно записать следующим образом:
В электрофизиологии кроме потенциала покоя рассматриваются и другие электрические потенциалы: локальные постсинаптические и рецепторные потенциалы (возбуждающие и тормозные), электротонические и следовые потенциалы, миниатюрные потенциалы концевой пластинки, концентрационный потенциал и потенциал действия [5].
Потенциал покоя — это разность электрических потенциалов, имеющихся на внутренней и наружной сторонах мембраны, когда клетка находится в состоянии физиологического покоя. Его величина измеряется изнутри клетки, она отрицательна и составляет в среднем −70 мВ (милливольт), хотя в разных клетках может быть различной: от −35 мВ до −90 мВ.
Важно учитывать, что в нервной системе электрические заряды представлены не электронами, как в обычных металлических проводах, а ионами — химическими частицами, имеющими электрический заряд. И вообще в водных растворах в виде электрического тока перемещаются не электроны, а ионы. Поэтому все электрические токи в клетках и окружающей их среде — это ионные токи.
Итак, изнутри клетка в покое заряжена отрицательно, а снаружи — положительно. Это свойственно всем живым клеткам, за исключением, разве что, эритроцитов, которые, наоборот, заряжены отрицательно снаружи. Если говорить конкретнее, то получается, что снаружи вокруг клетки будут преобладать положительные ионы (катионы Na + и K + ), а внутри — отрицательные ионы (анионы органических кислот, не способные свободно перемещаться через мембрану, как Na + и K + ).
Теперь нам всего лишь осталось объяснить, каким же образом всё получилось именно так. Хотя, конечно, неприятно сознавать, что все наши клетки кроме эритроцитов только снаружи выглядят положительными, а внутри они — отрицательные.
Термин «отрицательность», который мы будем применять для характеристики электрического потенциала внутри клетки, пригодится нам для простоты объяснения изменений уровня потенциала покоя. В этом термине ценно то, что интуитивно понятно следующее: чем больше отрицательность внутри клетки — тем ниже в отрицательную сторону от нуля смещён потенциал, а чем меньше отрицательность — тем ближе отрицательный потенциал к нулю. Это намного проще понять, чем каждый раз разбираться в том, что же именно означает выражение «потенциал возрастает» — возрастание по абсолютному значению (или «по модулю») будет означать смещение потенциала покоя вниз от нуля, а просто «возрастание» — смещение потенциала вверх к нулю. Термин «отрицательность» не создаёт подобных проблем неоднозначности понимания.
Сущность формирования потенциала покоя
Попробуем разобраться, откуда берётся электрический заряд нервных клеток, хотя их никто не трёт, как это делают физики в своих опытах с электрическими зарядами.
Здесь исследователя и студента поджидает одна из логических ловушек: внутренняя отрицательность клетки возникает не из-за появления лишних отрицательных частиц (анионов), а, наоборот, из-за потери некоторого количества положительных частиц (катионов)!
Так куда же деваются из клетки положительно заряженные частицы? Напомню, что это покинувшие клетку и скопившиеся снаружи ионы натрия — Na + — и калия — K + .
Главный секрет появления отрицательности внутри клетки
Сразу откроем этот секрет и скажем, что клетка лишается части своих положительных частиц и заряжается отрицательно за счёт двух процессов:
- вначале она обменивает «свой» натрий на «чужой» калий (да-да, одни положительные ионы на другие, такие же положительные);
- потом из неё происходит утечка этих «наменянных» положительных ионов калия, вместе с которыми из клетки утекают положительные заряды.
Эти два процесса нам и надо объяснить.
Первый этап создания внутренней отрицательности: обмен Na + на K +
В мембране нервной клетки постоянно работают белковые насосы-обменники (аденозинтрифосфатазы, или Na + /K + -АТФазы), встроенные в мембрану. Они меняют «собственный» натрий клетки на наружный «чужой» калий.
Но ведь при обмене одного положительного заряда (Na + ) на другой такой же положительный заряд (K + ) никакого дефицита положительных зарядов в клетке возникать не может! Правильно. Но, тем не менее, из-за этого обмена в клетке остаётся очень мало ионов натрия, потому что они почти все ушли наружу. И в то же время клетка переполняется ионами калия, которые в неё накачали молекулярные насосы. Если бы мы могли попробовать на вкус цитоплазму клетки, мы бы заметили, что в результате работы насосов-обменников она превратилась из солёной в горько-солёно-кислую, потому что солёный вкус хлорида натрия сменился сложным вкусом довольно-таки концентрированного раствора хлорида калия. В клетке концентрация калия достигает 0,4 моль/л. Растворы хлорида калия в пределах 0,009–0,02 моль/л имеют сладкий вкус, 0,03–0,04 — горький, 0,05–0,1 — горько-солёный, а начиная с 0,2 и выше — сложный вкус, состоящий из солёного, горького и кислого [8].
Важно здесь то, что обмен натрия на калий — неравный. За каждые отданные клеткой три иона натрия она получает всего два иона калия. Это приводит к потере одного положительного заряда при каждом акте ионного обмена. Так что уже на этом этапе за счёт неравноценного обмена клетка теряет больше «плюсов», чем получает взамен. В электрическом выражении это составляет примерно −10 мВ отрицательности внутри клетки. (Но помните, что нам надо ещё найти объяснение для оставшихся −60 мВ!)
Чтобы легче было запомнить работу насосов-обменников, образно можно выразиться так: «Клетка любит калий!» Поэтому клетка и затаскивает калий к себе, несмотря на то, что его и так в ней полно. И поэтому она невыгодно обменивает его на натрий, отдавая 3 иона натрия за 2 иона калия. И поэтому она тратит на этот обмен энергию АТФ. И как тратит! До 70% всех энергозатрат нейрона может уходить на работу натрий-калиевых насосов. (Вот что делает любовь, пусть она даже и не настоящая!)
Кстати, интересно, что клетка не рождается с готовым потенциалом покоя. Ей его ещё надо создать. Например, при дифференцировке и слиянии миобластов потенциал их мембраны изменяется от −10 до −70 мВ, т.е. их мембрана становится более отрицательной — поляризуется в процессе дифференцировки. А в экспериментах на мультипотентных мезенхимальных стромальных клетках костного мозга человека искусственная деполяризация, противодействующая потенциалу покоя и уменьшающая отрицательность клеток, даже ингибировала (угнетала) дифференцировку клеток [1].
Образно говоря, можно выразиться так: Создавая потенциал покоя, клетка «заряжается любовью». Это любовь к двум вещам:
- любовь клетки к калию (поэтому клетка насильно затаскивает его к себе);
- любовь калия к свободе (поэтому калий покидает захватившую его клетку).
Механизм насыщения клетки калием мы уже объяснили (это работа насосов-обменников), а механизм ухода калия из клетки объясним ниже, когда перейдём к описанию второго этапа создания внутриклеточной отрицательности. Итак, результат деятельности мембранных ионных насосов-обменников на первом этапе формирования потенциала покоя таков:
- Дефицит натрия (Na + ) в клетке.
- Избыток калия (K + ) в клетке.
- Появление на мембране слабого электрического потенциала (−10 мВ).
Можно сказать так: на первом этапе ионные насосы мембраны создают разность концентраций ионов, или градиент (перепад) концентрации, между внутриклеточной и внеклеточной средой.
Второй этап создания отрицательности: утечка ионов K + из клетки
Итак, что начинается в клетке после того, как с ионами поработают её мембранные натрий-калиевые насосы-обменники?
Из-за образовавшегося дефицита натрия внутри клетки этот ион при каждом удобном случае норовит устремиться внутрь: растворённые вещества всегда стремятся выровнять свою концентрацию во всём объёме раствора. Но это у натрия получается плохо, поскольку ионные натриевые каналы обычно закрыты и открываются только при определённых условиях: под воздействием специальных веществ (трансмиттеров) или при уменьшении отрицательности в клетке (деполяризации мембраны).
В то же время в клетке имеется избыток ионов калия по сравнению с наружной средой — потому что насосы мембраны насильно накачали его в клетку. И он, тоже стремясь уравнять свою концентрацию внутри и снаружи, норовит, напротив, выйти из клетки. И это у него получается!
Ионы калия K + покидают клетку под действием химического градиента их концентрации по разные стороны мембраны (мембрана значительно более проницаема для K + , чем для Na + ) и уносят с собой положительные заряды. Из-за этого внутри клетки нарастает отрицательность.
Тут ещё важно понять то, что ионы натрия и калия как бы «не замечают» друг друга, они реагируют только «на самих себя». Т.е. натрий реагирует на концентрацию натрия же, но «не обращает внимания» на то, сколько вокруг калия. И наоборот, калий реагирует только на концентрацию калия и «не замечает» натрий. Получается, что для понимания поведения ионов надо по отдельности рассматривать концентрации ионов натрия и калия. Т.е. надо отдельно сравнить концентрацию по натрию внутри и снаружи клетки и отдельно — концентрацию по калию внутри и снаружи клетки, но не имеет смысла сравнивать натрий с калием, как это, бывает, делается в учебниках.
По закону выравнивания химических концентраций, который действует в растворах, натрий «хочет» снаружи войти в клетку; туда же его влечёт и электрическая сила (как мы помним, цитоплазма заряжена отрицательно). Хотеть-то он хочет, но не может, так как мембрана в обычном состоянии плохо его пропускает. Натриевые ионные каналы, имеющиеся в мембране, в норме закрыты. Если все же его заходит немножко, то клетка сразу же обменивает его на наружный калий с помощью своих натрий-калиевых насосов-обменников. Получается, что ионы натрия проходят через клетку как бы транзитом и не задерживаются в ней. Поэтому натрий в нейронах всегда в дефиците.
А вот калий как раз может легко выходить из клетки наружу! В клетке его полно, и она его удержать не может. Он выходит наружу через особые каналы в мембране — «калиевые каналы утечки», которые в норме открыты и выпускают калий [5, 7].
К + -каналы утечки постоянно открыты при нормальных значениях мембранного потенциала покоя и проявляют взрывы активности при сдвигах мембранного потенциала, которые длятся несколько минут и наблюдаются при всех значениях потенциала. Усиление К + -токов утечки ведёт к гиперполяризации мембраны, тогда как их подавление — к деполяризации. . Однако, существование канального механизма, ответственного за токи утечки, долгое время оставалось под вопросом. Только сейчас стало ясно, что калиевая утечка — это ток через специальные калиевые каналы.
Зефиров А.Л. и Ситдикова Г.Ф. Ионные каналы возбудимой клетки (структура, функция, патология) [7].
От химического — к электрическому
А теперь — ещё раз самое главное. Мы должны осознанно перейти от движения химических частиц к движению электрических зарядов.
Калий (K + ) положительно заряжен, и поэтому он, когда выходит из клетки, выносит из неё не только самого себя, но и положительный заряд. За ним изнутри клетки к мембране тянутся «минусы» — отрицательные заряды. Но они не могут просочиться через мембрану — в отличие от ионов калия — т.к. для них нет подходящих ионных каналов, и мембрана их не пропускает. Помните про оставшиеся необъяснёнными нами −60 мВ отрицательности? Это и есть та самая часть мембранного потенциала покоя, которую создаёт утечка ионов калия из клетки! И это — большая часть потенциала покоя.
Для этой составной части потенциала покоя есть даже специальное название — концентрационный потенциал [5]. Концентрационный потенциал — это часть потенциала покоя, созданная дефицитом положительных зарядов внутри клетки, образовавшимся за счёт утечки из неё положительных ионов калия.
Ну, а теперь немного физики, химии и математики для любителей точности.
Электрические силы связаны с химическими по уравнению Гольдмана. Его частным случаем является более простое уравнение Нернста, по формуле которого можно рассчитать трансмембранную диффузионную разность потенциалов на основе различной концентрации ионов одного вида по разные стороны мембраны. Так, зная концентрацию ионов калия снаружи и внутри клетки, можно рассчитать калиевый равновесный потенциал EK:
где Ек — равновесный потенциал, R — газовая постоянная, Т — абсолютная температура, F — постоянная Фарадея, К + внеш и K + внутр — концентрации ионов К + снаружи и внутри клетки, соответственно. По формуле видно, что для расчёта потенциала между собой сравниваются концентрации ионов одного вида — K + .
Более точно итоговая величина суммарного диффузионного потенциала, который создаётся утечкой нескольких видов ионов, рассчитывается по формуле Гольдмана-Ходжкина-Катца. В ней учтено, что потенциал покоя зависит от трех факторов: (1) полярности электрического заряда каждого иона; (2) проницаемости мембраны Р для каждого иона; (3) [концентраций соответствующих ионов] внутри (внутр) и снаружи мембраны (внеш). Для мембраны аксона кальмара в покое отношение проводимостей РK : PNa :PCl = 1 : 0,04 : 0,45 [5].
Заключение
Итак, поте нциал покоя состоит из двух частей:
- −10 мВ, которые получаются от «несимметричной» работы мембранного насоса-обменника (ведь он больше выкачивает из клетки положительных зарядов (Na + ), чем закачивает обратно с калием).
- Вторая часть — это всё время утекающий из клетки калий, уносящий положительные заряды. Его вклад — основной: −60 мВ. В сумме это и дает искомые −70 мВ.
Что интересно, калий перестанет выходить из клетки (точнее, его вход и выход уравниваются) только при уровне отрицательности клетки −90 мВ. В этом случае сравняются химические и электрические силы, проталкивающие калий через мембрану, но направляющие его в противоположные стороны. Но этому мешает постоянно подтекающий в клетку натрий, который несёт с собой положительные заряды и уменьшает отрицательность, за которую «борется» калий. И в итоге в клетке поддерживается равновесное состояние на уровне −70 мВ.
Вот теперь мембранный потенциал покоя окончательно сформирован.
Схема работы Na + /K + -АТФазы наглядно иллюстрирует «несимметричный» обмен Na + на K + : выкачивание избыточного «плюса» в каждом цикле работы фермента приводит к отрицательному заряжению внутренней поверхности мембраны. Чего в этом ролике не сказано, так это того, что АТФаза ответственна за менее чем 20% потенциала покоя (−10 мВ): оставшаяся «отрицательность» (−60 мВ) появляется за счет выхода из клетки через «калиевые каналы утечки» ионов K + , стремящихся выровнять свою концентрацию внутри клетки и вне нее.
Мембранный потенциал
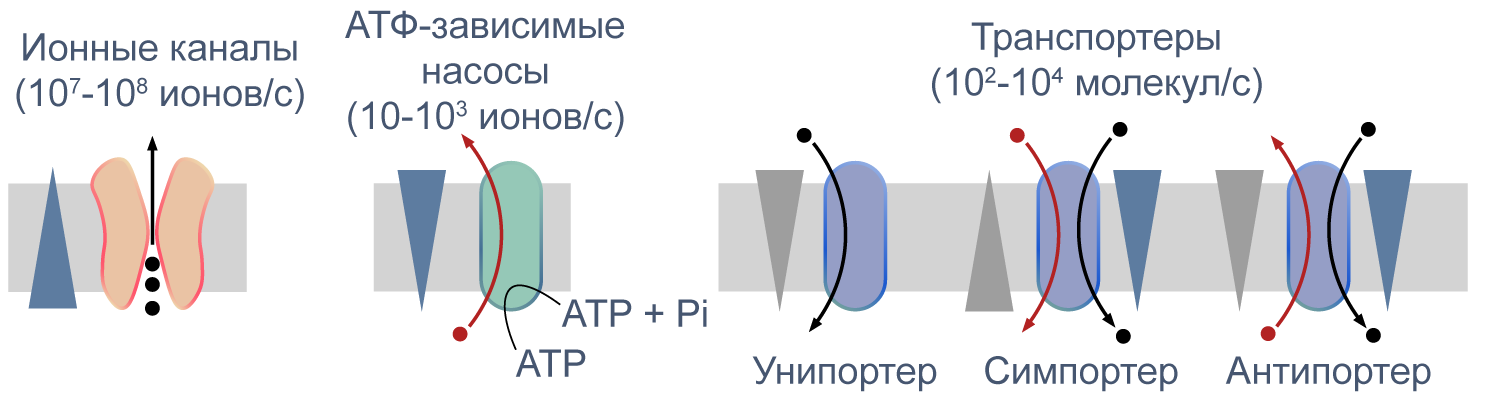
Химический состав живых клеток отличается от внешней среды, причем различия есть не только в сложных молекулах, таких как белки и нуклеиновые кислоты, но и в ионах. Например, во внеклеточной среде преобладают ионы натрия, а в клетке — ионы калия, причем последних на порядок больше. Сама по себе плазматическая мембрана клеток практически непроницаема для ионов, и поэтому для их переноса через мембрану существуют специальные транспортные механизмы — встроенные в мембрану белки. В геноме человека более 800 генов ионных каналов и транспортеров, а общую долю генов, вовлеченных в трансмембранный транспорт, оценивают в 10 % от всех генов, кодирующих белки [1] . В этой серии статей мы рассмотрим механизмы трансмембранного переноса ионов и разнообразие реализуемых ими клеточных функций. Мы также уделим внимание патологиям, вызванным мутациями в генах, кодирующих соответствующие каналы и транспортеры.
Потенциал покоя
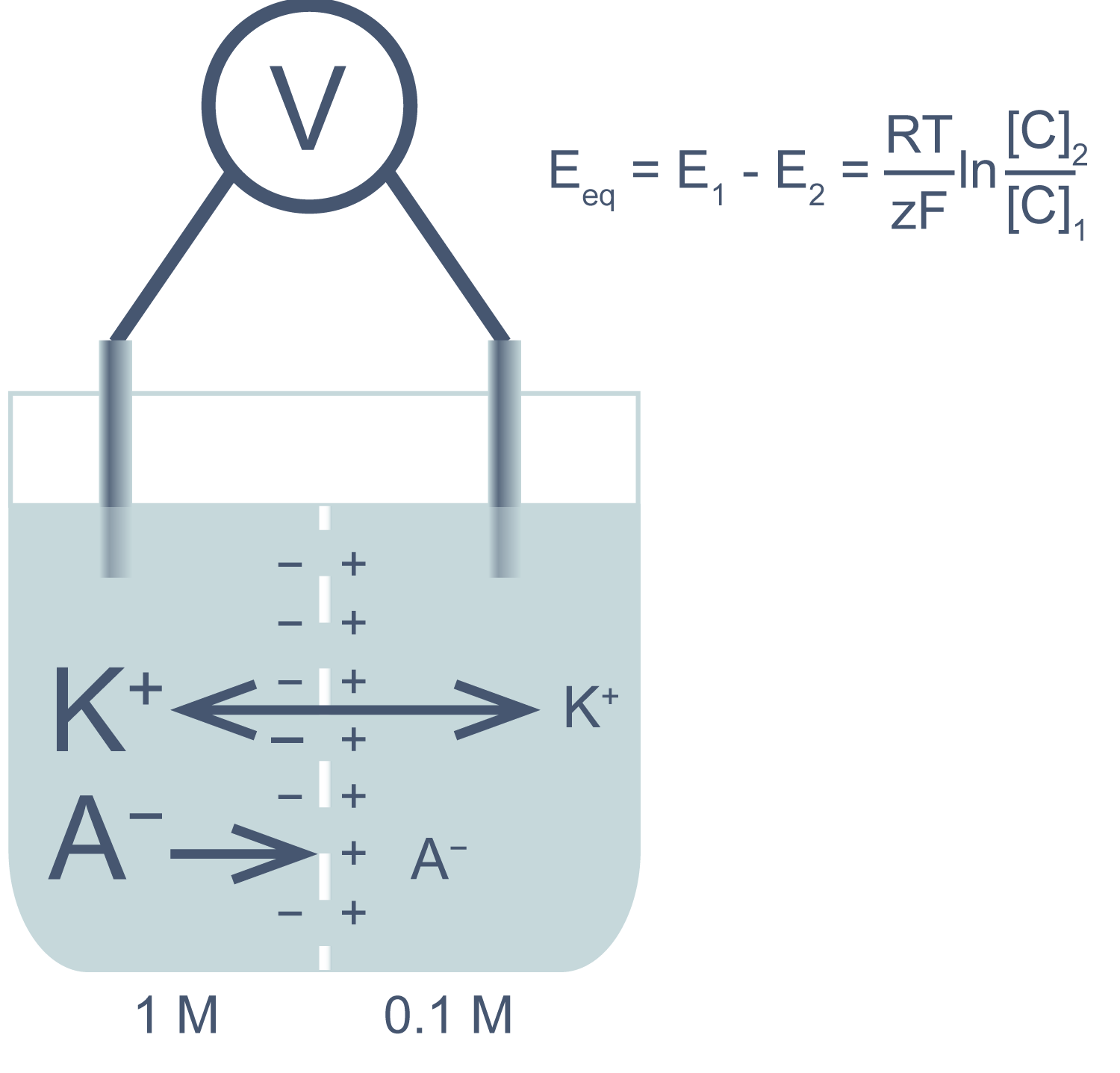
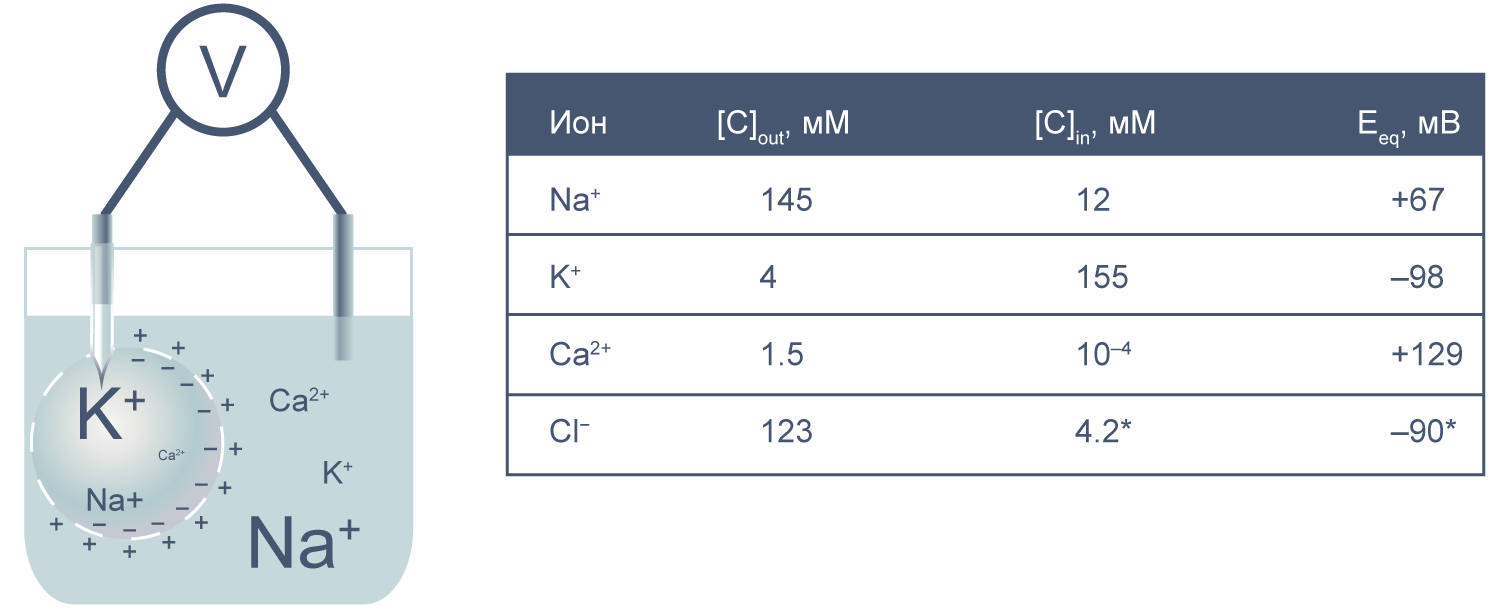
Представим себе электрохимическую ячейку — сосуд, разделенный пополам полупроницаемой мембраной, в левой части которого находится 1,0 М раствор KCl, а в правой — 0,1 М KCl. Через мембрану могут проходить катионы K + , но не анионы Cl − . Ионы K + в результате процесса диффузии будут переходить из левого отсека в правый по градиенту концентрации*, тогда как ионы Cl − , неспособные последовать за катионами, останутся в исходном отсеке. Благодаря такому разделению зарядов на мембране будет накапливаться электрохимический потенциал: избыток анионов с левой стороны мембраны и избыток катионов с правой. Этот потенциал можно измерить, опустив в отсеки электроды, подсоединенные к вольтметру.
Асимметричный поток катионов не будет продолжаться бесконечно: накопленный электрический потенциал (с избытком положительного заряда с левой стороны мембраны) будет противодействовать диффузии ионов калия в левый отсек. Через некоторое время поток ионов K + из правого отсека в левый сравняется по скорости с потоком из левого отсека в правый, и система достигнет равновесия. Для математического описания подобного равновесия применяют уравнение Нернста (рис. 1).
Рисунок 1 | Электрохимическая ячейка. V — вольтметр. Справа приведено уравнение Нернста, где Eeq — равновесный потенциал; E1 – E2 — разность потенциалов по обе стороны мембраны; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура (в кельвинах); F = 96485,55 Кл·моль –1 — константа Фарадея; z — степень окисления иона (его заряд); [C]1, 2 — равновесные концентрации ионов по обе стороны мембраны.
Если принять, что равновесные концентрации ионов K + в нашем примере равны начальным, разность потенциала на мембране при 25 °C приблизительно равна –58 мВ.
Рисунок 2 | Клетка как электрохимическая ячейка. Справа приведены концентрации основных ионов внутри и вне клетки [2] .
Теперь представим, что левая часть нашей электрохимической ячейки — это живая клетка, а правая — внешняя среда. Добавим к этой картине концентрации других физиологически значимых ионов. На мембране клетки также будет накапливаться электрохимический потенциал. Величину электрической составляющей мембранного потенциала измеряют относительно потенциала вне клетки, принимая его за ноль.
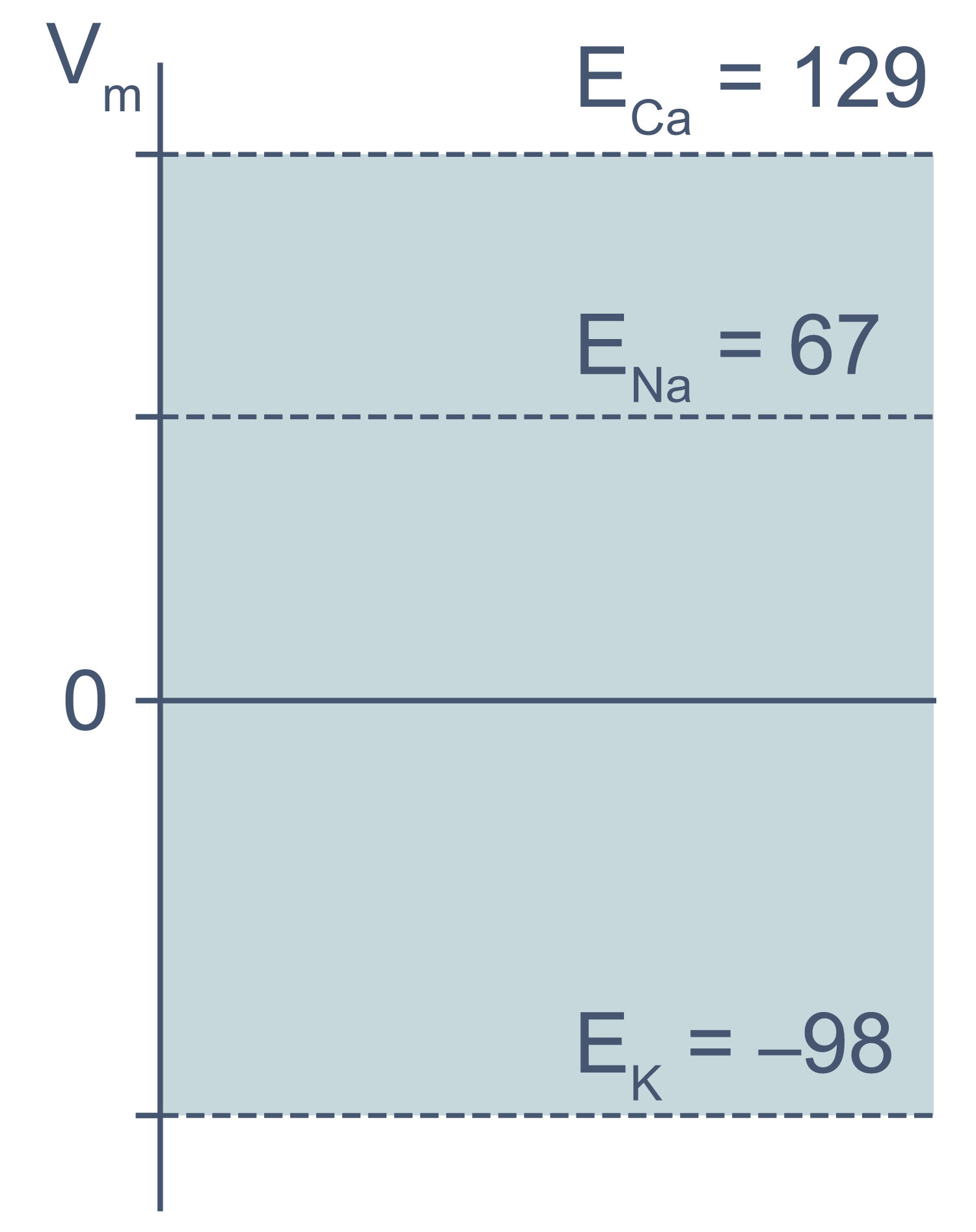
В первом приближении можно сказать, что мембрана клетки проницаема для калия и непроницаема для других катионов (Na + , Ca 2+ ) и анионов (в первую очередь для Cl – и отрицательно заряженных участков макромолекул). Ионы калия, выходя из клетки, создают потенциал покоя. Его величина достаточно близка к значению равновесного потенциала для K + , однако строго не равна ему, поскольку в реальности другие катионы и Cl – могут участвовать в формировании потенциала покоя в различных типах клеток. Вычислив равновесные потенциалы для основных ионов, мы получим динамический диапазон величины потенциала на мембране клетки: он не может быть более отрицательным, чем EK, и не может достигать более положительных значений на пике потенциала действия, чем ECa. Причина такого поведения кроется в том, что система стремится к равновесию, и при малейших отклонениях мембранного потенциала в сторону более отрицательных значений, чем EK, K + будет двигаться по электрохимическому градиенту внутрь клетки, возвращая мембранный потенциал к равновесному потенциалу для калия.
Рисунок 3 | Диапазон возможных значений мембранного потенциала от ЕK до ECa (показан голубым цветом).
Величина потенциала покоя зависит от типа клеток и равна около –30 мВ в невозбудимых клетках и около –80 мВ в возбудимых клетках (нейроны, мышечные и эндокринные клетки). Когда мембранный потенциал более отрицателен, чем потенциал покоя, говорят, что мембрана гиперполяризована, а когда он приближается к нулю или даже принимает положительные значения, говорят о деполяризации мембраны.
В общем случае мембранный потенциал можно вычислить согласно уравнению Гольдмана-Ходжкина-Катца, которое принимает в расчет все основные катионы и анионы:
где E — мембранный потенциал; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура; F = 96485,55 Кл·моль –1 — константа Фарадея; PX — проницаемость мембраны для иона X; [C]in, out — равновесные концентрации ионов внутри и вне клетки. N.B.: для анионов внеклеточная концентрация стоит в знаменателе, а внутриклеточная — в числителе.
Что же обеспечивает проницаемость мембраны для ионов? Заряженные частицы не могут самостоятельно пересекать гидрофобный внутренний слой плазматической мембраны, и поэтому требуются специальные белки, образующие гидрофильную пору, через которую ионы могут двигаться через мембрану. Такие белки называются ионными каналами. Основной вклад в поддержание потенциала покоя вносят калиевые каналы семейств Kir (inward rectifying K + channels — калиевые каналы внутреннего выпрямления) и K2P (two—pore domain K + channels — калиевые каналы с двумя поровыми доменами, которые часто называют каналами утечки), а каналы других семейств могут обеспечивать быстрое изменение мембранного потенциала в возбудимых клетках. Каналы могут селективно пропускать определенный тип ионов, например, K + (как каналы семейства Kir), или более широкий спектр веществ, как, например, коннексины — белки щелевых контактов.
Каналы бывают потенциал-зависимые (потенциал-управляемые), лиганд-зависимые, термо- и механочувствительные — в зависимости от стимула, который управляет открытием и закрытием канала. В роли стимула, таким образом, могут выступать изменения мембранного потенциала, химические агенты, температура, свет, механические и другие стимулы. Один и тот же канал может открываться под действием различных эндо- и экзогенных стимулов. Так, канал TRPV1 активируется повышением температуры более 43 °C [3] , кислым pH [4] и разнообразными химическими веществами: капсаицином (алкалоид из перцев рода Capsicum) [3] , эндоканнабиноидом анандамидом [5] , окситоцином [6] и др.
Физиологическая роль каналов крайне важна. К примеру, мутации в генах, кодирующих белки ионных каналов, лежат в основе патогенеза многих заболеваний человека: некоторых видов эпилепсии [7] , муковисцидоза [8] , некоторых аритмий [9, 10] и др. Ионные каналы служат мишенями действия многих лекарств, ядов и токсинов.
Однако для формирования потенциала покоя недостаточно одних лишь каналов, ведь нужно создавать и поддерживать концентрационные градиенты на мембране. Основной механизм поддержания градиентов концентрации калия и натрия — это Na/K-АТФаза, фермент, за счет гидролиза одной молекулы АТФ переносящий три Na + наружу и два K + внутрь клетки. Она осуществляет электрогенный транспорт: в каждом транспортном цикле при переносе одного дополнительного положительного заряда наружу генерируется некоторая разность потенциалов на мембране. Чтобы оценить этот вклад Na/K-АТФазы в поддержание потенциала покоя, можно заблокировать работу фермента алкалоидом оубаином. Тогда мембрана деполяризуется примерно на 10 мВ [11] .
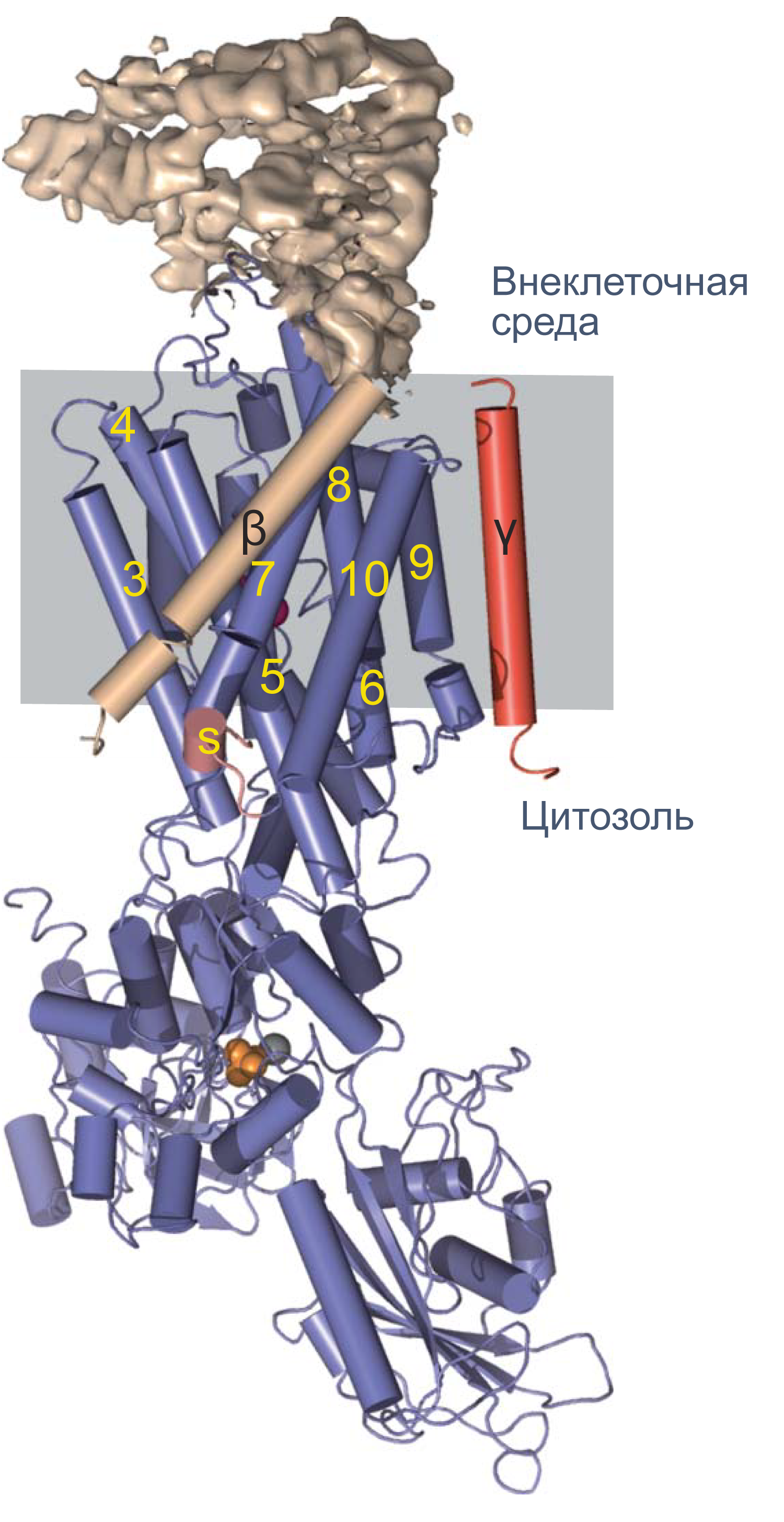
Рисунок 4 | Структура Na/K-АТФазы, полученная методом рентгеновской кристаллографии. Синим цветом показана α-субъединица, красным — γ-субъединица; β-субъединица показана бежевым цветом. Внеклеточная часть β-субъединицы показана в виде электронной плотности. Альфа-спирали изображены цилиндрами, бета-слои — плоскими стрелками [12] .
Активный и пассивный транспорт веществ через мембрану
Процессы транспорта веществ через мембрану можно классифицировать по источнику энергии для транспорта. Пассивный транспорт — это движение вещества через канал или транспортер по градиенту концентрации*, то есть за счет энергии электрохимического градиента. Таким способом через калиевые каналы пассивно движутся ионы калия, или осуществляется перенос глюкозы через транспортер GLUT4 (такой тип транспорта еще называют облегченной диффузией, а транспортеры, переносящие только один субстрат — унипортерами). Кроме пассивного транспорта, существует активный транспорт, при котором субстраты переносятся против градиента концентрации с затратой энергии, запасенной клеткой в виде АТФ (например, Na/K-АТФаза).
Некоторые транспортеры сопрягают перенос ионов или молекул против градиента концентрации с движением ионов по градиенту концентрации. Симпортеры переносят различные частицы в одном направлении (например, KCC2 — K—Cl cotransporter 2 — K/Cl котранспортер 2), а антипортеры, или обменники, — в противоположных (например, NHE-1 — Na/H exchanger 1 — Na/H обменник, участвующий в поддержании клеточного pH). Такой транспорт называется вторично-активным.
Рисунок 5 | Пассивный и активный транспорт веществ через мембрану. Треугольниками показаны концентрационные градиенты. Черными стрелками показано движение по градиенту концентрации, красными — против градиента концентрации. По [13], с изменениями.
В старой литературе можно встретить концепцию «белков-переносчиков»: до открытия молекулярной идентичности многих каналов и транспортеров (т. е. какая молекула опосредует данный ионный ток и какой ген ее кодирует) существовало представление о переносчиках как о челноках, связывающих субстраты с одной стороны мембраны, диффундирующих через мембрану и высвобождающих субстраты с другой стороны. Однако, когда стали известны аминокислотные последовательности транспортных белков, стало понятно, что все они часто содержат многочисленные трансмембранные домены и образуют сквозной путь через мембрану.
Различия между каналами, транспортерами и насосами заключаются в механизме их работы и регуляции. Каналы представляют собой более или менее селективную пору, через которую ионы могут свободно диффундировать, не вызывая конформационных изменений в белке канала. При токе через отдельный канал в 1 пА по нему проходят 6×10 6 одновалентных ионов в секунду. Транспортер, связываясь с субстратом, изменяет свою конформацию для переноса субстрата. При ко-транспорте повышается аффинность транспортера в новой конформации к второму субстрату, и субстраты переносятся через мембрану сопряженно. Насосы, также называемые АТФазами, (ауто)фосфорилируются АТФ, и это фосфорилирование значительно изменяет их конформацию и приводит к транслокации субстратов через мембрану. Электрическая проводимость насосов очень мала: Na/K-АТФаза переносит всего около 300 Na + и 200 K + в секунду.
Граница между молекулами каналов и транспортеров не всегда строга. Например, семейство хлоридных каналов и транспортеров ClC (англ. Chloride Channel) включает в себя гомологичные друг другу каналы (ClC-1, 2, Ka и Kb) и Cl/H-обменники (ClC-3–7), которые можно превратить в каналы, внеся мутацию в единственный остаток глутамата (т. н. gating glutamate — воротный глутамат) [14]. Na/K-АТФазу также можно превратить в простую пору, например, с помощью палитоксина [15] . Хлоридный канал CFTR относится к группе ABC-транспортеров, однако он использует энергию АТФ не для транспорта ионов, а для регуляции открытия и закрытия канала [16] . Кроме того, существуют данные о том, что везикулярный транспортер глутамата VGLUT1 кроме обмена глутамата на протоны также опосредует не сопряженный с обменом ток Cl − [17] .
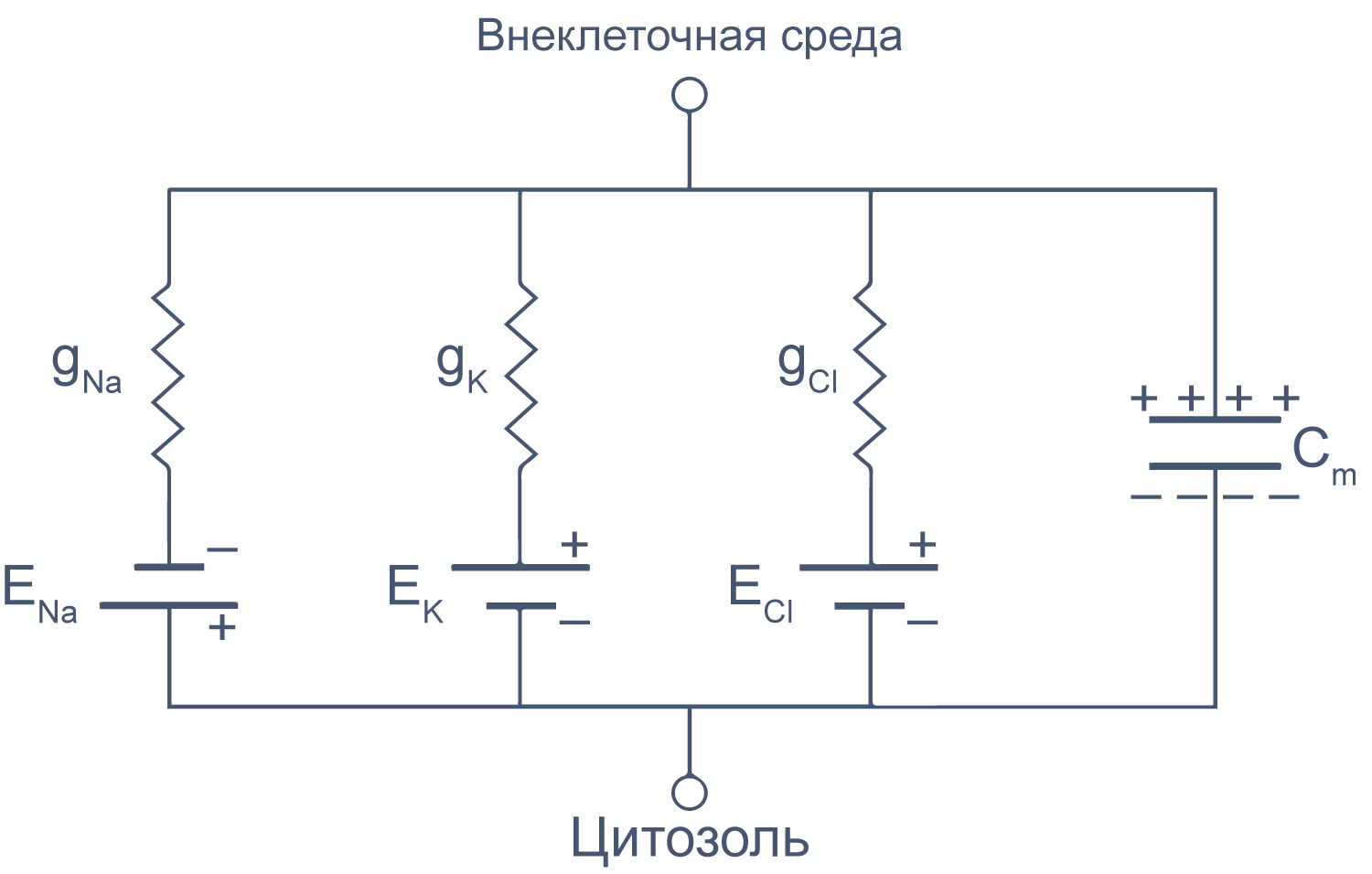
Клеточная мембрана как электрическая цепь
Липидный бислой мембраны можно представить как резистор (сопротивление) и конденсатор (емкость), соединенные параллельно. Величина сопротивления зависит от плотности каналов в мембране и их функционального состояния. Электроемкость возникает из-за разделения зарядов по обе стороны мембраны тонким слоем диэлектрика (гидрофобными хвостами фосфолипидов).
Рисунок 6 | Плазматическая мембрана, представленная в виде RC схемы. gNa, gK, gCl — проводимость** мембраны для ионов Na + , K + и Cl – , соответственно; ENa, EK, ECl — электродвижущая сила, или равновесные потенциалы для соответствующих ионов, Сm — электроемкость мембраны.
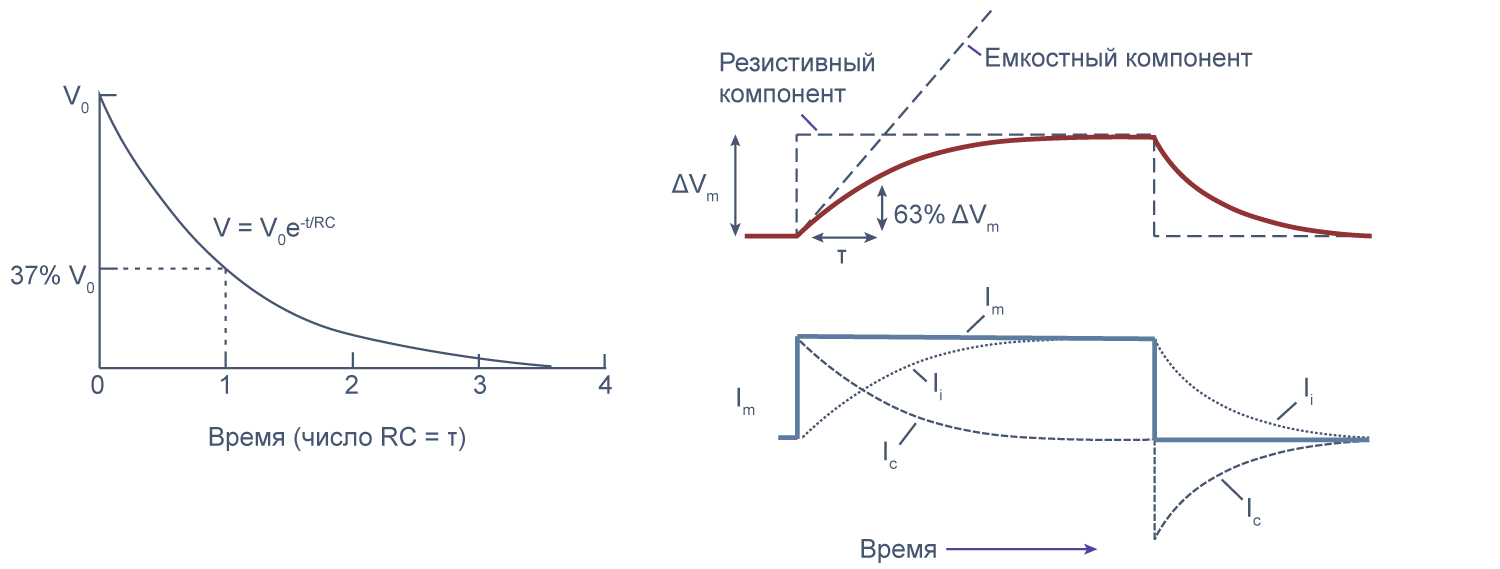
Можно считать, что проводимость (величина, обратная сопротивлению, измеряемая в сименсах) характеризует проницаемые для ионов компоненты структуры мембраны, а емкость — не проницаемые для ионов структуры. Удельная емкость мембраны составляет приблизительно 1 мкФ/см 2 или 0,01 пФ/мкм 2 *** и мало зависит от типа клеток [2] . Это позволяет оценить размер клетки по ее электрическим характеристикам. Высокая электроемкость клеточных мембран задерживает изменения потенциала в ответ на ток. Эту задержку можно выразить через постоянную времени τ, которая равна произведению емкости и параллельно соединенного с ней сопротивления (RC). Если конденсатор зарядить на некоторую величину, а затем дать ему разрядиться через резистор, то потенциал будет убывать экспоненциально согласно формуле V = V0e –t/RC , то есть за каждые τ = RC секунд потенциал будет падать в 1/e раз (на 37 % от исходной величины). Этот расчет применим и к клеточной мембране: падение напряжения при разрядке мембраны будет подчиняться экспоненциальному закону. То есть, если приложить гипер- или деполяризующий стимул, то мембранный потенциал через время τ достигнет 63 % конечного сдвига.
Рисунок 7 | Падение напряжения при разрядке мембраны. Изменение мембранного потенциала при деполяризации мембраны на ΔVm [22] , Ic — емкостный ток, Ii — ионный ток, Im — суммарный ток через мембрану. Пояснения в тексте.
Потенциал действия
Возбудимые клетки могут быстро изменять потенциал на мембране и этим запускать внутриклеточные процессы, например, мышечное сокращение или экзоцитоз везикул. Кратковременный локальный скачок мембранного потенциала от приблизительно –80 мВ (значения потенциала покоя) до 0…+20 мВ за счет изменения проницаемости мембраны для ионов называется потенциалом действия.
Для начала рассмотрим потенциал действия в аксонах нейрона на примере гигантского аксона кальмара. Выбор столь экзотического объекта обусловлен историческими причинами. Современная микроэлектродная техника — использование тонких стеклянных микропипеток, заполненных раствором электролита, — была предложена лишь в 1949 году Дж. Лингом и Р. Джерардом [18] . До этого поместить электрод, представлявший собой тонкую проволоку, внутрь клетки, не разрушив ее, можно было только в случае ее крупных размеров. Гигантский аксон кальмара стал идеальным модельным объектом для изучения потенциала действия: его диаметр может достигать 0,5–1 мм. Этот отросток служит для быстрой передачи нервных импульсов у беспозвоночных, у которых отсутствует миелинизация. Внутренним содержимым аксона легко манипулировать, заменяя ионный состав внутриклеточного раствора, а внутрь такого аксона можно поместить электрод для регистрации мембранного потенциала.
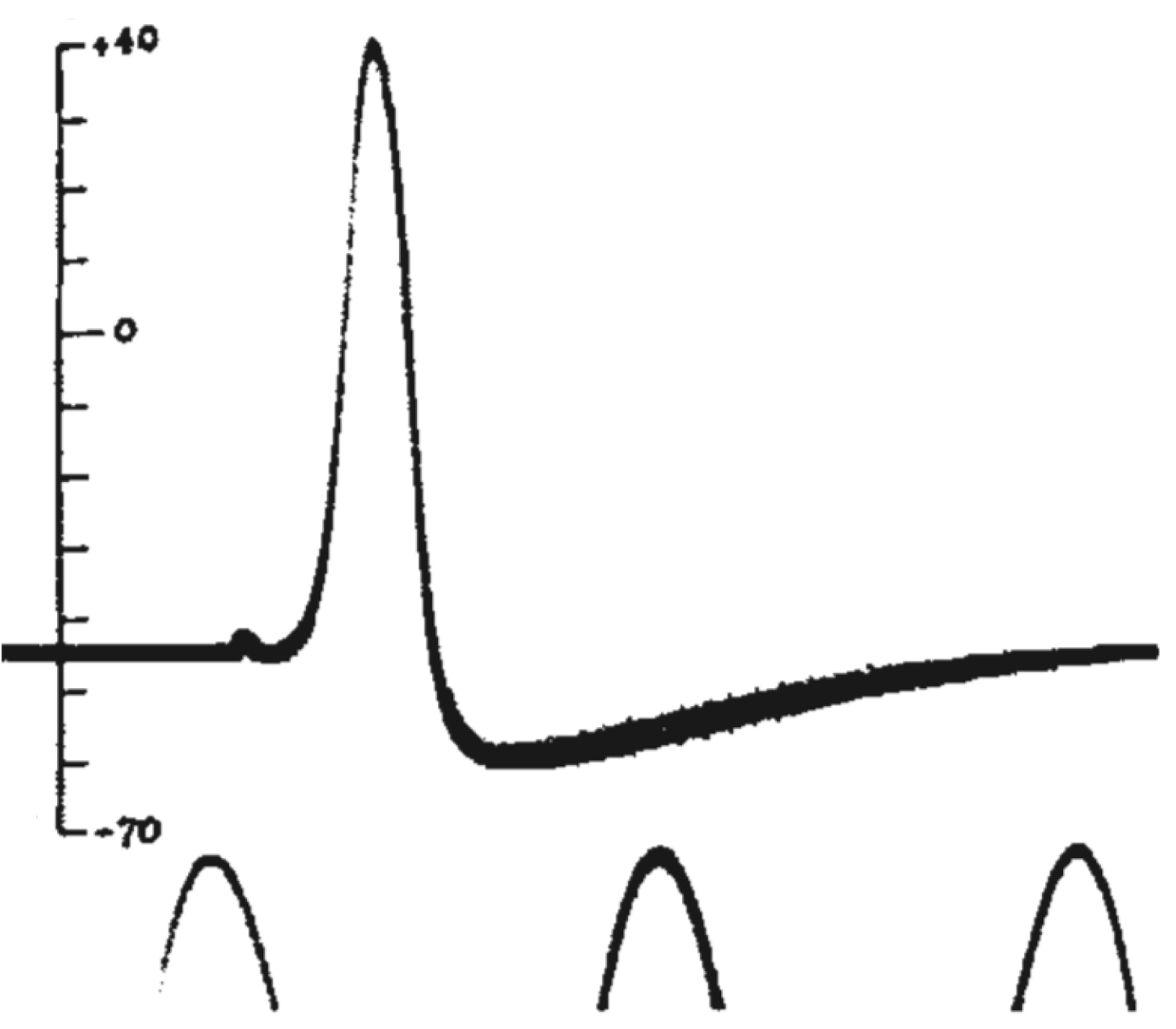
Так, в 1939 году А. Ходжкин и Э. Хаксли опубликовали в журнале Nature короткую заметку «Потенциалы действия, зарегистрированные внутри нервного волокна» [19] , в которой они описали первый эксперимент по внутриклеточному измерению мембранного потенциала на гигантском аксоне кальмара. Посмотрим на потенциалы действия, которые зарегистрировали исследователи.
Рисунок 8 | Потенциал действия из статьи А. Ходжкина и Э. Хаксли 1939 года [19] . Потенциал действия был зарегистрирован как разность потенциала между внутренней средой аксона и внешней средой. Пики внизу рисунка — это фрагменты синусоидального сигнала с частотой 500 Гц. Вертикальной чертой отмечен потенциал внутреннего электрода в милливольтах, потенциал морской воды снаружи аксона был принят за ноль.
Мы видим резкую деполяризацию мембраны до положительных значений, а затем более плавное возвращение потенциала к отрицательным значениям, зачастую более отрицательным, чем величина потенциала покоя. Из этих наблюдений следовало два важных вывода: 1) потенциал действия генерируется мембраной клетки, что не было очевидно в 1930-е годы; 2) поскольку измеренная амплитуда потенциала действия была больше величины мембранного потенциала, генерация потенциала действия — это активный процесс, который нельзя объяснить временным «пробоем» в мембране (каким бы наивным такое представление нам не казалось сегодня, в 1930-е так думали многие физиологи). В том же году К. С. Коул и Х. Дж. Кертис [20] зарегистрировали кратковременное изменение проводимости мембраны с 1 мСм/см 2 до 40 мСм/см 2 при генерации потенциала действия. Эти данные также свидетельствовали о тонкой регуляции этого процесса.
После Второй мировой войны Ходжкин и Хаксли вернулись к своим исследованиям. В 1945 году они опубликовали статью с несколькими дополнительными экспериментами, подтверждающими сформулированные ранее выводы. Но и тогда ионные механизмы потенциала действия оставались неясными.
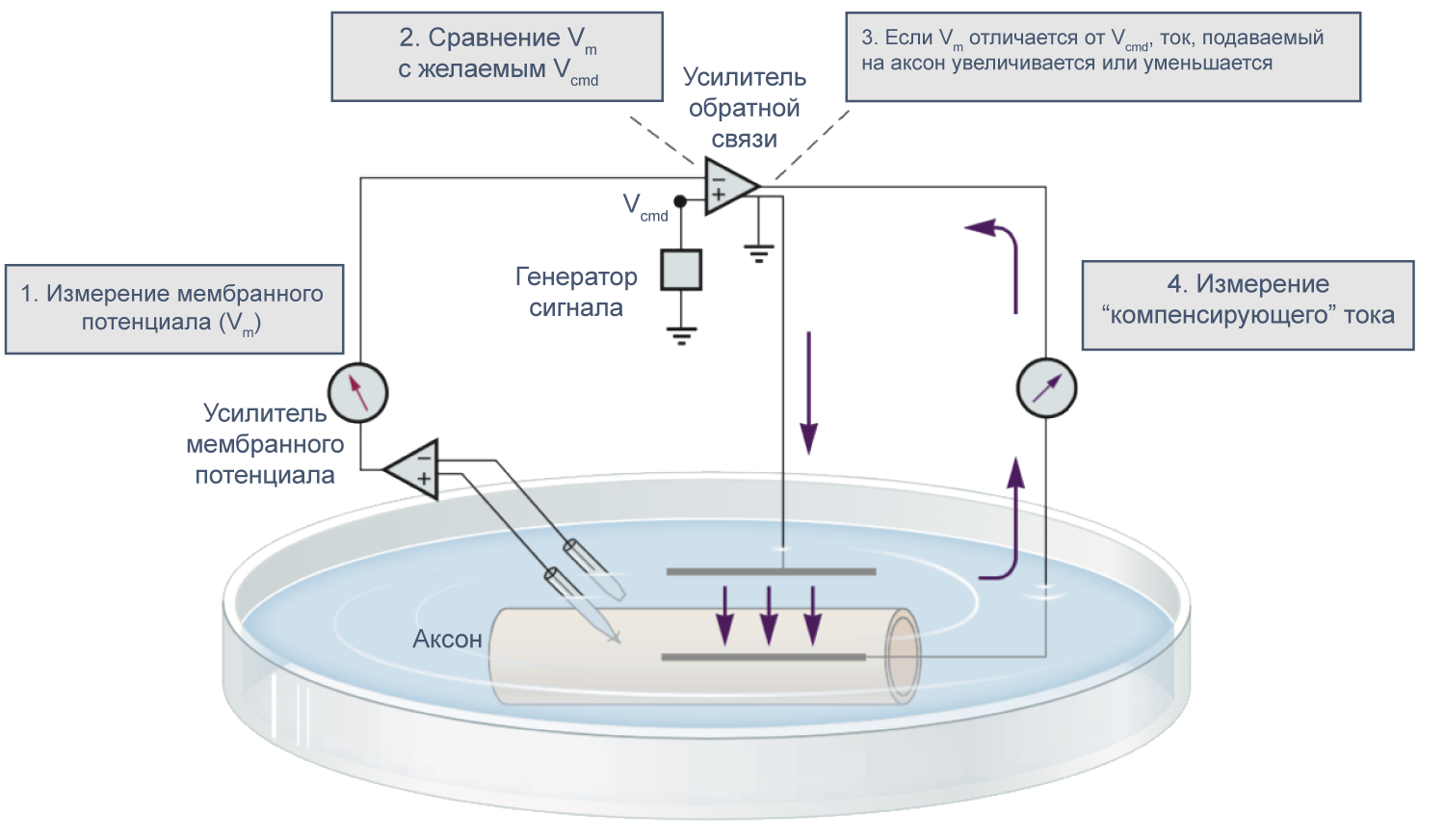
В 1952 году вышла серия статей, посвященных разгадке механизма генерации потенциала действия. Ведущую роль в этом открытии сыграл новый метод фиксации потенциала с помощью двух электродов (в англоязычной литературе TEVC — two-electrode voltage clamp), разработанный в конце 1940-х годов К. С. Коулом и Дж. Мармонтом [21] . Этот метод позволяет измерять не только потенциал, но и токи при заданном значении мембранного потенциала. Как же осуществляется фиксация потенциала с помощью двух электродов на заданном уровне (Vcmd — «командный потенциал»)? В клетку помещают два электрода, один из которых измеряет потенциал (относительно внеклеточного электрода сравнения) и передает его значение на специальный усилитель, который сравнивает измеренный потенциал со значением командного потенциала. Это устройство вычисляет ток, необходимый для компенсации этой разницы, и подает через второй внутриклеточный электрод ток такой величины, чтобы потенциал на мембране клетки стал равен Vcmd (Vm = Vcmd). Из амплитуды тока, необходимого для компенсации сдвига потенциала до Vcmd, можно сделать вывод о токе через мембрану при данном значении мембранного потенциала. Ток при данном значении потенциала равен току, подаваемому на второй электрод, взятому с обратным знаком.
Рисунок 9 | Схема фиксации потенциала с помощью двух электродов [21] .
В 1970–80-х годах Эрвин Неер и Берт Сакман (Erwin Neher, Bert Sakmann) предложили метод локальной фиксации потенциала (англ. patch clamp), позволяющий работать с мелкими клетками и токами малой амплитуды и даже регистрировать активность отдельных каналов. Тем не менее, метод фиксации потенциала двумя электродами в микроэлектродной конфигурации используется и сегодня при работе с такими крупными клетками, как ооциты лягушки Xenopus laevis.
Временной ход потенциала действия
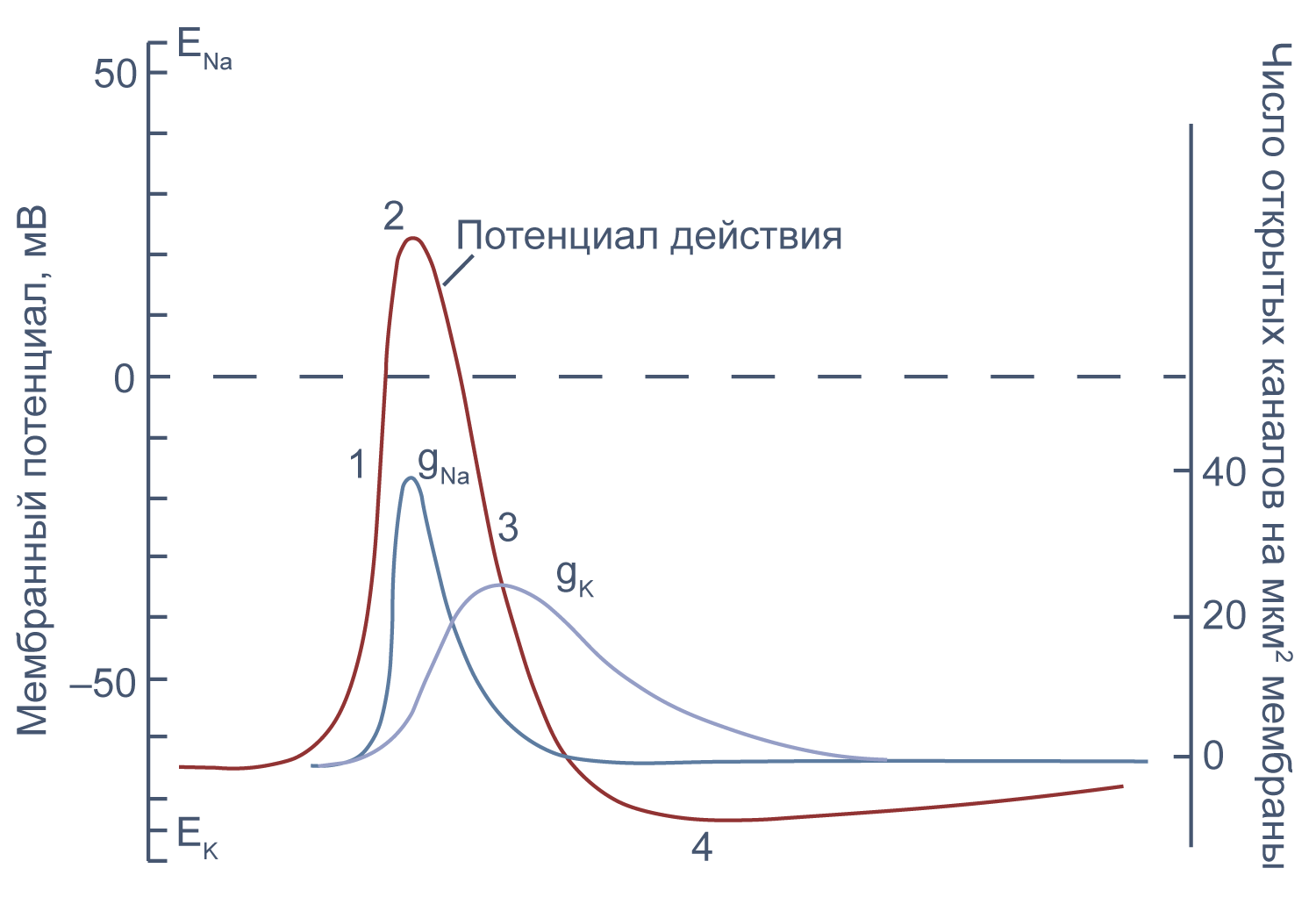
Потенциал действия в аксоне можно разделить на 1) фазу быстрой деполяризации до 2) положительных значений (овершута, от англ. overshoot), 3) фазу реполяризации, в которой потенциал возвращается к потенциалу покоя или даже до несколько более отрицательных значений — 4) следовая гиперполяризация.
Рисунок 10 | Потенциал действия и изменения проводимости мембраны для Na + и K + в гигантском аксоне кальмара. Из [22], с изменениями.
Изменяя ионный состав внутри- и внеклеточного раствора, можно изолировать ионные токи, которые опосредуют изменение мембранного потенциала при потенциале действия. Так, помещая аксон в раствор, в котором натрий заменен на холин, можно изолировать натриевый и калиевый компонент потенциала действия, то есть отдельно измерить калиевый ток [20] . Этого же можно достичь применением блокаторов потенциал-зависимых натриевых и калиевых каналов — тетродотоксина и тетраэтиламмония (TEA).
Чтобы понять взаимосвязь ионных токов и вызванных ими изменений потенциала, рассмотрим всю цепь событий при генерации потенциала действия. Сначала мембрана деполяризуется под действием внешнего стимула: поступления в клетку катионов через лиганд-управляемые каналы, закрытия калиевых каналов или электрической стимуляции в эксперименте. Если деполяризация достигает порогового значения для потенциалзависимых натриевых каналов (Nav), они открываются, натрий по градиенту своей концентрации входит в клетку, и мембрана деполяризуется еще сильнее. Дальнейшая деполяризация влечет за собой лавинообразное открытие все новых натриевых каналов, ток через которые приводит к еще большей деполяризации. Однако эта петля положительной обратной связи не работает бесконечно: открывшись на некоторое время, натриевые каналы инактивируются и не могут открыться вновь, пока мембранный потенциал не вернется к отрицательным значениям.
Механизм инактивации был предложен еще в математической модели Ходжкина и Хаксли [23] на основании кинетических характеристик тока. Они предположили, что в натриевом канале есть три активационные частицы m и одна инактивационная частица h. Когда стала известна аминокислотная последовательность канала, выяснилось, что канал на самом деле имеет четыре гомологичных активационных домена и один инактивационный, однако один из активационных доменов срабатывает значительно медленнее остальных трех, и его влияние на кинетические характеристики тока маскируется происходящей в то же время инактивацией канала (например, [24]).
В то же время деполяризация мембраны приводит к активации потенциал-зависимых калиевых каналов (Kv), которые открываются медленнее, чем натриевые, калий выходит из клетки, и потенциал возвращается к потенциалу покоя и может даже временно стать более отрицательным: пока натриевые каналы инактивированы, потенциал становится ближе к калиевому равновесному потенциалу, и это явление называется следовой гиперполяризацией.
Генерация потенциала действия происходит по принципу «все или ничего». Если деполяризующий стимул не достиг порогового значения, потенциал действия не генерируется. Если же порог был достигнут, положительная обратная связь обеспечивает открытие всех доступных натриевых каналов, и потенциал действия достигает своей максимальной амплитуды.
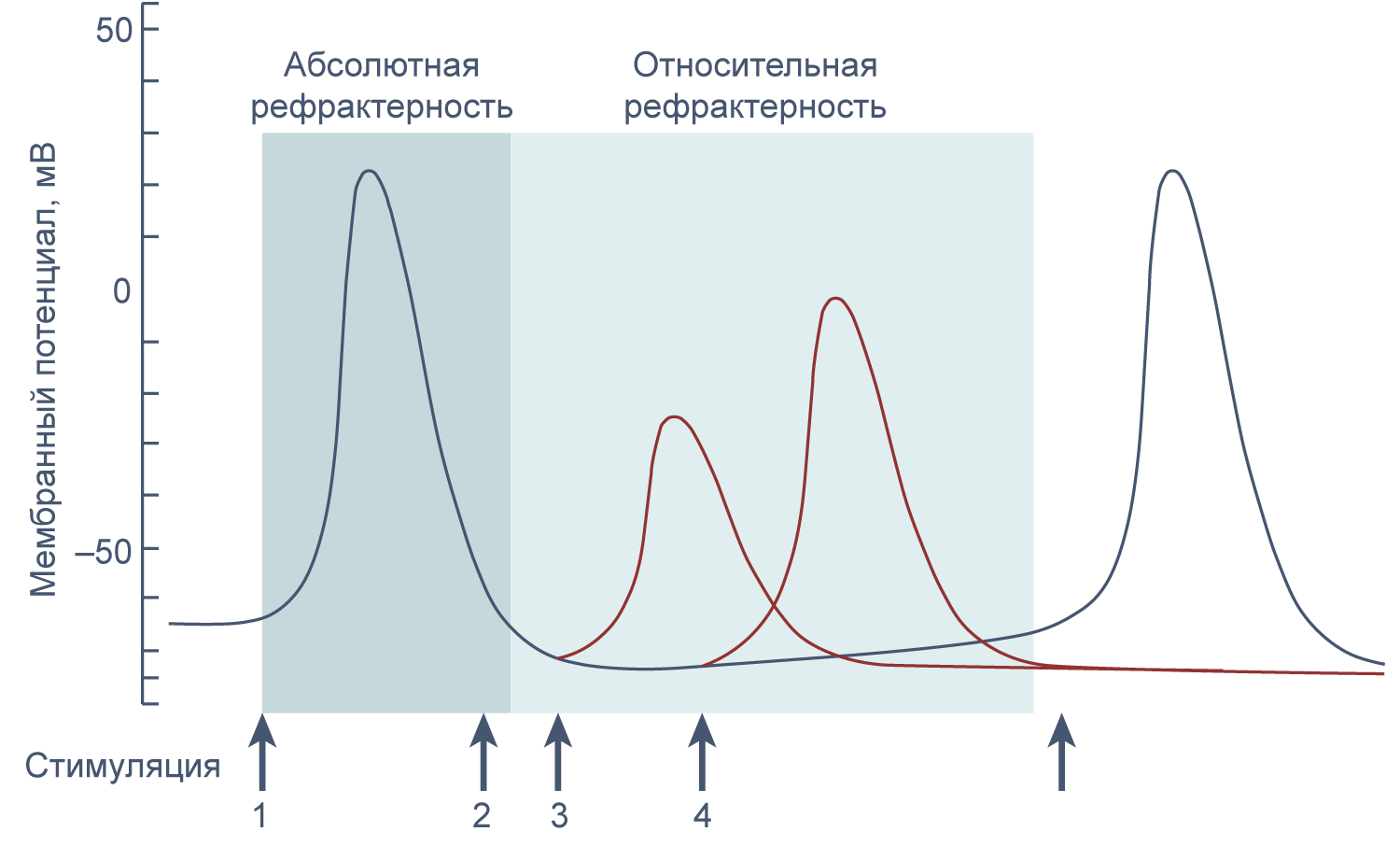
Если новый стимул приходит во время или сразу после генерации потенциала действия, второй потенциал действия не возникает или обладает меньшей амплитудой, чем первый. Это явление называется рефрактерностью. Стимул, возникший в период абсолютной рефрактерности, не вызывает генерации потенциала действия, а пришедшийся на период относительной рефрактерности вызывает потенциал действия уменьшенной амплитуды, так как часть натриевых каналов все еще инактивирована.
Рисунок 11 | Абсолютная и относительная рефрактерность. Стимуляция в период абсолютной рефрактерности (2) не ведет к генерации потенциала действия, а стимуляция в период относительной рефрактерности (3 и 4) приводит к генерации потенциала действия сниженной амплитуды.
Стоит отметить, что внутриклеточная концентрация физиологически значимых ионов при генерации потенциала действия не меняется, и ионные токи задействуют пренебрежимо малую долю от общего числа Na + и K + . Это можно проиллюстрировать следующим примером. Рассчитаем число ионов, которое должно пересечь мембрану для деполяризации на 100 мВ. Заряд на мембране равен произведению емкости мембраны и потенциала: Q = CmVm. Удельная емкость мембраны близка к 1 мкФ/см 2 , а сдвиг потенциала в нашем случае равен 0,1 В. Тогда количество разделенных зарядов равно Q = 10−6 Ф/см 2 × 0,1 В = 10−7 Кл/см 2 . Величина заряда одного иона Na + или K + (элементарного заряда) равна 1,6 × 10−19 Кл, тогда количество переносимых через мембрану ионов равно 10−7 Кл/см 2 / 1,6 × 10−19 Кл = 6,25 × 1011 ионов/см 2 , или 6250 ионов/мкм 2 . Для клетки диаметром 10 мкм площадь поверхности мембраны будет приблизительно равна 4πr 2 = 314 мкм 2 (в этом расчете для простоты мы считаем клетку гладкой сферой), а объем — 4πr 3 /3 = 524 мкм 3 . При внутриклеточной концентрации Na + 10 мМ, а K + 150 мМ содержание этих ионов в цитозоле будет равно 3,2 × 109 и 4,7 × 1010 соответственно. В течение одного потенциала действия приблизительно 314 мкм 2 × 6,250 ионов/мкм 2 ≈ 2 000 000 ионов Na + входит в клетку в фазе деполяризации и примерно столько же ионов K + выходит из клетки в фазе реполяризации, что составляет всего 0,06 % от общего числа ионов натрия в клетке. Токи такой величины обычно не изменяют макроскопические концентрации ионов в клетке, поскольку работа Na/K-АТФазы компенсирует эти незначительные изменения. Однако при определенных условиях концентрации Na + и K + все же могут измениться, например, при продолжительной стимуляции аксонов с малым диаметром [25] .
Распространение возбуждения по аксону
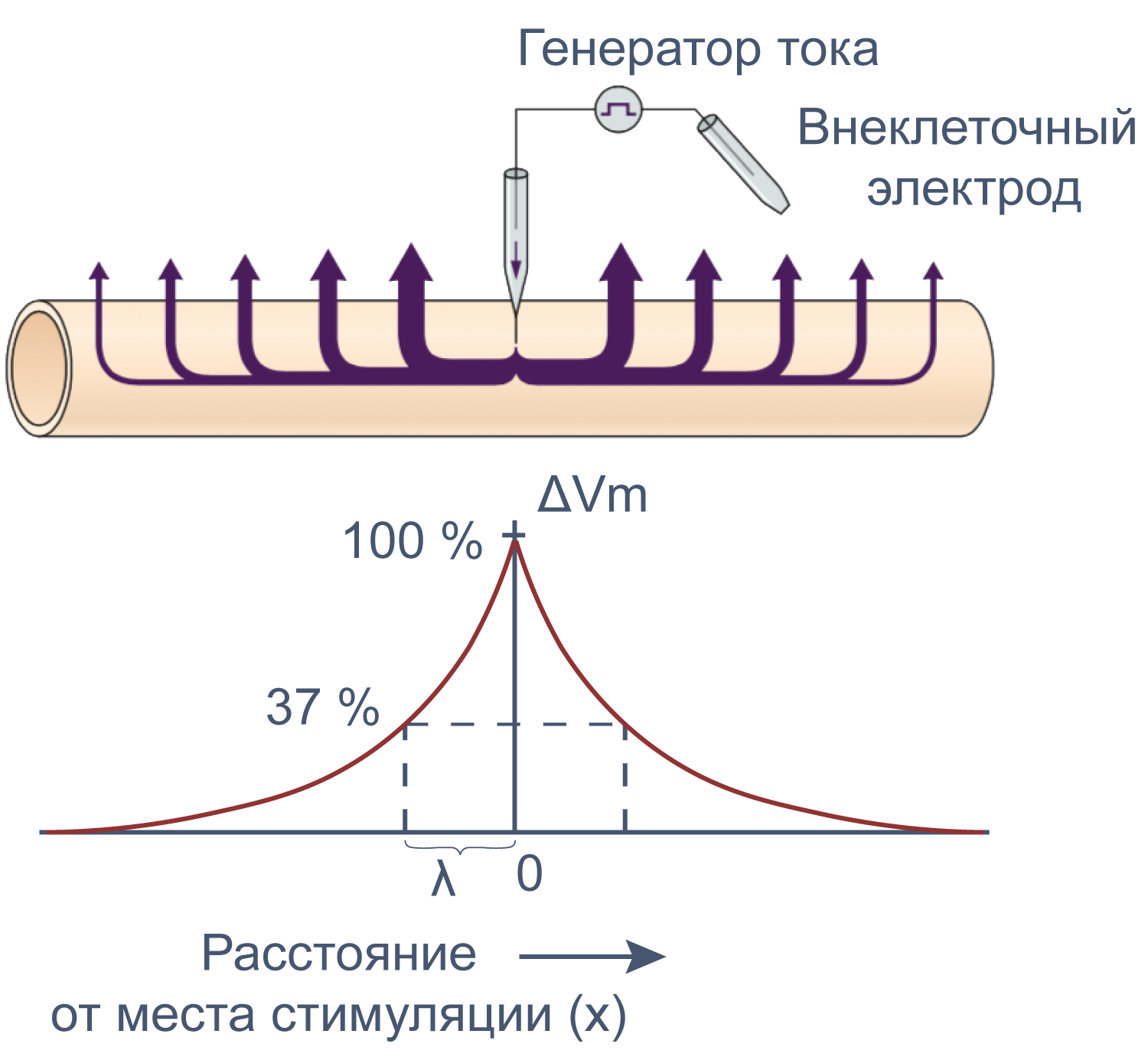
Электрические свойства мембраны помогают понять изменения мембранного потенциала не только во времени, но и в пространстве. Пассивное, или электротоническое распространение возбуждения по мембране происходит без изменения проводимости потенциал-зависимых каналов. Для распространения потенциала действия важен как активный (изменение проводимости натриевых и калиевых каналов), так и пассивный механизмы, поскольку деполяризация, вызывающая открытие новых потенциал-зависимых натриевых каналов, должна достигнуть нового невозбужденного участка аксона, и происходит это благодаря электротоническому распространению возбуждения.
Рисунок 12 | Электротоническое распространение возбуждения. Пояснения в тексте [22].
Сдвиг потенциала в точке, отстоящий на x от места стимуляции, можно вычислить как Ex = E0e –x/λ , где E0 — это сдвиг потенциала в точке стимуляции, а λ — постоянная длины.
Постоянная длины возрастает с увеличением сопротивления мембраны (rm) и уменьшается с возрастанием сопротивления аксоплазмы (ri), которое в свою очередь зависит от концентрации подвижных зарядов в объеме аксона. Знание этих закономерностей позволяет понять зависимость скорости распространения возбуждения от радиуса (R) аксона. Сопротивление мембраны rm пропорционально 1/2πR, сопротивление аксоплазмы ri — 1/πR 2 , а емкость мембраны Cm пропорциональна R. По мере увеличения радиуса аксона и rm, и ri уменьшаются, но ri уменьшается сильнее. Постоянная длины увеличивается, следовательно, сдвиг потенциала может распространяться по более крупному аксону дальше. Кроме того, увеличение радиуса аксона ведет к увеличению емкости мембраны, однако этот эффект нивелируется тем, что емкость с увеличением радиуса растет линейно, а уменьшение ri пропорционально квадрату радиуса. Таким образом, проводимость аксоплазмы увеличивается быстрее (при снижении ri), чем растет емкость мембраны, и это позволяет току быстрее достигать невозбужденных участков мембраны более крупного аксона.
Зависимость скорости распространения потенциала действия по аксону от его диаметра объясняет необходимость в гигантских аксонах у кальмара. Однако у позвоночных гигантских аксонов нет, и достаточная скорость проведения нервных импульсов достигается с помощью миелинизации аксонов. Миелиновые оболочки образованы специальными глиальными клетками: олигодендроцитами в центральной нервной системе и клетками Шванна в периферической. Эти клетки оборачивают аксон, образуя вокруг него плотный чехол из десятков слоев плазматической мембраны, который работает как изолятор. Под миелиновой оболочкой очень мало или почти нет натриевых каналов. Они оказываются расположены на небольших участках мембраны аксона между двумя соседними шванновскими клетками или олигодендроцитами — в перехватах Ранвье. Миелиновая оболочка увеличивает скорость проведения потенциала действия благодаря повышению сопротивления мембраны rm. При этом снижаются потери тока через мембрану, и деполяризация может пассивно распространяться на бо́льшие расстояния. Кроме того, из-за снижения емкости мембраны Cm, меньшая доля тока тратится на перезарядку мембраны. Миелинизация делает передачу потенциала действия не только быстрее, но и эффективнее, поскольку натриевые каналы располагаются только в перехватах Ранвье, благодаря чему меньшее количество ионов натрия входит в клетку и меньше энергии требуется на работу Na/K АТФ-азы для поддержания концентрационного градиента.
Потенциалы действия в других возбудимых клетках
Минималистичный натриево-калиевый потенциал действия характерен только для аксонов нейронов. В других частях нейрона и в иных типах возбудимых клеток в генерации потенциала действия принимают участие разнообразные ионные каналы, в том числе калиевые каналы других семейств и кальциевые каналы плазматической мембраны и эндоплазматического ретикулума (ЭПР является внутриклеточным депо кальция; общая концентрация Ca 2+ в нем достигает миллимолярных значений, а концентрация свободного кальция находится в микромолярном диапазоне [26] ; эти значения на несколько порядков выше, чем 100 нМ свободного Ca 2+ в цитозоле в состоянии покоя). Различия в экспрессии генов ионных каналов в различных типах возбудимых клеток порождают разнообразие потенциалов действия, различающихся ионными механизмами, длительностью (от 1,5 мс в аксонах до 500 мс в кардиомиоцитах желудочков), необходимостью внешнего стимула для генерации или наличием собственного ритма. Многие ионные каналы, не участвуя напрямую в генерации потенциала действия, влияют на возбудимость клеток и таким образом вносят вклад в разнообразие электрической активности клеток.
* Принятое в физиологической литературе употребление фраз «по» или «против градиента концентрации» расходится с физическим понятием градиента. В математике и физике градиент направлен в сторону наибольшей скорости возрастания функции или величины; так, если вещество движется в направлении этого вектора, то физиологи говорят о движении «против градиента концентрации», а если в противоположном направлении — то «по градиенту концентрации». Такое словоупотребление прочно закрепилось в литературе, но пусть оно не сбивает вас с толку, когда вы размышляете, откуда взялся минус перед градиентом концентрации в уравнении диффузионного потока (уравнении Фика): J = — D dC/dx, где J — диффузионный поток [моль∙см -2 ∙с -1 ], D — коэффициент диффузии [см 2 ∙с -1 ], а dC/dx— градиент концентрации.
** Проводимость (g = 1/R) — это характеристика скорости движения любых зарядов через мембрану, а проницаемость (P) отражает, насколько легко частицы могут двигаться через мембрану независимо от того, движутся они или нет. Для ионов эти величины связаны. Например, в фазе быстрой деполяризации при потенциале действия возрастает как проводимость, так и проницаемость мембраны для ионов натрия. Однако зачастую, если проницаемость канала для какого-то иона высока из-за высокого сродства участков поры канала для этого иона, такие ионы будут двигаться через канал медленнее, и проводимость будет ниже, чем для других ионов, для которых канал менее проницаем.
*** Удельная емкость чистого липидного бислоя составляет около 0,8 мкФ/см 2 , разница между электроемкостью мембраны и липидного бислоя возникает из-за обилия встроенных в мембрану белков.
http://biomolecula.ru/articles/formirovanie-membrannogo-potentsiala-pokoia
http://medach.pro/post/1458