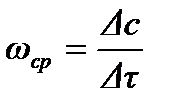ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.
Пример 1. Вычислить электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов 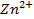
Решение. Для количественной характеристики активности металлов используется разность потенциалов в гальваническом элементе, образованном электродом, содержащим металл, и стандартным водородным электродом, потенциал которого принят равным нулю.
Если активность α или концентрация 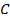
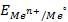
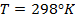
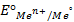
где 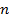
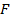
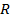
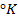
при 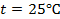
Таким образом, рассчитать требуемый электродный потенциал можно, используя уравнение
Отыскав по таблице значение нормального цинкового потенциала
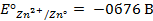
Пример 2. Вычислить потенциал серебряного электрода в насыщенном растворе
(ПР = 6 ∙ 10 -13 ), содержащем, кроме того, 0,1 моль/л бромида калия.
Решение. Уравнение Нернста для вычисления требуемого электродного потенциала имеет вид
где
Необходимое для расчёта значение величины концентрации ионов серебра 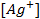
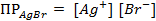
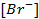
Подставляя полученное значение 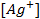
Пример 3. Вычислить ЭДС цепи
Написать протекающие электродные процессы (Коэффициенты активности ионов серебра и цинка соответственно равны 0,79 и 0,52; температура опыта 25 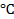
Решение. ЭДС ( 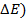
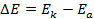
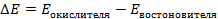
Зная, что активность является вспомогательной расчётной величиной, которая характеризует отклонение свойств вещества в данной фазе (в рассматриваемом случае жидкости) от свойств его в состоянии, принимаемом за стандартное (идеальные растворы), величины активности ионов входящих в состав данного гальванического элемента, можно определить по формуле, связывающей активность иона с его концентрацией:
где 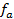
Подставив соответствующие величины, получим:
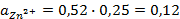
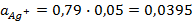
Электродные потенциалы серебра и цинка вычисляем по формуле Нернста:
где 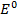
a – активность ионов; n – заряд иона.
Работу гальванического элемента определяют реакции
анодная (А): катодная (К):
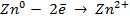
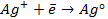
так как известно, что в данной паре металлов цинковый электрод будет заряжен отрицательно и будет анодом в силу его положения в ряду напряжений металлов.
Пример 4. Элемент составлен из нормальных водородного и кислотного электродов. Изменится ли его ЭДС, если давление газов (водорода и кислорода) увеличить в 10 раз?
Решение. Запишем схему элемента и электродные реакции:
Зная, что величины электродных потенциалов для водородного и кислородного электродов соответственно равны
заменяем величины концентрации свободных водорода и кислорода на величины их парциальных давлений и получаем выражения уравнения Нернста для этих электродов в следующем виде в расчёте на 1 
для водородного электрода
для кислородного электрода
Соответственно ЭДС ( 
Под величиной 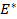
При
При
Следовательно, увеличение давления кислорода и водорода в 10 раз приводит к увеличению 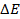
Пример 5. Найти потенциал водородного электрода при 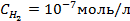
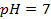
Решение. При Р = 1 атм., электродный потенциал водородного электрода равен
где
Пример 6. Напишите общую химическую реакцию, определяющую работу гальванического элемента
его электродные реакции и определите его ЭДС.
Решение. Известно (из таблиц), что 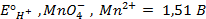
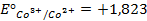
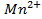
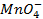
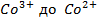
 |
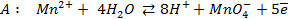
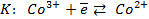
Зная, что электродный потенциал окислительно- восстановительного электрода вычисляется по уравнению Нернста
или для Т = 298 К
Для данных электродов эти уравнения имеют вид
Пример 7. Какие процессы происходят на электродах гальванического элемента
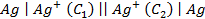
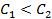
Решение. Известно, что гальванические элементы, работа которых обусловлена лишь различием концентрации электролита в разных зонах раствора при одинаковом составе электродов, носят название концентрационных. Более отрицательным электродом в этом случае считается тот, который опущен в раствор с меньшей концентрацией.
Следовательно, в предлагаемом элементе серебряный электрод, погруженный в менее концентрированный раствор, будет заряжен более отрицательно, т.е. он будет анодом. Электродная реакция 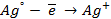
На электроде, заряженном менее отрицательно, который будет являться катодом, идёт реакция восстановления ионов серебра:
При этом электроны будут перемещаться от анода к катоду, а ток, получаемый в результате работы этого элемента, пойдёт в противоположном направлении.
Пример 1. Что такое электролиз? Какие законы электролиза Вы знаете? Какие количественные законы электролиза Вы знаете?
Решение. Электролизом называется окислительно- восстановительный процесс, происходящий в растворе или расплаве электролита при пропускании через него электрического тока.
Электрод, соединенный с отрицательным полюсом источника тока, называется катодом (-); электрод, соединенный с положительным источником тока, называется анодом (+).
Схему электролиза в общем виде можно представить следующим образом:
| катионы движутся к катоду (т.е. отрицательно заряженному электроду), где происходит процесс восстановления молекул или положительно заряженного иона | анионы движутся к аноду (т.е. положительно заряженному электроду), где происходит процесс окисления молекул или отрицательно заряженного иона |
Для проведения электролиза могут использоваться растворимые или нерастворимые аноды. Последние сами не участвуют в окислительно- восстановительной реакции, а являются только передатчиками электронов. В качестве нерастворимых анодов используют платину и другие благородные металлы, графит. Растворимые металлические аноды при проведении электролиза разрушаются.
Основные законы электролиза установил М. Фарадей.
1-й закон. Количество вещества, образующегося при электролизе, прямо пропорционально количеству прошедшего электричества:
где m – количество вещества в граммах, Q – Количество электричества в кулонах Q = Jt , где
J – сила тока, А; t – время, с; К – коэффициент пропорциональности.
2-й закон. При пропускании равного количества электричества в результате электролиза выделяются количества веществ m, пропорциональные их химическим эквивалентам Э. Для выделения 1 г – экв. требуется количество электричества, равное числу Фарадея F = 96487 кулонов, т.е.
Математически, обобщив законы Фарадея, получим:
Пример 2. Какие процессы протекают при электролизе расплавов солей 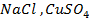
Решение. Установим, на какие ионы диссоциируют перечисленные соединения:
Представим протекание процесса электролиза каждого из веществ.
При пропускании через расплав 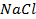
электронейтрального натрия: (К): 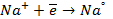
Отрицательно же заряженные ионы хлора притягиваются к положительно заряженному электроду А, где они разряжаются до свободного хлора, отдавая свой электрон: (А):
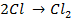
Аналогично разобранному примеру можно представить схемы электролиза 
 |  |
| (-) катод | (+) анод |
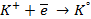 | 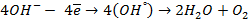 |
 |  |
| (-) катод | (+) анод |
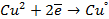 | 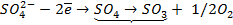 |
Пример 3. Как влияет положение металла в ряду напряжений и состав кислотного остатка на процессы электролиза растворов солей?
Решение. В растворах солей металлов, кроме ионов металла и ионов кислотного остатка, присутствуют 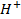
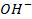
Наличие кислородсодержащих анионов приводит к окислению 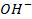
который требует значительного большего сдвига потенциала в положительную сторону. Поэтому в обычных условиях окисления кислородсодержащих кислотных остатков, таких как 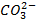
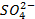
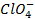
Бескислородные же анионы окисляются легче до свободного состояния, чем 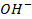
| А: | 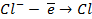 2 2 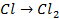 | или | 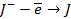 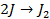 |
Поведение металла при электролизе четко определено его положением в ряду напряжений. Чем левее расположен он в ряду, тем больший сдвиг потенциала в отрицательную сторону необходим для его восстановления до свободного состояния. Поэтому легче всего восстанавливаются ионы металлов, характеризующиеся наиболее электроположительной величиной потенциала (т.е. расположенные в крайней правой части ряда (после водорода): 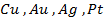
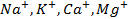
При электролизе же металлов, расположенных в средней части ряда (от алюминия до водорода), имеющих потенциал разложения, сравнимый с величиной потенциала разложения воды, протекает реакция как восстановления самого металла, так и молекул воды, т.е. с выделением в чистом виде металла и газообразного водорода.
Обобщив все вышеперечисленное, можно сделать вывод, что при проведении электролиза будут восстанавливаться положительные ионы, требующие наименьшего сдвига потенциала в отрицательную сторону, т.е. вероятность выделения металла в чистом виде уменьшается при переходе в ряду напряжений справа налево (от Au к Na). Что качается смеси анионов, то в этом случае необходимо учитывать наличие кислорода в кислотном остатке и способность бескислородных ионов к окислению.
Практически установлено, что вероятность их выделения в чистом виде уменьшается по следующему ряду:
В качестве примеров можно привести схемы электролиза нескольких характерных солей (аноды инертные):
а) электролиз раствора
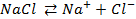
| (+) на аноде | (-) на катоде |
2 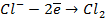 | 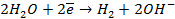 |
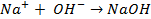
б) электролиз
диссоциация:
| катод (-) | анод (+) |
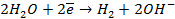 | 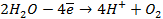 |
в) электролиз раствора
диссоциация:
| катод (-) | анод (+) |
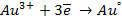 | 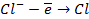 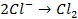 |
(Потенциал разложения 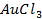
Анод растворимый (например, никелевый)
а) электролиз раствора
диссоциация:
| катод (-) | анод (+) |
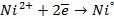 | 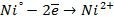 |
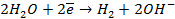 | 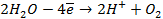 |
При использовании растворимых анодов в окислительно- восстановительную реакцию вступает металл анода и происходит его окисление (т.е. он растворяется). Это вызвано тем, что металл выбранного растворимого анода имеет потенциал окисления значительно ниже, чем требуется для окисления аниона и даже ниже потенциала разложения воды.
3.3. КОРРОЗИЯ МЕТАЛЛОВ.
Пример 1. а) Объясните, почему луженое железное изделие (например кастрюля) при нарушении защитного слоя корродирует быстрее, чем оцинкованное железное изделие (например ведро)?
Решение. Как луженое, так и оцинкованное изделие подвергают электрохимической коррозии. Природу протекающих процессов можно объяснить, используя величины окислительно- восстановительных (электродных) потенциалов металлов, находящихся в контакте друг с другом и электролитом. Известно, что
Про контакте железа с оловом и нарушении целостности луженого покрытия в среде электролита возникают коррозионные микрогальванопары, работа которых определяет разрешение основного металла – железа. Связано это с тем, что железо обладает более электроотрицательным электродным потенциалом по сравнению с оловом. Таким образом, в паре Fe – Sn олово, как менее электроотрицательный металл, будет катодом, т.е. только переносчиком электронов, которые возникают при окислении основного металла железа, являющегося в данном случае анодом (А)
На катоде в зависимости от условий при этом может протекать один из процессов:
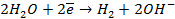
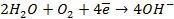
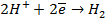
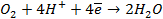
Нарушение же циклового покрытия при контакте его с железом не приводит к разрушению основного металла (железа), так как в этом случае будет разрушаться цинковое покрытие (электродный потенциал цинка более электроотрицателен по сравнению с электродным потенциалом железа), т.е. цинк будет анодом 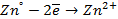
Пример 2. Почему железо, частично покрытое хромом, корродирует, хотя хром имеет более отрицательный стандартный потенциал, чем железо? Стандартные потенциалы хрома и железа соответственно равны -0,74 и -0,44 В.
Решение. По месту, занимаемому хромом в ряду напряжений, следовательно бы ожидать, что хром в паре с железом будет работать как анодного покрытие, т.е. разрушаться, предотвращая коррозию железа. Однако этого не происходит из-за присутствия на поверхности хрома прочной оксидной пленки, которая в корне меняет взаимоотношения металлов.
Можно предположить, что образование адсорбционной плёнки, пассивирующей металл, приводит как бы к созданию на поверхности хрома кислородного электрода, потенциал которого, как известно равен +0,401 В, т.е. пассивное состояние поверхности хрома выражается в значительном смещении электродного потенциала металла в положительную сторону, по сравнению с величиной потенциала железа, что и не позволяет хрому быть анодным покрытием железа.
Пример 3. Как влияет 
Решение. Течение коррозийных процессов всегда зависит от концепции ионов Н + , способствует разрядке их на катоде, и этим облегчается катодная деполяризация и растворение металла с анодных участков. Например, это способствует усилению коррозии черных металлов. При значительном повышении концентрации Н + процесс может перейти в обычное растворение металла в кислоте. Коррозия 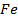
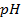
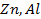
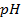
1. При 25 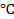
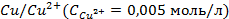
2. Рассчитать электродный потенциал цинка, погружённого в раствор, содержащий ионы 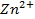
3. Найти потенциал водородного электрода при 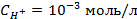
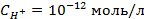
4. Найти потенциал водородного электрода в щелочной среде при 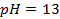
5. Как должна быть составлена гальваническая цепь для того, чтобы осуществлять электрохимическим путём следующие реакции:
а)
б)
в)
г)
д) 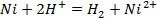
Для каждого случая указать:
а) электрод- восстановитель и электрод- окислитель,
б) знаки полюсов,
в) направление перемещения электронов во внешней цепи.
6. Составить схемы двух гальванических элементов, в одном из которых никель – отрицательный электрод, в другом – положительный.
7. Какие реакции протекают у электродов в гальванических элементах, образованных:
а) железом и оловом, погруженными в растворы своих солей,
б) оловом и медью, погружёнными в растворы своих солей?
8. Рассчитайте ЭДС газового элемента 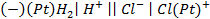
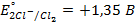
9. Найдите величину электродного потенциала для электрода, составленного из платиновой пластинки, опушенной в раствор смеси солей 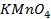
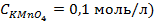
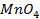
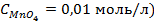
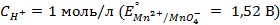
10. Чему равен нормальный электродный потенциал серебра, если потенциал электрода 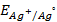
11. Вычислить потенциал свинцового электрода в насыщенном растворе 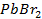
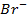
12. ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в 1 М растворы солей этих металлов, равна 0,47 В. Изменится ли ЭДС, если взять 0,001 М растворы? Ответ обосновать.
13. Нормальные потенциалы олова и свинца равны – 0,14 В и -0,13 В. Покажет ли амперметр ток в гальваническом элементе, образованном из полуэлементов
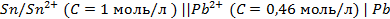
14. Объясните классификацию электродов на электроды 1 и 2 рода. Приведите примеры таких электродов.
15. Зная, что потенциал электрода, отвечающего реакции 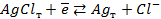
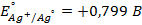
16. Напишите электродные и суммарную реакцию, протекающие в гальваническом элементе, составленном из нормального водородного электрода и цинкового электрода. Укажите, какой заряд будет принадлежать цинковому электроду.
17. В каком направлении пойдет ток в гальваническом элементе, состоящем из водородных электродов, находящихся в растворах с 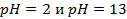
18. Какие процессы происходят на электродах гальванического элемента:
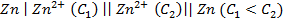
В каком направлении перемещаются электроны во внешней цепи?
19. На основании ряда напряжений металлов составьте гальванический элемент с наибольшей ЭДС и наименьшей его стоимостью. Ответ мотивируйте.
20. Имеются концентрационные цепи:
а) 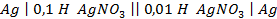
б)
в)
г)
Для каждой из этих цепей:
а) вычислить электродные потенциалы;
б) указать электрод- восстановитель и электрод- окислитель;
в) отметить знаки полюсов и направление перемещения электронов;
г) написать электронно- ионные уравнения восстановления и окисления;
д) вычислить ЭДС.
21. Какие процессы происходят при электролизе расплавов 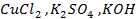
22. Разобрать процессы, протекающие у электродов при электролизе водных растворов:
23. Раствор содержит ионы 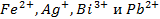
24. Одинаковые ли будут продукты электролиза растворов солей:
а) 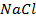
б) 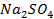
в) 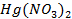
г) 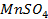
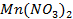
Ответ обосноваться соответствующими электронно- ионными уравнениями.
25. Изменится ли количественное содержание ионов каждой из указанных солей в растворе при электролизе водных растворов:
а) 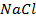
б) 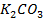
в) 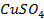
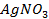
Ответ обосноваться соответствующими электронно- ионными уравнениями.
26. Почему литий нельзя получить электролизом водного раствора его солей? Составьте схему электролиза водного раствора сульфата лития.
27. Электролизом таких соединений и при каких условиях можно получить металлы 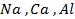
28. Электролиз раствора 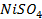
29. Железная и цинковая пластинки погружены в сосуд с раствором серной кислоты так, что они не качаются одна другой. Какие процессы будут протекать на поверхности пластинок, если:
1) пластинки не соединены друг с другом;
2) пластинки соединены;
3) пластинки соединены с полюсами источника тока,
а) цинк будет катодом,
б) цинк будет атодом?
Ответ подтвердить электрохимическими уравнениями.
30. Вычислить количество серебра, выделенного при пропускании через раствор 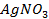
31. Вычислить время, необходимое для полного выделения хлора, содержащегося в 1 л 1 Н раствора 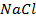
32. Раствор, содержащий 159,54 г соли 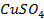
33. Сколько времени требуется для выделения 1 г-экв 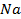
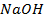
34. Сколько электричества надо пропустить через раствор 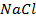
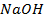
35. Вычислить г-экв 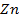
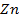
36. Раствор, содержащий 129,7 г соли 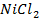
37. При электролизе 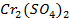
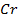
38. Ток одной и той же силы проходит через растворы нитрата серебра 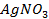
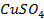
39. В двух отдельных электролизерах проводится электролиз водного раствора 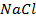
40. При электролизе раствора 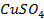
41. Вычислить объём водорода, выделенного при пропускании тока в 5 А в течении 1 ч. через раствор 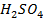
42. Объясните различия между химической и электрохимической коррозией.
43. Почему технический цинк взаимодействует с кислотой более интенсивно, чем химически чистый цинк?
44. В железном изделии имеются детали, изготовленные из меди. Как это отразится на коррозии железа?
45. Объясните, почему цинковое покрытие в стальных трубах, по которым течет горячая вода, интенсивно корродирует?
46. Какое покрытие называется анодным? Приведите пример катодного покрытия железа и составьте электронные уравнения процессов, происходящих при коррозии, когда нарушена целостность покрытия.
47. Какое покрытие называется катодным? Приведите пример катодного покрытия железа и составьте уравнения процессов, происходящих при коррозии, когда нарушена целостность покрытия.
48. Железные цистерны применяются для перевозки концентрированной серной кислоты и хорошо выдерживают транспортировку. Если цистерну, освобождённую от кислоты, оставить открытой, она быстро корродирует. Объясните причину этого явления.
49. Почему при контактированнии железных изделий с алюминиевыми железные изделия подвергаются более интенсивной коррозии, хотя алюминий имеет меньшую величину стандартного потенциала?
50. Составьте уравнение процессов, происходящих при коррозии цинка, погруженного в раствор: а) с кислотой и б) щелочной средой.
51. В чём заключается сущность протекторной защиты металлов от коррозии? Приведите пример и составьте электронные уравнения.
52. Никелевая пластинка опущена в раствор:
а) соли трехвалентного железа,
В каком случае процесс коррозии 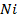
Составьте соответствующие электронные уравнения.
53. Железные пластинки опущены:
а) в дистиллированную воду;
б) в раствор хлористого атрия.
В каком случае процесс коррозии протекает интенсивнее?
54. Под землёй уложены рядом стальные объекты, имеющие различный потенциал (относительно нормального водородного электрода): телефонный кабель в стальной оболочке (+0,05 В), водопровод (-0,15 В), теплоцентраль (0,05 В), газопровод (-0,15 В). Какой из объектов наиболее подвержен коррозии? Что следует сделать для ее замедления?
55. Можно ли поверхность нержавеющей стали обрабатывать песком, содержащим загрязнения в виде хлоридов?
56. Почему отмывка автомобиля от солей и грязи предотвращает его коррозию?
57. Рассчитайте скорость коррозии стального листа размером 1,5х2 м, если убыль его массы составила за 300 дней 6 кг.
58. Объясните связь между защитой окружающей среды и защитой от коррозии.
59. Какие химические реакции происходят при коррозии алюминия в растворе соды?
60. Объясните причину коррозии алюминиевых деталей, обрызганных во время ремонта раствором гидроокиси кальция
61. Чем можно объяснить, что активный металл- алюминий хорошо сопротивляется атмосферной коррозии? Назвать вещество, активирующее коррозию алюминия. Объяснить, в чём заключается активирующее действие.
62. Если хорошо вычищенную наждачной бумагой алюминиевую пластину смочить раствором 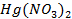
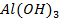
63. Какие способы нанесения металлических покрытий применяются в промышленности?
64. Что такое оксидирование? Привести примеры химического и электрохимического оксидирования алюминия, железа.
65. Какие вещества называются ингибиторами? Какие вы знаете ингибиторы? Механизм действия ингибиторов. Где и когда применяются ингибиторы?
66. Какое из соотношений площадей поверхности катода и анода (например, медного и стального листов) наиболее благоприятно с точки зрения коррозионности: 1:1, 1:10, 10:1?
67. Почему для достижения полной защиты изделия необходимо придерживать определённой минимальной толщины лакокрасочных покрытий?
68. Перечислить требования, предъявляемые к гальваническим покрытиям.
1) -3716 Дж, -4955 Дж; 2) -4955 Дж, -2477 Дж, 2477 Дж, 4955 Дж; 3) -47,78 кДж/моль;
4) -819,67 кДж/моль; 5) 6427 Дж, -12854 Дж; 6) 431,5 кДж/моль; 7) -1579 кДж; 8) 52,2 кДж/моль; 9) -120,4 кДж/моль; 10) -236,8 кДж/моль; 11) 66,08 кДж/моль; 12) -2196,53 кДж/моль; 13) 2453 кДж, 2466 кДж; 14) 2398,1 кДж; 15) 39,4 кДж; 16) -100,5 кДж/моль; 17) 60 кДж; 18) 24,3 кДж/моль; 19) а) 96,8 кДж, б) 490,1 кДж; в) -27,7 кДж; 20) -1113 кДж/моль; 21) а) -443,2 кДж, б) -365,6 кДж; 22) а) -69,2 кДж, б) -2803 кДж; 23) 6С + 3Н2 = С6Н6 (ж); 24) 12,38 кДж; 25) 8,24 кДж; 26) 11395 кДж; 27) 6618,6 кДж; 28) 12254,7 кДж; 29) -798,101 кДж; 30) -897,74; 31)-573,28 кДж; 32) -198,39 кДж; 33) -186,86 кДж; 34) 131,1 кДж, 2926,33 кДж; 35) 23 кДж; 36) 0,083 г; 37) 119,8 кДж; 38) Тепловой эффект уменьшается; 39) 1032,6 Дж/к; 40) 61,1 Дж/кг К; 41) 159,1 Дж/моль к; 42) 154 Дж/моль К;
43) -423,82, 56,71, -5,17 Дж/К; 44) 590,94 кДж/моль. Прямая реакция невозможна; 45)
а) -505,62 кДж/моль, б) -7,51 кДж/моль, в) -4,4 кДж/моль, б и в при стандартных условиях протекает слабо; 48) б) и в); 49) 129,1 кДж, 50,7 кДж, -114,0 кДж, около 1080 К; 50) а) 47,1 кДж, б) 107,2 кДж, в) -13,0 кДж; 51) в) и г) при низкой темпер атуре; 55) 22,03 Дж/моль К; 56) 1601,7 кДж; 57) 36,5 кДж, 4,16 10 -7 ; 58) 2,5 10 -2 ; 59) 885 К; 60) а) 1,1 10 5 , 0,91, б) 1,5
10 -22 , 1,4, в) 2,7 10 5 , 1,1 10 -6 ; 61) б); 63) а); 64) б); 65) а); 70) 985,7 К; 71) 8,02 10 -3 ; 72) 29,2 кДж, 504,7 К; 73) 1,73; 74) 3,8 10 -8 ; 75) 1,6 10 3 , -28478,6 Дж.
1) 5,26 г; 2) 160 г соли и 1440 г воды; 3) 34,78 г; 4) 26,25 г; 5) 1 М; 6) 0,75 г; 7) 1,26 г; 8) 0,5 л; 9) 2,65 г; 10) 3,8 л; 11) 250 мл; 12) 10 г; 13) 0,3 Н, 24 мл; 14) 9,74 г; 15) 244,7 г; 16) 4,762 моль/1000 г Н2О; 19) 2,61 Н, 0,15 г/мл; 20) 5,37 Н, 0,2 г/мл; 21) 0,05 Н; 22) 1,3 Н; 23) 1,62 ° ; 24) 0,26 ° ; 25) 102 ° ; 26) 18,4 г; 27) 1250 г; 28) 4,5 г; 29) 180; 30) 34; 31) 82; 32) 92; 33) -10,1 ° ; 34) 5,2; 35) 178; 36) 500 г; 37) 20 г; 38) -10 ° ; 39) 0,0348 ° ; 40) 0,93 ° ; 41) 0,78; 42) 0,75; 43) 2,5; 44) 102,064 ° ; 45) -0,0279 градусов; 46) 2,96; 47) 3; 48) 1,8 10 -5 ; 49) 10%; 50) 0,018%; 51) 3 10 -7 ; 52) 0,95%; 53) 0,43%; 54) 1,7 10 -3 , 1,7 10 -4 г-ион/л; 55) 9,5 10 -3 ,9,5 10 -4 г-ион/л; 56) 0,072 г-ион/л, 0,144 г-ион/л; 57) 1,9 10 -4 ; 58) 0,6 г-ион/л, 0,3 г-ион/л; 59)0,999 10 -7 г-ион/л; 60)0,5 г-ион/л; 61) 1 10 -4 г-ион/л; 62) 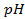
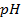
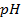
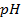
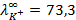
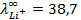
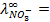
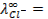
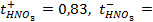
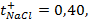
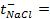
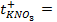
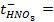
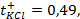
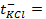
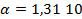
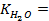
10 -15 ; 117) 0,97; 118) 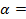
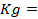
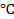
2) -0788 В; 3) -0,18 В, 0,71 В; 4) -0,77 В; 9) 1,53 В; 13) 0; 15) 1,78 10 -10 ; 17) 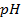
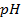
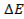
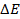
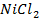
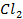
Значение энергии связи
| Тип связи | 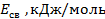 |
| H – H H – C C = C Cl – Cl H – Cl C – C O – O H – O C = O C = C H – O C – O C = O C = O | — 430,0 — 358,2 — 536,0 — 243,0 — 431,5 — 262,8 — 490,4 — 460,0 — 702,9 — 425,0 — 418,4 — 374,0 — 660,0 — 652,7 |
Энергия фазовых переходов
| кДж/моль | |
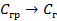 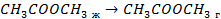 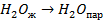 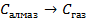 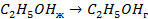 | 33,8 44,0 41,68 |
Стандартные энтальпии образования 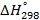
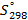
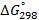
| Вещество | 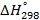 кДж/моль кДж/моль | 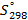 Дж/моль Дж/моль | 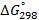 кДж/моль кДж/моль | |||||||
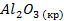 | -1672,0 | |||||||||
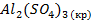 | -3439,0 | |||||||||
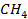 | -74,9 | 186,2 | -50,8 | |||||||
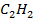 | 226,8 | 200,8 | 209,2 | |||||||
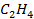 | 52,3 | 219,4 | ||||||||
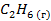 | -84,8 | |||||||||
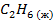 | — | — | 123,48 | |||||||
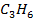 | 20,42 | 267,11 | 61,7 | |||||||
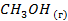 | -201,2 | |||||||||
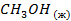 | -238,71 | |||||||||
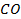 | -110,7 | 197,4 | -137,4 | |||||||
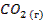 | -394 | 213,6 | -394,89 | |||||||
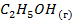 | -235,46 | 278,7 | ||||||||
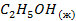 | -277,6 | |||||||||
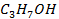 | -171,4 | |||||||||
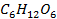 | -1273 | |||||||||
(глюкоза) 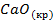 | — | 39,7 | -604,2 | |||||||
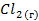 | — | 223,09 | ||||||||
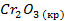 | -1129 | 81,2 | -1050 | |||||||
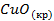 | -162,0 | 42,0 | -129,9 | |||||||
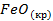 | -2648 | 58,79 | -246 | |||||||
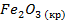 | -822,2 | 87,4 | -740,3 | |||||||
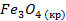 | -1117,1 | 151,46 | -1010 | |||||||
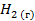 | 130,5 | |||||||||
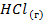 | -92,3 | 186,8 | — | |||||||
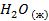 | -285,8 | 70,1 | -237,3 | |||||||
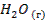 | -241,8 | 188,7 | -228,6 | |||||||
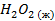 | -187,29 | -218,88 | ||||||||
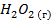 | -135,34 | 227,09 | -203,07 | |||||||
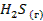 | — | 205,7 | -33,8 | |||||||
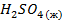 | -194,1 | 157,1 | — | |||||||
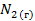 | 191,5 | |||||||||
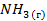 | -46,2 | — | -1655 | |||||||
| t1 |
| a |
| с |
| t |
| b |
| a |
| спрод |
| сисх |
| ∆t |
| ∆С |
| с1 |
Изменения концентраций каждого из реагентов связаны друг с другом стехиометрическими соотношениями. Тогда для реакции
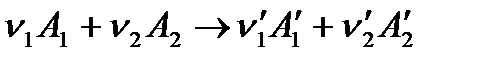
скорость можно выразить
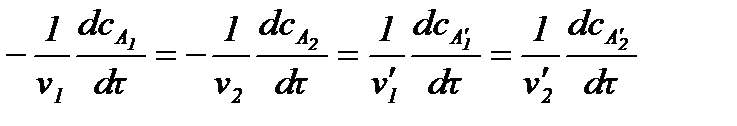
Дата добавления: 2016-06-22 ; просмотров: 3121 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://physchem.chimfak.sfedu.ru/Source/PCC/Solutions_6.htm
http://poznayka.org/s21708t1.html
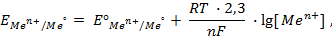
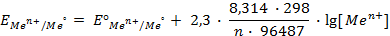
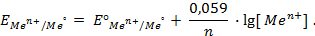
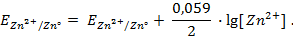
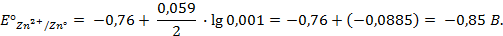
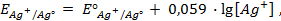
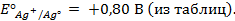
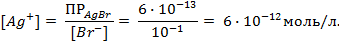
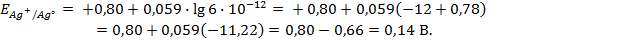
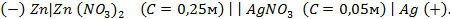
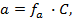
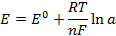
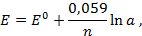
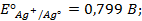
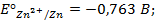
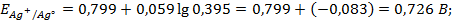
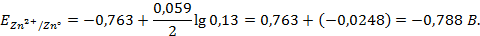
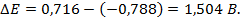
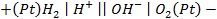
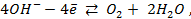
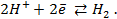
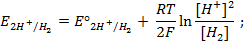
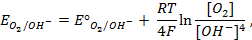
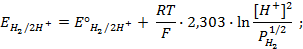
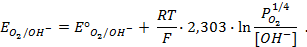
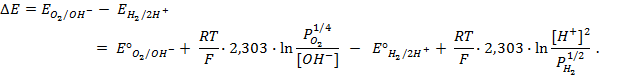
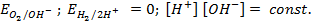
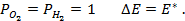
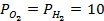
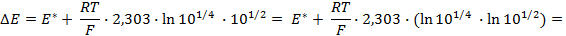
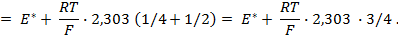
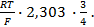
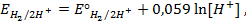
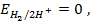
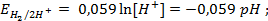
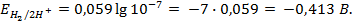
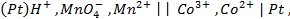
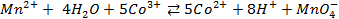
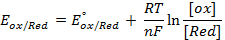
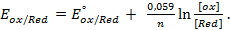
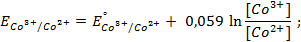
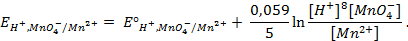
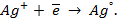
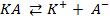


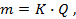
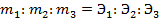
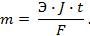
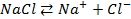
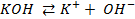
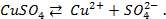
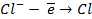
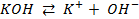
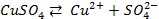
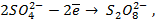
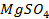
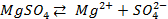
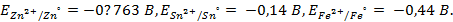
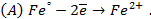
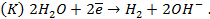
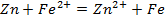
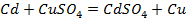
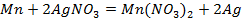
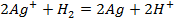
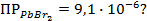
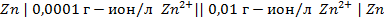
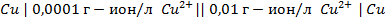
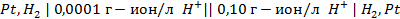
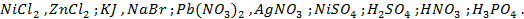
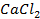
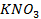
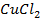
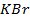
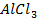
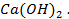
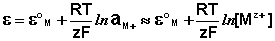 (III.40)
(III.40)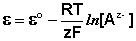 (III.48)
(III.48)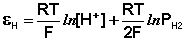 (III.49)
(III.49)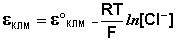 (III.50)
(III.50)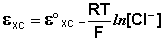 (III.51)
(III.51)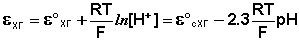 (III.52)
(III.52)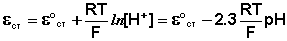 (III.53)
(III.53)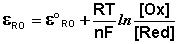 (III.54)
(III.54)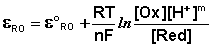 (III.55)
(III.55)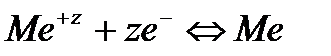 .
.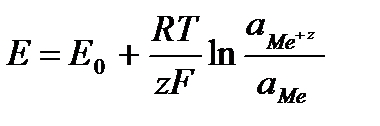 .
.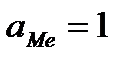 , тогда
, тогда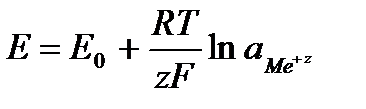 .
.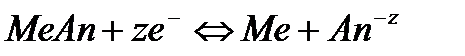 .
.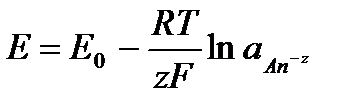
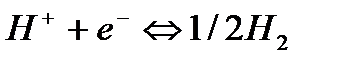 .
.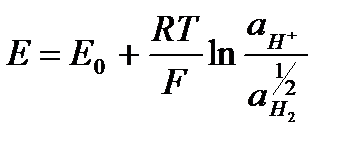 .
.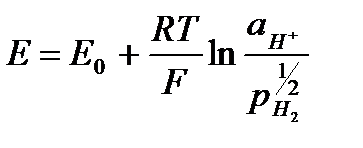 .
.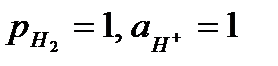 , то такой электрод является стандартным и его потенциал равен нулю:
, то такой электрод является стандартным и его потенциал равен нулю: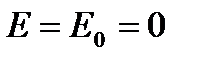
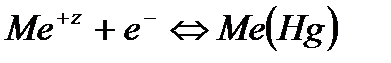
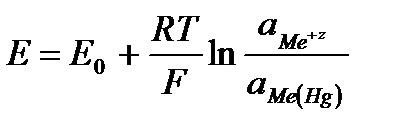 .
.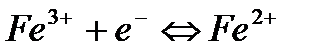
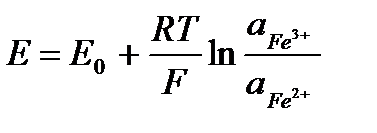 .
.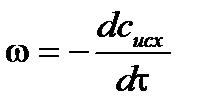 ,
,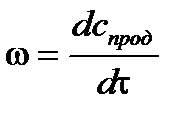
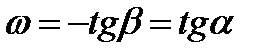 – для исходных веществ
– для исходных веществ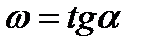 – для продуктов реакции.
– для продуктов реакции.