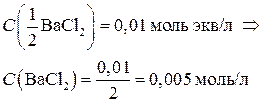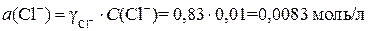Ионная сила: единицы, как ее рассчитать, примеры
Ионная сила: единицы, как ее рассчитать, примеры — Наука
Содержание:
В ионная сила это способ выражения концентрации ионов в растворе. Это понятие было введено в 1922 году Льюисом и Рэндаллом, когда они работали над описанием коэффициента химической активности.
Когда концентрация ионов в растворе высока, между ионами с противоположным зарядом происходит электростатическое взаимодействие; Другими словами, катионы и анионы очень сильно притягиваются, что приводит к тому, что фактическая или эффективная концентрация ионов меньше, чем рассчитанная для конкретной химической реакции.
По этой причине понятие химической активности было введено как эффективная концентрация ионов в растворе, причем химическая активность является произведением молярности раствора и коэффициента химической активности.
Этот коэффициент имеет значение, близкое к единице (1) для разбавленных ионных растворов и для так называемых идеальных растворов. Это растворы, в которых межмолекулярное взаимодействие между подобными молекулами такое же, как и между разными молекулами.
Создание концепции ионной силы способствовало объяснению отклонений от идеального поведения, наблюдаемых в реальных ионных растворах.
Блоки ионной силы
Ионная сила выражается в единицах моль / л (молярность) или моль / кг воды (молярность). Последний рекомендуется в неидеальных растворах, которые характеризуются тем, что объемы их смесей не являются полностью аддитивными.
Это означает, например, следующее: если смешать 0,5 л жидкости A и 0,5 л жидкости B, полученный объем этой смеси не обязательно будет равен 1 литру, но он может быть другим.
Ионная сила представлена символом I.
Как рассчитать ионную силу?
Для расчета ионной силы раствора учитывается концентрация всех ионов, присутствующих в растворе, а также их соответствующие валентности.
Значение ионной силы получается по следующей формуле:
Где I, как уже было сказано, — ионная сила; C соответствует молярной или молярной ионной концентрации ионов; в то время как Z представляет их соответствующие валентности (± 1, ± 2, ± 3 и т. д.).
Выражение, которое появляется в формуле для расчета ионной силы (Σ), читается как сумма, то есть сумма произведения молярной концентрации (C) каждого иона, присутствующего в растворе, на его повышенную валентность (Z). в квадрате.
Как видно, валентность иона имеет наибольший вес в значении ионной силы раствора. Например: валентность (Z) Ca равна +2, поэтому Z 2 равно 4. В то время как валентность (Z) Na равна +1, а значит, Z 2 равно 1.
Это указывает на то, что вклад иона Са 2+ значение ионной силы при той же молярной концентрации ионов в четыре раза больше, чем у иона Na + .
Важность ионной силы
Ионная сила является подходящей мерой ионной концентрации раствора и является основой для создания теории Дебая-Хюккеля. Эта теория описывает идеальное поведение ионных растворов.
Ионная сила служит основой для расчета коэффициента активности (γя), параметр, который, в свою очередь, позволяет рассчитать химическую активность ионного соединения, причем химическая активность представляет собой фактическую и эффективную концентрацию ионного соединения в растворе.
По мере увеличения ионной силы раствора взаимодействие между ионами увеличивается. Следовательно, γ уменьшаетсяя и химическая активность ионов.
Увеличение ионной силы может снизить растворимость белков в водной среде, это свойство используется для избирательного осаждения белков. Растворы сульфата аммония с высокой ионной силой используются для осаждения и очистки белков плазмы.
Примеры ионных сил
Пример 1
Рассчитайте ионную силу 0,3 М раствора хлорида калия (KCl).
KCl диссоциирует следующим образом:
Итак, у нас есть два иона: катион K + (Z = + 1) и анион Cl – (Z = -1). Затем мы применяем формулу для расчета ионной силы I:
I = 1/2 [C · (+1) 1 + С (-1) 1 ]
= 1/2 [0,3 М · 1 1 + 0,3 млн 1 1 ]
Обратите внимание, что -1 валентность Cl – Он был принят за 1, его абсолютное значение, иначе ионная сила была бы равна 0.
Пример 2
Рассчитайте ионную силу раствора сульфата кальция (CaSO4) 0,5 млн
Дело4 диссоциирован следующим образом:
У нас есть два иона: катион Ca 2+ (Z = + 2) и анион SO4 2- (Z = -2). Затем мы применяем формулу для расчета ионной силы I:
I = 1/2 [C · (+2) 2 + С (-2) 2 ]
= 1/2 [0,5 M 4 + 0,5 M 4]
Пример 3
Рассчитайте ионную силу буфера с конечными концентрациями двухосновного фосфата натрия (Na2HPO4) 0,3 М и одноосновный фосфат натрия (NaH2PO4) 0,4 М.
Затем2HPO4 он диссоциирован следующим образом:
В то время как NaH2PO4 диссоциирует по следующей схеме:
Мы действуем так же, как и предыдущие упражнения, на этот раз с анионами HPO4 2- (Z = -2) и H2PO4 – (Z = -1):
Обратите внимание, что концентрация Na + от Na2HPO4 он умножается на 2, так как его концентрация в два раза больше. Однако для другой соли NaH2PO4, концентрация Na + да, мы умножаем его на 1 в соответствии со стехиометрией уравнения растворения.
Пример 4
Рассчитайте ионную силу раствора 0,15 М хлорида натрия (NaCl) и глюкозы (C6ЧАС12ИЛИ6) 0,3 М.
NaCl диссоциирует следующим образом:
Глюкоза, однако, не диссоциирует на ионы, потому что в ее химической структуре есть только ковалентные связи. Следовательно, валентность глюкозы (Z) равна нулю (0). Затем рассчитываем произведение ионной силы NaCl:
I = 1/2 [C · (+1) 1 + С (-1) 1 ]
= 1/2 [0,15 M · 1 + 0,15 M · 1]
Ссылки
- Уиттен, Дэвис, Пек и Стэнли. (2008). Химия. (8-е изд.). CENGAGE Обучение.
- Википедия. (2020). Ионная сила. Получено с: en.wikipedia.or
- Доктор Дэвид К. Райан. (н.д.). Класс активности и ионной силы 4 Райан. [PDF]. Получено с: faculty.uml.edu
- Университет Мичигана. (н.д.). Более подробный взгляд на химическое равновесие. [PDF]. Получено с: umich.edu
- Elsevier B.V. (2020). Ионная сила. ScienceDirect. Получено с: sciencedirect.com
- CD. Кеннеди. (1990). Ионная сила и диссоциация кислот. [PDF]. Получено с: iubmb.onlinelibrary.wiley.com
Неверность: причины и последствия
Симптом Ровсинга: анамнез, применение при аппендиците и брюшной полости
Примеры выполнения расчетов
Расчет ионной силы раствора
Пример 1. Рассчитать ионную силу 0,1 моль/л раствора Ca(NO3)2.
Решение. Запишем уравнение диссоциации нитрата кальция:
Ca(NO3)2 ® Ca 2+ + 2
Найдем концентрации обоих ионов по формуле (1.1):
C( 
Рассчитаем ионную силу, создаваемую ионами кальция и нитрата, по формуле (1.3):


Пример 2. Рассчитать ионную силу в растворе, содержащем 0,01 моль экв/л Al(NO3)3 и 0,01 моль экв/л BaCl2.
Решение. Запишем уравнения диссоциации солей:
Al(NO3)3 ® Al 3+ + 3
Перейдем от молярных концентраций эквивалента солей к молярным концентрациям:
Найдем молярные концентрации всех ионов по формуле (1.1):
C( 
C(Cl – ) = 2 · C(BaCl2) = 2 · 0,005 = 0,01 моль/л
Рассчитаем ионную силу, которую создают все ионы в растворе, по формуле (1.3):
Расчет коэффициентов активности
Пример 3. Рассчитать коэффициенты активности каждого из ионов в растворе, указанном в примере 2.
Решение. Для расчета коэффициентов активности ионов необходимо знать ионную силу раствора, поэтому сначала выполним все необходимые действия, как описано в примере 2:
§ запишем уравнения диссоциации солей;
§ перейдем от молярных концентраций эквивалента солей к молярным концентрациям;
§ найдем молярные концентрации всех ионов и рассчитаем ионную силу раствора: I = 0,035 моль/л.
Обращаемся к справочнику [1 или 2] и выясняем, что такого значения ионной силы в нем нет. Следовательно, придется рассчитывать коэффициенты активности по эмпирическим уравнениям. Выбираем необходимое уравнение. Поскольку 0,01
§ воспользоваться формулой (1.7).
Активность иона алюминия в растворе, содержащем 0,01 моль экв/л Al(NO3)3 и 0,01 моль экв/л BaCl2, равна:

Аналогично рассчитаем активности остальных ионов:
Как видно, для всех ионов величина активности меньше концентрации, что объясняется электростатическими взаимодействиями между ионами в растворе.
Водные растворы сильных электролитов. Ионная сила раствора. Коэффициенты активности ионов
Водные растворы сильных электролитов
Ионная сила раствора. Коэффициенты активности ионов
Сильными называются электролиты, которые в водных растворах полностью или практически полностью распадаются на ионы. К ним относятся соединения с ионной связью (соли) и соединения с ковалентной полярной связью.
При растворении в воде соединений с ионной связью под действием полярных молекул воды происходит их распад на гидратированные ионы противоположного знака, т. е. диссоциация:
При растворении в воде соединений с полярной ковалентной связью (HCl, HI, HNO3) под действием диполей воды происходит ионизация ковалентной полярной связи и последующая диссоциация. Процесс диссоциации хлороводородной кислоты в водном растворе представляется уравнением:
HCl + H2O → H3O+ + Cl-
Гидратированный ион водорода (H+∙aq) принято записывать в виде иона оксония H3O+. В водных растворах сильных электролитов гидратированные
ионы электростатически взаимодействуют друг с другом (притягиваются и отталкиваются), создавая, так называемую, ионную атмосферу. Ионная атмосфера определенным образом влияет на подвижность ионов в растворе и на характер их взаимодействия. Влияние ионной атмосферы на ход химических реакций учитывается вычислением ионной силы раствора и заменой концентрации ионов их активностью.
Мерой электростатического взаимодействия ионов в растворе является ионная сила раствора (µ), равная полусумме произведений молярных концентраций всех присутствующих в растворе ионов на квадраты их зарядов:
где: Ci – молярная концентрация i-го иона, Zi — заряд i — го иона.
На величину электростатического взаимодействия ионов в растворе не влияют электронейтральные молекулы (неэлектролиты или слабые электролиты), поэтому их не учитывают при вычислении ионной силы раствора.
Легко показать, что для бинарных электролитов с однозарядными ионами (NaCl, HCl, HI, HNO3) ионная сила раствора равна молярной концентрации этого электролита, т. е. µ (NaCl) = С(NaCl). В случае бинарных электролитов с двухзарядными ионами (FeSO4, MgSO4) ионная сила раствора в четыре раза больше концентрации этого электролита, т. е. µ (FeSO4) = 4С(FeSO4). Для трехионных электролитов (K2SO4, MgCl2) ионная сила раствора в три раза больше концентрации этого электролита, т. е. µ(K2SO4) = 3С(K2SO4).
Ионная сила раствора, содержащего несколько сильных электролитов, равна сумме ионных сил, создаваемых каждым из них.
Например, ионная сила раствора, содержащего хлорид и сульфат натрия, равна: µ (NaCl + Na2SO4) = С(NaCl) + 3С(Na2SO4).
Активная концентрация или активность иона Х – это эффективная (действующая) концентрация, соответственно которой ион действует в химической реакции. Активность и равновесная концентрация иона Х связаны выражением:
где а(Х) – активность иона Х, моль/л; f(Х)- коэффициент активности иона Х в растворе (безразмерная величина), [X] — равновесная концентрация иона Х в растворе, моль/л.
В реальных растворах сильных электролитов коэффициенты активности ионов обычно меньше единицы, а для очень разбавленных растворов — близки к единице. Для идеальных растворов (растворы неэлектролитов или очень слабых электролитов, очень разбавленные растворы сильных электролитов) коэффициенты активности ионов равны единице.
Коэффициент активности индивидуального иона зависит от его природы (электронного строения), его радиуса и заряда, от ионной силы раствора. Ионы с одинаковым зарядом (по абсолютной величине) при данном значении ионной силы имеют одинаковые коэффициенты активности, значения которых приводятся в справочниках.
Активности чистых твердых веществ и молекул воды в водных растворах принято считать равными единице.
Пример. Вычислите ионную силу раствора и активность ионов в растворе хлорида натрия NaCl с молярной концентрацией C(NaCl) = 0,0100 моль/л.
Решение. Хлорид натрия в водном растворе диссоциирует на два иона (бинарный электролит) согласно уравнению:
C(Na+) = C(Cl-) = [Na+] = [Cl-] = С(NaCl) = 0,0100 моль/л.
Ионная сила раствора бинарного электролита равна его концентрации, т. е. µ (NaCl) = С(NaCl) = 0,0100 моль/л, или µ = 0,5[C(Na+)Z2(Na+) + C(Cl-) Z2(Cl-)]= 0,5 [0,0100∙12 + 0,0100∙12] = 0,0100
При данном значении ионной силы раствора коэффициенты активности однозарядных ионов равны 0,890, т. е.
Активности ионов натрия и хлорид-ионов равны друг другу, так как равны их концентрации и коэффициенты активности. По формуле a(Х) = f (Х) [X] находим:
a (Na+) = a (Cl-) = 0,0100∙0,890 = 8,90∙10-3 моль/л
Ионное произведение воды
Вода является очень слабым электролитом и ее самоионизация (автопротолиз) описывается следующим уравнением:
H2O + H2O → H3O+ + OH — ΔH = + 55,9 кДж∙моль-1
Термодинамическая (выраженная через активности) константа равновесия этой реакции называется константой автопротолиза воды или ионным произведением воды:
Ионное произведение воды при постоянной температуре является величиной постоянной для воды и любого водного раствора. При t=220C значение Kw составляет 1,00∙10-14.
Чистая вода является нейтральной и в ней
В водном растворе какого-либо электролита характер среды определяется соотношением активностей ионов H3O+ и OH-.
Нейтральная среда a(H3O+) = 1,00∙10-7 = a(OH-)
Кислая среда a(H3O+) > 1,00∙10-7 > a(OH-)
Щелочная среда a(H3O+) 7,00.
Водные растворы сильных кислот и оснований
Сильные кислоты вида HAn (HCl, HClO3, HClO4, HBr, HI, HNO3 и др.) в водных растворах полностью диссоциируют на ионы:
HAn + H2O → H3O+ + An-
При известной молярной концентрации сильной кислоты в растворе можно определить концентрацию ионов и рассчитать ионную силу раствора. Определив коэффициенты активности ионов из таблицы, можно вычислить активности ионов. Для кислоты HAn имеем:
a(H3O+) = C(H3O+) f(H3O+) = C(HAn) f(H3O+)
Если в водном растворе сильной кислоты нет других источников ионов H3O+, кроме кислоты HAn, то pH такого раствора вычисляется по формуле
рH = — lg a(H3O+) = — lg [C(HAn)f(H3O+)].
Сильные основания вида KtOH (NaOH, KOH, CsOH и др.) в водных растворах полностью диссоциируют на ионы
Активность ионов H3O+ в водном растворе сильного основания KtOH вычисляется по формуле:
Значение pH вычисляется по формуле:
pH = — lg a(H3O+) = pKw — pOH = 14, 00 + lg [C(OH-)f(OH-)]
Равновесие в водных растворах слабых кислот
С точки зрения протолитической теории, ионизация слабых кислот, слабых оснований, их взаимодействие – это процесс переноса протонов от одних молекул или ионов к другим. Кислоты — это вещества (молекулы или ионы), которые отдают протоны, т. е. они являются донорами протонов. Основания — это вещества (молекулы или ионы), которые принимают протоны, т. е. они являются акцепторами протонов.
Ионизация слабой монопротонной (одноосноной) кислоты HAn в водном растворе протекает согласно уравнению:
HAn + H2O → H3O+ + An-,
где a и b — сопряжённые кислота (acid) и основание (base).
Процесс ионизации кислоты характеризуется константой равновесия, называемой константой кислотности Ka(HAn):
Чем меньше численное значение константы кислотности, тем кислота слабее, и наоборот. Значения констант кислотности слабых кислот приводятся в справочниках.
Так как в растворах слабых электролитов концентрации ионов малы, то близка к нулю их ионная сила, а активности ионов поэтому равны их концентрациям ( 0, f 1). Обозначим молярную концентрацию слабой кислоты HAn через Ca, степень ее ионизации через a , тогда
Подставив значения активностей частиц в выражение константы кислотности, получим математическое выражение закона разбавления Оствальда
Для раствора слабой кислоты при соотношении Ca / Ka 400, степень её ионизации меньше или равна 5% (0,05), [HAn] = Ca, знаменатель дроби 1 — 1, тогда Ka = Ca a 2 .
В этом случае справедливы следующие соотношения:
Полученные формулы могут быть использованы также для расчета рН растворов слабых полипротонных кислот. В этом случае учитывается ионизация кислоты только по первой ступени, а в формулы для расчета подставляется значение первой константы кислотности.
Равновесие в растворах слабых оснований
Ионизация слабого основания An — в водном растворе описывается уравнением
An — + H2O → HAn + OHb
и характеризуется константой равновесия, называемой константой основности Kb(An-):
Как видно из приведенного выше уравнения, для водного раствора кислоты или основания справедливо соотношение Ka(HAn)∙Kb(An-) = Kw = 1,00∙10-14. Оно позволяет вычислять отсутствующие в справочниках значения констант сопряженной кислоты или основания.
Если для слабого однокислотного основания An- с молярной концентрацией Cb соотношение Cb/Kb 400, то его степень ионизации b 5% ( 0,05) и справедливы формулы:
pH = 14,00 – pOH =14,00 – . (pKb + pCb)
Вычисление констант равновесия реакций нейтрализации
Реакция взаимодействия кислоты и основания с образованием соли и воды называется реакцией нейтрализации.
Константа равновесия реакции нейтрализации записывается по сокращенному ионно-молекулярному уравнению, так как суть любого химического взаимодействия, протекающего в водном растворе, выражается его сокращенным ионно-молекулярным уравнением. При составлении ионно-молекулярного уравнения слабые электролиты (слабые кислоты и слабые основания) и малорастворимые в воде соединения записываются в виде молекул, а сильные электролиты (сильные кислоты, сильные основания и растворимые в воде соли) – в виде ионов.
Взаимодействие сильных кислот и оснований, например,
HCl + NaOH → NaCl + H2O,
описывается сокращенным ионно-молекулярным уравнением:
Выражение константы равновесия этой реакции имеет вид:
Так как a(H2O) = 1, то
Kp = 1/a(H3O+) a(OH-) = 1/Kw = 1/1,00∙10-14 = 1,00∙1014
Большое численное значение константы равновесия свидетельствует о том, что реакция между сильной кислотой и сильным основанием идет практически до конца. В полученном растворе a(H3O+) = a(OH-) = 1,00 107 w K моль/л.
Сокращенное ионно-молекулярное уравнение реакции взаимодействия слабой кислоты и сильного основания, или сильной кислоты и слабого основания, кроме молекул воды включает молекулы соответствующей слабой кислоты или слабого основания. Константа равновесия такой реакции включает ионное произведение воды и константу кислотности или константу основности. Например, для реакции
CH3COOH + NaOH → CH3COONa + H2O,
сокращенное ионно-молекулярное уравнение которой
CH3COOH + OH — → CH3COO- + H2O,
выражение константы равновесия имеет вид:
Подставив численные значения Ka(CH3COOH) и Kw получаем
Kp = 1,75∙10-5/1,00∙10-14 = 1,75∙10-9
Из приведенных примеров видно, что реакции нейтрализации с участием слабых электролитов отличаются меньшими значениями константы равновесия, чем в случае реакций между сильными электролитами.
При написании и вычислении констант равновесия реакций с участием слабых электролитов необходимо:
1. Написать сокращенное ионно-молекулярное уравнение реакции. Выделить слабые электролиты и выписать из справочника значения констант, характеризующих их ионизацию.
2. В числителе дроби, выражающей константу равновесия, записать перемноженные между собой константы ионизации (Ka, Kb, Kw) слабых электролитов – реагентов, а в знаменателе — перемноженные между собой константы ионизации слабых электролитов — продуктов реакции, возведя все константы в степени, равные их стехиометрическим коэффициентам в уравнении реакции.
3. Подставить в формулу численные значения констант ионизации и вычислить значение константы равновесия.
Слабые многопротонные кислоты необходимо представить общими константами кислотности (произведение всех ступенчатых), если в ходе реакции произошла их полная нейтрализация.
В случае частичной нейтрализации многопротонной кислоты, приводящей к образованию кислой соли, в выражение константы равновесия подставляется соответствующая ступенчатая константа кислотности.
http://lektsii.org/8-75660.html
http://pandia.ru/text/80/382/43200.php