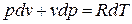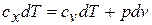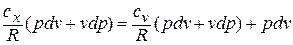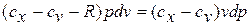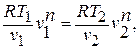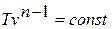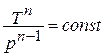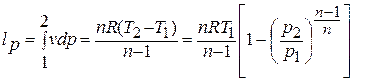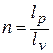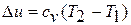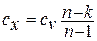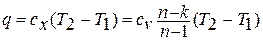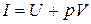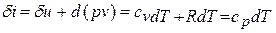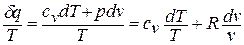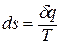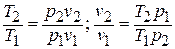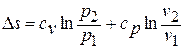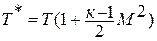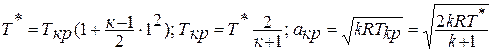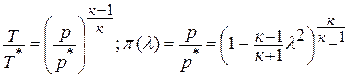Уравнение политропного процесса.
Продифференцируем уравнение состояния для 1 кг идеального газа:
Принимая теплоемкость не зависящей от температуры, получим уравнение первого закона термодинамики в дифференциальной форме:
Подставляя в это уравнение выражение для 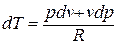
Разделяя переменные и произведя интегрирование, получаем
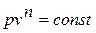
где 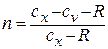
Зависимость между температурой и удельным объёмом определяется путём замены давления в уравнении политропного процесса его значением из уравнения состояния идеального газа:
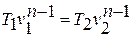
Исключая подобным же образом удельный объём, находим зависимость между давлением и температурой:

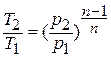
Деформационная работа, производимая 1 кг газа в политропном процессе, определяется по формуле:
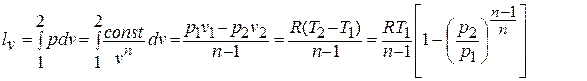
То есть отношение технической и деформационной работ равно показателю политропы:
Изменение внутренней энергии в политропном процессе находится общей формулой:
Теплоёмкость процесса 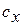
Количество теплоты в политропном процессе находится по формуле:
1.12. Энтальпия рабочего тела.
В термодинамике важную роль играет сумма внутренней энергии системы 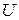
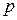
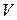
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния.
Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности . Величина
называемая удельной энтальпией ( 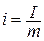
Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния:
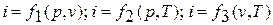
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Физический смысл энтальпии выясним на следующем примере. Рассмотрим расширенную систему, включающую газ в цилиндре и поршень с грузом общим весом G (рис.1.7). Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: 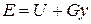
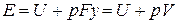

Уравнение 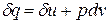
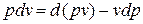
Рис.1.10. К определению физического смысла энтальпии
Из этого соотношения следует, что если давление термодинамической системы сохраняется неизменным, то есть осуществляется изобарный процесс (dp = 0), то 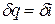
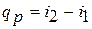
Это выражение очень часто используется в расчетах, так как огромное
количество процессов подвода теплоты в теплоэнергетике (в паровых котлах, камерах сгорания газовых турбореактивных двигателей, теплообменных аппаратах), а также целый ряд процессов химической технологии и многих других производствах осуществляется при постоянном давлении. Кстати, по этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, a не внутренней энергии.
Для идеального газа для вычисления энтальпии используется формула
Так как между энтальпией и внутренней энергией существует связь, выбор начала отсчета одной из них произволен: в точке, принятой за начало отсчета внутренней энергии, 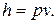

р = 610,8 Па, 
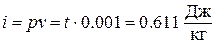
При расчетах практический интерес представляет изменение энтальпии в конечном процессе:
1.13. Энтропия рабочего тела.
Как уже указывалось, величина 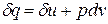
В математике доказывается, что дифференциальный двучлен всегда можно превратить в полный дифференциал путем умножения (или деления) на интегрирующий множитель (или делитель). Таким интегрирующим делителем для элементарного количества теплоты 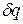
Покажем это на примере изменения состояния идеального газа в равновесных процессах:
Выражение 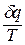
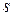
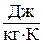
Для произвольного количества газа энтропия, обозначаемая через 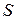
равна 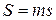
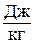
Таким образом, аналитически энтропия определяется следующим образом:
Эта формула справедлива как для идеальных, так и для реальных газов.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
Понятием «энтропия» (от греч. Entropia – поворот, превращение) будем называть в термодинамике направление теплообмена между рабочим телом термодинамической системы и внешней средой.
Значение энтропии для заданного состояния газа определяется интегрированием уравнения для энтропии:
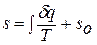

При температурах, близких к абсолютному нулю, все известные газы находятся в конденсированном состоянии. Вальтер Нернст (1864 – 1941), немецкий физик и химик, в 1906 году экспериментально установил, а Макс Планк (1858 – 1947), немецкий физик, в 1912 году окончательно сформулировал следующий принцип:
при температуре, стремящейся к абсолютному нулю, энтропия газа, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю,то есть 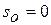
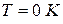
Этот закон называют третьим законом термодинамикиили тепловой теоремой В.Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
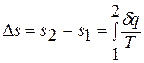
поэтому энтропию тоже отсчитывают от произвольно выбранного уровня.
Получим формулы, позволяющие вычислить изменение энтропии идеального газа. Для этого проинтегрируем уравнение для энтропии, полагая 
Имея в виду уравнение состояния, записанное для состояний «1» и «2», получаем:
После подстановки отношений 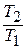
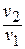
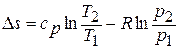
Поскольку энтропия есть функция состояния рабочего тела, написанными уравнениями можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями «1» и «2» и, в частности, от того, равновесный этот переход или нет.
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов 
на 
Из уравнения для изменения энтропии следует, что в равновесном процессе: 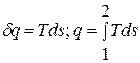

Рис.1.11. Графическое изображение теплоты в 
линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Формула для элементарного изменения энтропии показывает, что 
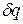
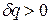
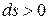

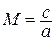
Данное отношение названо в честь Эрнста Маха (1838 – 1916), австрийского физика и философа; отношение является критерием( от греч. Kriterion – средство для суждения) – признаком, на основании которого производится оценка, определение или классификация чего — либо; мерило оценки; в данном случае критерий сжимаемости газа. Формула 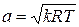
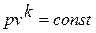
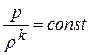
Дифференциальное уравнение этого процесса представляется так 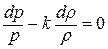
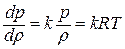
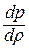
Отсюда выражение для полной энергии потока в сечении записывается так:
Число Маха, таким образом, является характеристикой сжимаемости рабочего тела. Например, при 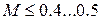
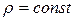
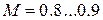
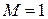

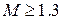
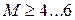
Принимая 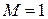
Если формулу для полной энергии потока разделить на 
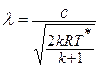
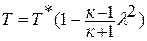
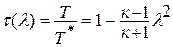
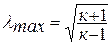
Если принять процесс торможения потока от температуры 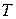
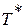
или плотности 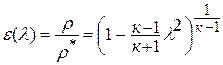
Уравнение сохранения энергии широко используется в авиационной практике для различных элементов двигателей. Например:
а) работа , подводимая к валу ротора компрессора 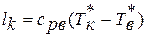
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Исследование политропного процесса при истечении газа через суживающееся сопло
Цель работы: Экспериментальное определение показателя политропы воздуха, вытекающего из суживающегося сопла, и зависимости расхода от скорости.
Краткие теоретические сведения.
В современной технике нашли широкое применение тепловые машины, в которых производится работа за счёт изменения кинетической энергии движущегося потока рабочего тела, например, в паровых и газовых турбинах, в реактивных двигателях, в эжекторах. В соответствии с первым законом термодинамики в произвольном термодинамическом процессе удельная теплота, подведённая извне к рабочему телу, расходуется на изменение внутренней энергии тела и совершение удельной работы:
Пусть в данном политропном процессе на изменение внутренней энергии газа идёт некоторая доля α внешнего тепла:
тогда оставшаяся часть тепла (1- α) идёт на совершение работы:
Величина α называется коэффициентом распределения теплоты в политропном процессе и остаётся неизменной в течение данного политропного процесса:
Таким образом, политропным называется процесс изменения состояния рабочего тела, в котором во внутреннюю энергию Δu в течение всего процесса превращается одна и та же доля α внешней теплоты q. Процесс в этом случае протекает при постоянной теплоёмкости, а уравнение политропного процесса имеет вид:
р υ n = const, (6.5)
где n – показатель политропы, определяемый по формуле:
где cп, Дж/(кг·К) – удельная политропная теплоёмкость;
cp, Дж/(кг·К) – удельная изобарная теплоёмкость;
cv, Дж/(кг·К) – удельная изохорная теплоёмкость.
Соотношение параметров в политропном процессе подчиняется следующим уравнениям:
Рассмотрим выражения для работы расширения газа в политропном процессе между двумя равновесными состояниями рабочего тела в точках 1 и 2.
Величина совершённой газом работы расширения находится по формуле:
l = 
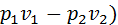
Теплота, подведённая в политропном процессе, определяется по формуле:
Теплоёмкость политропного процесса определяется по формуле:
где k – показатель адиабаты, зависящий только от атомности газа.
Из данного соотношения следует, что теплоёмкость политропного процесса есть функция показателя политропы n. Показатель политропы может принимать любые постоянные значения — ∞
В частных случаях уравнение политропы принимает вид уравнений адиабаты, изотермы, изобары или изохоры. Поэтому и величина теплоёмкости для различных политропных процессов также изменяется в пределах — ∞ k = const, т.е. имеем адиабату; при n = 1, cп = ± ∞ уравнение запишется р·υ = const, что соответствует изотерме; при n = 0 получим cп = сv·k = cp и уравнение р = const, что соответствует изобаре; при n = ± ∞ cп = сv – имеем изохору, т.е уравнение v = const.
Значение n в любом политропном процессе может быть определено по координатам двух любых точек процесса из выражений:
n = 



В процессе истечения воздуха через суживающееся сопло считаем, что истечение воздуха происходит из резервуара неограниченной ёмкости, поскольку имеет место непрерывная подача воздуха от вентилятора.
Примем параметры в резервуаре р1, v1, Т1; параметры газа в выходном сечении сопла р2, v2, Т2; параметры окружающей среды, куда вытекает воздух через суживающееся сопло, р0, v0 и Т0. Тогда перепад давлений, при котором происходит процесс истечения:
По известному перепаду давлений и определённому по формулам 6.13 – 6.15 значению показателя политропы скорость истечения определится из выражения:
w = 
где R = 287 Дж/(кг·К) – удельная газовая постоянная для воздуха и двухатомных газов.
Расход рабочего тела (воздуха) при истечении определяется по уравнению:
G =F 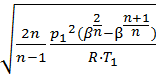
где F, м 2 – площадь выходного сечения.
Описание экспериментальной установки
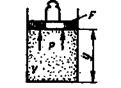
Рабочим участком экспериментальной установки, схема которой представлена на рис. 5.1, является суживающееся сопло 2 прямоугольного сечения.
Рис. 6.1. Схема лабораторной установки для исследования политропного процесса истечения воздуха
1 – воздушный вентилятор, 2 – резервуар, 3 – электрический нагреватель, 4 — суживающееся сопло, 5 — термопары, 6 – жидкостные манометры, 7 – реостат нагревателя, 8 – выключатель, 9 — электродвигатель.
Воздух нагнетается вентилятором 1, приводимым во вращение электродвигателем 9, частота вращения которого и, соответственно количество подаваемого им воздуха в резервуар 2, регулируется реостатом на горизонтальной части пульта управления установки.
Экспериментальный участок сопла имеет рубашку, которая может дополнительно нагреваться или охлаждаться потоком воздуха от вентилятора. Выходное сечение сопла — прямоугольной формы, площадью F = 1,8·10 -4 м 2 . Воздух перед поступлением в суживающуюся часть сопла может нагреваться электронагревателем 3, подсоединенным через выключатель 8; нагрев регулируется с помощью реостата 7, расположенного на горизонтальной части пульта управления установкой.
В зависимости от количества теплоты, сообщённого движущемуся по каналу воздушному потоку, можно осуществлять различные политропные процессы расширения, дополнительно меняя расход воздуха через сопло от наибольшего Gmax до наименьшего – Gmin значений.
Измерительный комплекс состоит из термопар 5, измеряющих температуру воздуха на входе в сопло, в середине канала и в выходном срезе сопла, а также дифференциальных манометров 6, установленных в тех же сечениях для измерения избыточного давления. Значения температур снимаются с цифрового многоканального пирометра, расположенного на горизонтальной панели пульта управления установкой.
Методика выполнения работы
Перед проведением опытов измерить атмосферное давление В и температуру воздуха tв в лаборатории, записать их значения в журнал наблюдений.
Выключателем на горизонтальной части пульта управления запустить вентилятор 1, и, контролируя по дифференциальным манометрам 5 на вертикальной панели установки расход воздуха, рукоятками управления на пульте плавно установить рекомендуемые преподавателем режимы:
1- исследование процесса истечения без нагрева рабочего воздуха и воздуха, поступающего в рубашку сопла;
2- исследование процесса истечения со средним нагревом рабочего воздуха и без нагрева воздуха, поступающего в рубашку сопла;
3 — исследование процесса истечения с наибольшим нагревом рабочего воздуха и без воздуха, поступающего в рубашку сопла;
4- исследование процесса истечения без нагрева рабочего воздуха и с подогревом воздуха, поступающего в рубашку сопла.
На каждом режиме произвести замеры температур и давлений во входном (Т1, р1), среднем (Т2, р2), и выходном сечениях сопла (Т3, р3), а также динамический напор воздуха, измеряемый трубкой Пито.
Провести аналогичные измерения для каждого опыта, добиваясь при этом стабилизации теплового режима в течение 10 мин. Результаты измерений записать в таблицу протокола наблюдений:
| № опы-та | Т1 | Т2 | Т3 | р1 | р2 | р3 | n1-2 | n2-3 | nср. | β | ω, м/с | G, кг/с |
| К | мм вод. ст. | |||||||||||
| Без нагрева | ||||||||||||
| Снагревом без охл. рубашки | ||||||||||||
| С нагревом и с охлажд. рубашкой |
По окончании измерений вращением против часовой стрелки ручек на горизонтальной панели управления отключить напряжение, подаваемой на нагреватель. После того, как нагреватель охладится ниже 50 0 С отключить его и вентилятор выключателями установки, отсоединить питание установки от сети лаборатории.
Обработка результатов эксперимента
Используя полученные данные, вычислить по замеренным в двух смежных сечениях параметрам воздуха показатели политропы на отдельных участках, принимая во внимание, что на них в потоке воздуха имеют место равные политропные процессы. Так для участка вход-середина сопла из уравнения:

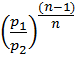
Аналогично находится показатель политропы n2 для участка середина — выходное сечение сопла. Затем вычисляется среднее значение показателя политропы для всего сопла:
Кроме того, необходимо вычислить перепад давлений, при котором происходит процесс истечения:
По известному перепаду давлений и определённому по формуле (6.2) показателю политропы находится скорость истечения:
w = 
где R – удельная газовая постоянная воздуха, Дж/кг·К.
Расход рабочего воздуха, при истечении определяется по уравнению:
G = F 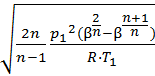
где F – площадь выходного сечения, м 2 .
Изобразить исследованный политропный процесс в P-υ и Т-s диаграммах.
В заключении сделать вывод по проделанной лабораторной работе.
1. Какой процесс называется политропным? Запишите соотношения основных термодинамических параметров в политропном процессе.
2. Напишите первый закон термодинамики для политропного процесса. Как определяются величины, входящие в уравнение?
3. Каковы пределы изменения показателя политропы и теплоёмкости в политропных процессах?
4. Какие ранее изученные процессы являются частными случаями политропных процессов?
5. Изобразите в системе координат P-υ и Т-s основные политропные процессы. Чему равны значения показателей политропы в этих процессах?
6. Напишите уравнение неразрывности для потока.
7. Какие режимы истечения газов и паров из сопла Вы знаете?
8. Напишите уравнение первого закона термодинамики для потока. Поясните, какие величины входят в уравнение?
9. Какие каналы называются соплами и диффузорами? Как изменяются в них основные термодинамические параметры?
10. Дайте описание комбинированного сопла Лаваля. Где применяются такие сопла?
http://energoworld.ru/theory/osnovnyie-termodinamicheskie-protsessyi/
http://poisk-ru.ru/s63187t21.html