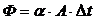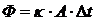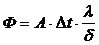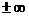Energy
education
сайт для тех, кто хочет изучать энергетику
Термодинамика и тепломассообмен
Идеальный газ
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
4. Процессы изменения состояния идеальных газов
К основным термодинамическим процессам относят следующие четыре процесса:
- изохорный – при постоянном объеме ($v = const$);
- изобарный – при постоянном давлении ($р = const$);
- изотермический – при постоянной температуре ($Т = const$);
- адиабатный – без теплообмена с внешней средой ($\mathrm
q = 0$).
В реальных условиях указанные ограничения практически не выполняются. В связи с этим в технической термодинамике существует понятие политропного процесса как общего случая термодинамического процесса. Предполагается, что политропный процесс обратим и теплоемкость рабочего тела (идеального газа) $с_n$ в ходе данного процесса не изменяется ($c_n=const$). Уравнение политропного процесса имеет вид:
где $n=\frac
Изобарный процесс – термодинамический процесс, происходящий в системе при постоянном давлении. Параметры состояния идеального газа на изобаре связаны соотношением:
Отсюда следует, что чем выше температура газа, тем больше его удельный объем (т.е. тем меньше плотность). При этом величина v на изобаре при повышении температуры растет тем быстрее, чем меньше давление.
Работа расширения системы в изобарном процессе определяется следующим образом:
Для идеального газа работа расширения системы в изобарном процессе может быть представлена также в следующем виде:
Количество теплоты, сообщаемой системе при нагреве (или отдаваемой системой при охлаждении) в изобарном процессе, определяется следующим образом:
$$\mathrm
Изменение энтропии в изобарном процессе, т.е. разность энтропий, соответствующих состояниям 1 и 2, определяется из соотношения:
Изотермический процесс – процесс изменения состояния термодинамической системы при постоянной температуре.
Для идеального газа давления и объемы в любых точках на изотерме связаны уравнением Бойля—Мариотта, т.е. зависимость объема от давления на изотерме для идеального газа имеет характер гиперболы:
Работа расширения системы в изотермическом процессе между точками изотермы 1 и 2 определяется с помощью общего соотношения:
Количество теплоты , подводимой к системе (или отдаваемой системой) в изотермическом процессе, определяется из известного соотношения:
Количество работы, совершаемой идеальным газом в изотермическом процессе, равно количеству теплоты, подведенной к этому газу:
Изменение энтропии в изотермическом процессе, т.е. разность энтропий, соответствующих состояниям 1 и 2, вычисляется следующим способом:
Адиабатный процесс – такой термодинамический процесс, в котором к системе не подводится и от системы не отводится теплота. Термодинамическую систему, в которой протекает адиабатный процесс, можно представить себе в виде некоторого объема, ограниченного оболочкой, снабженной идеальной теплоизоляцией, абсолютно не пропускающей теплоту. В реальных условиях процесс является адиабатным в тех случаях, когда система снабжена хорошей теплоизоляцией или когда процесс расширения (сжатия) газа происходит настолько быстро, что не успевает произойти скольконибудь заметный теплообмен газа с окружающей средой.
Поскольку для обратимого процесса $\mathrm
Для любого состояния системы в изоэнтропном процессе справедливо соотношение Пуассона:
Если показатель изоэнтропы $k$ изменяется с изменением состояния системы и известен характер зависимости $k$ на изоэнтропе, то для расчета величины $p_2$ по известным $p_1$, $v_1$ и $v_2$ следует вычислить интеграл, стоящий в правой части по известным значениям $k$.
Для идеального газа показатель изоэнтропы $k$ можно определить:
Так как для идеального газа $c_p=c_v+µR$, тогда:
Как известно, теплоемкости идеального газа слабо изменяются с температурой, поэтому и величину $k$ с высокой степенью точности можно считать практически не зависящей от температуры. Известно, что мольная изохорная теплоемкость $μс_v$ идеального газа равна примерно $13$ кДж/(кмоль·К) для одноатомного идеального газа, $21$ кДж/(кмоль·К) для двухатомного и $29$ кДж/(кмоль·К) для трех- и многоатомного газа. Поскольку $µR≈8.3$ кДж/(кмоль·К), то получаем следующие примерные значения показателя изоэнтропы $k$ идеального газа: одноатомный $k=1.67$, двухатомный $k=1.40$, трех- и многоатомный $k=1.29$. Для воздуха показатель изоэнтропы в идеально-газовом состоянии равен примерно $1.40$.
Для изоэнтропного процесса в идеальном газе можно получить соотношения, связывающие между собой значения $p$, $Т$ и $v$:
Работа расширения системы в изоэнтропном процессе определяется следующим образом:
Таким образом, в адиабатном процессе работа расширения системы совершается за счет убыли внутренней энергии системы. Это и понятно – ведь в адиабатном процессе к системе нет притока теплоты извне и единственный источник энергии для совершения работы – внутренняя энергия самой системы.
В случае идеального газа уравнения для расчета работы расширения могут быть представлены также в иной форме:
Следует подчеркнуть, что уравнение выше пригодно для расчета в том случае, если в интервале параметров между точками 1 и 2 показатель изоэнтропы $k$ сохраняется постоянным.
Политропные процессы. Политропными называют термодинамические процессы, удовлетворяющие уравнению:
при произвольном, постоянном для данного процесса значении $n$.
Понятие о политропных процессах было введено в термодинамике по аналогии с понятием об адиабатных процессах. Уравнение политропного процесса по внешнему виду сходно с уравнением адиабаты, однако существенная разница между этими уравнениями состоит в том, что если показатель изоэнтропы (адиабаты) $k$ является в общем случае величиной переменной, то уже само понятие политропного процесса основано на предположении о том, что показатель политропы n является постоянной величиной. В политропном процессе к системе может подводиться (или отводиться от нее) теплота.
Понятие о политропных процессах широко используется главным образом при изучении процессов сжатия и расширения в газовых двигателях, зачастую политропные процессы оказываются удобными для аппроксимации действительных газовых процессов в двигателях. Реальные процессы сжатия в газовых двигателях и компрессорах часто не являются ни адиабатными, ни изотермическими, а занимают промежуточное положение между этими двумя видами процессов. Поэтому обычно встречаемые на практике значения показателя n политропного процесса лежат в интервале от $1$ до $k$.
Если политропный процесс осуществляется в идеальном газе, то нетрудно получить зависимости между начальными и конечными параметрами процесса:
Работа расширения системы в политропном процессе между точками 1 и 2 определяется с помощью уравнения:
Это уравнение можно преобразовать в вид:
Количество теплоты , подводимой к системе (или отводимой от нее) в политропном процессе можно определить с помощью уравнения первого закона термодинамики:
Тогда теплоемкость идеального газа в политропном процессе:
Изменение энтропии системы в политропном процессе, т.е. разность энтропий, соответствующих точкам 1 и 2 на политропе, определяется из соотношения:
Для того чтобы определить значение показателя политропы для того или иного конкретного газового процесса, надо располагать экспериментальными данными для этого процесса.
Администратор сайта: Колосов Михаил
email:
Copyright © 2011-2022. All rights reserved.
Укажите номер правильного ответа
1. Уравнение для расчета теплоты в изохорном процессе имеет вид
1) 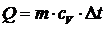
2. Связь между параметрами для изохорного процесса определяется выражением
3. Связь между параметрами изобарного процесса определяется выражением
1) 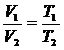
4. Процессы дизельного двигателя в координатных осях T — S представлены на рисунке
 |
5. Цикл Ренкина в координатных осях P — V представлен на рисунке
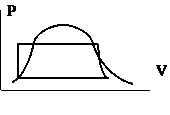
6. Уравнение для расчета термического КПД двигателя внутреннего сгорания с подводом теплоты при P = const и v = const имеет вид
1) 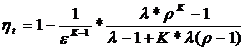
7. Уравнение для расчета термического КПД двигателя внутреннего сгорания с подводом теплоты при v = const имеет вид
1) 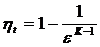
8. Уравнение для расчета КПД цикла Ренкина имеет вид
1) 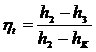
9. Цикл Отто в координатных осях T — S представлен на рисунке

10. Уравнение для расчета КПД цикла Карно имеет вид
1) 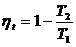
11. Процесс расширения газа, в котором совершается наибольшая работа, показан на графике

12. Цикл Карно в координатных осях T – S представлен на рисунке

13. Связь между параметрами изотермического процесса определяется выражением
1) 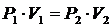
14. Процесс, имеющий минимальный теплообмен, показан на графике

15. Изотермический процесс показан на графике

16. Процессам, в которых подводится теплота, соответствует график
 |
17. При нагревании газа больше изменится энтропия в процессе
18. Уравнение работы для изотермического процесса имеет вид
1) 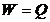
19. Уравнение для изменения энтропии в изохорном процессе имеет вид
1) 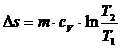
20. Уравнение для изменения энтропии в адиабатном процессе
1) 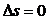
21. Адиабатный процесс показан на графике
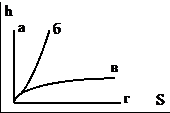
22. Закону Ньютона – Рихмана соответствует уравнение
1) 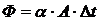
23. Уравнение теплопередачи имеет вид
1) 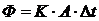
24. Закону теплопроводности (Фурье) соответствует уравнение
1) 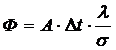
25. Показатель адиабаты К определяется выражением
1) 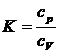
26. Передача теплоты от одной среды другой через стенку называется
27. В абсорбционных холодильных установках в качестве хладона используется
1) бинарная смесь.
28. Сухой насыщенный водяной пар имеет степень сухости
1) 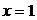
29. Процесс парообразования проходит при
1) 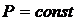

30. Критерий Нуссельта характеризует
1) интенсивность теплоотдачи;
31. Критерий Рейнольдса характеризует
3) режим вынужденного движения;
32. Критерий Грасгофа характеризует
1) подъемную силу при естественной конвекции.
33. Критерий Прандля характеризует
1) физические свойства подвижной среды;
34. Горючими элементами твердого и жидкого топлива являются
1) 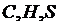
35. При расчете тепловых потерь через пол площадь пола разделяют на зоны шириной
36. При дросселировании идеального газа остается постоянным
37. Минимальная работа в компрессоре затрачивается, если сжатие
38. Основные тепловые потери через ограждение определяются по формуле
1) 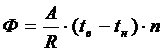
39. Тепловые потери на отопление здания по укрупненным показателям определяются по формуле
1) 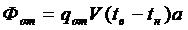
40. Значение удельной отопительной характеристики здания q от зависит от
1) объема и назначения здания;
41. Наиболее совершенными являются ледники
1) с боковым расположением льда.
42. В животноводческом помещении необходимый воздухообмен (м 3 /час), исходя из допустимого содержания водяных паров, вычисляется по формуле
1) 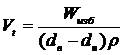
43. В животноводческом помещении необходимый воздухообмен (м 3 /час), исходя из допустимой концентрации СО 2 , вычисляется по формуле
1) 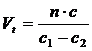
44. В животноводческом помещении необходимый воздухообмен (м 3 /час) по избыточной теплоте рассчитывают по формуле
1) 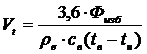
45. Математическое выражение первого закона термодинамики для изолированных систем имеет вид
1) 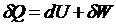
46. Уравнение первого закона термодинамики через энтальпию имеет вид
1) 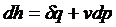
47. Уравнение политропного процесса имеет вид
1) 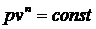
48. Закон Стефана — Больцмана при лучистом теплообмене имеет вид
1) 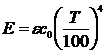
4 9. В вакууме процесс переноса теплоты осуществляется
1) тепловым излучением;
50. Наибольшее значение теплопроводности имеют
1) чистые металлы.
51. В котельных установках деаэрация воды производится
1) для удаления растворенных газов;
52. В котельных установках катионитовые фильтры предназначены
1) для умягчения воды;
53. Значение показателя адиабаты зависит от
1) числа атомности газа;
54. Холодильный коэффициент обратимого цикла Карно определяется по формуле
2) 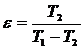
55. Температура кипения воды зависит от
56. Основным горючим элементом твердого и жидкого топлива является
57. Расход теплоты на технологические нужды определяется по формуле
1) 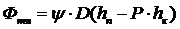
58. Для сгорания 1 кг водорода требуется кислорода
59. Критерий Нуссельта характеризует
1) интенсивность теплоотдачи;
60. Минимальная работа в компрессоре затрачивается, если сжатие
61. Установите соответствие между законом и его математическим выражением
1) Закон Ньютона – Рихмана
а)
2) Закон теплопроводности
б)
г)
где Ф — тепловой поток;
α — коэффициент теплоотдачи;
κ — коэффициент теплопередачи;
А — площадь поверхности теплообмена;
δ — толщина стенки.
62. Установите соответствие между процессом и показателем политропы n
Показатель политропы n
а) n =
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
http://ekonomych.narod.ru/gos/teploteh.htm
http://energoworld.ru/theory/osnovnyie-termodinamicheskie-protsessyi/