Уравнение состояния газов
Основными характеристиками физического состояния газа являются его давление, температура и плотность. Все эти величины взаимозависимы. Газы сжимаемы, поэтому их плотность меняется в зависимости от давления и температуры. Связь между давлением, температурой и плотностью для идеальных газов дается уравнением состояния газов, известным из физики. Оно пишется

где 



Для каждого газа существует температура, называемая критической, выше которой любой газ можно с большой степенью точности назвать идеальным. Если температура газа выше критической, то газ ни при каком давлении не может быть переведен ни в жидкое, ни в твердое состояние.
Идеальный газ, находясь в смеси с другими газами, ведет себя независимо от них, имея собственные давление 


Рассмотрим уравнение состояния газа применительно к сухому воздуху, поскольку он как смесь газов удовлетворяет изложенным выше положениям физики. В табл. 2 приведены значения критической температуры для основных газов, входящих в состав сухого воздуха.
Критическая температура газов, входящих в состав сухой атмосферы
Для сухого воздуха, кроме входящего в него углекислого газа, все газы имеют критическую температуру более низкую, чем температуры, наблюдаемые в земной атмосфере, т.е. сухой воздух можно считать смесью идеальных газов. Углекислый газ в атмосфере имеет очень малое парциальное давление, далекое от насыщающего, т.е. в естественных условиях он также не может сконденсироваться.
Для каждого газа, входящего в атмосферу, можно записать уравнение состояния

где 


Удельная газовая постоянная связана с универсальной R= 8,31441·103 Дж/кмоль·К так:

где 

Общее давление смеси

Принимая массу сухого воздуха равной единице, а массу газа 

где: 
Используя уравнения (1), (4) и (5), запишем


где 

Относительная молекулярная масса сухого воздуха при известном 

Рассмотрим влажный воздух как смесь сухого воздуха и водяного пара. Поскольку критическая температура водяного пара равна 374ºС, он как примесь идеального газа к смеси газов, формирующих сухой воздух, рассматриваться не может. Условие, когда фактическая температура меньше критической, является необходимым, но недостаточным для перехода газа в жидкость или твердое состояние. Необходимо также, чтобы его парциальное давление достигло состояния насыщения. Последнее является только функцией температуры, свойств газа и формы поверхности, для которой она рассчитывается. Здесь будет рассмотрен водяной пар, который до момента насыщения можно считать примесью идеального газа.
Уравнение состояния водяного пара можно представить в следующем виде:

где 



где 
Как показывают экспериментальные исследования и расчеты, в диапазоне температур от 0 до 40ºС удельная постоянная водяного пара 
Для вывода уравнения состояния рассмотрим 1 кг влажного воздуха. В нем содержится q кг водяного пара и 



Сухой воздух и водяной пар равномерно распределены по объему влажного воздуха и полностью его занимают. Удельные объемы водяного пара и сухого воздуха соответственно равны


Если обозначить 



Отношение удельных газовых постоянных водяного пара и сухого воздуха

Заменив удельную газовую постоянную водяного пара удельной газовой постоянной сухого воздуха с соответствующим коэффициентом, получим уравнение состояния влажного воздуха
Множитель (1 + 0,608q) в метеорологии относят к температуре, вводя понятие виртуальной температуры
Она всегда не меньше молекулярной, так как влажность может меняться от 0 до насыщающей.
Таким образом, виртуальная температура – это температура, которую должен иметь сухой воздух, чтобы его плотность при том же давлении была равна плотности влажного воздуха.
Плотность влажного воздуха всегда меньше плотности сухого. В некоторых случаях это может служить дополнительным фактором, способствующим развитию свободной конвекции в атмосфере.
Плотность воздуха в каждом месте непрерывно меняется во времени. Кроме того, она сильно меняется с высотой, потому что с высотой меняются также атмосферное давление и температура воздуха. Давление с высотой всегда уменьшается, а вместе с ним убывает и плотность. Температура с высотой по большей части понижается, по крайней мере в нижних 10-15 кматмосферы. Но падение температуры влечет за собой повышение плотности. В результате совместного влияния изменения давления и температуры плотность с высотой, как правило, понижается, но не так сильно, как давление. В среднем для Европы она равна у земной поверхности 1250 г/м3, на высоте 5 км – 735 г/м3, 10 км – 411 г/м3, 20 км – 87 г/м3.
На высотах около 300 кмплотность воздуха имеет порядок величины 10-8 г/м3, т.е. в сто миллиардов раз меньше, чем у земной поверхности. На высоте 500 км плотность воздуха уже 10-9 г/м3,на высоте 750 км – 10-10 г/м3или еще меньше. Эти значения плотности ничтожны по сравнению с приземными. Но все же до высот более 20 тыс. кмплотность воздуха остается значительно большей, чем плотность вещества в межпланетном пространстве.
Если бы плотность воздуха не менялась с высотой, а оставалась на всех уровнях такой же, как у земной поверхности, то для высоты атмосферы получилась бы величина около 8000 м.В самом деле, приземная плотность сухого воздуха при давлении 760 мми температуре 0° равна 1293 г/м3;столб воздуха с этой плотностью должен был бы иметь высоту, очень близкую к 8000 м,чтобы производить такое же давление, какое производит столб ртути в 760 мм высотой (1033 г/см3).Указанная высота (8000 м)называется высотой однородной атмосферы. В действительности плотность воздуха с высотой убывает, и потому истинная высота атмосферы равняется многим тысячам километров.
Первое начало термодинамики для атмосферы
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ В АТМОСФЕРЕ
Первое начало термодинамики для атмосферы
Атмосфера представляет собой воздушную среду, в которой постоянно осуществляется переход энергии из одного вида в другие. Раздел метеорологии, рассматривающий общие закономерности преобразования энергии и изменения состояния атмосферы под влиянием притока тепла называется термодинамикой атмосферы.
В этом разделе широко используются выводы, вытекающие из первого начала термодинамики или закона сохранения энергии:
ü Невозможно возникновение или уничтожение энергии, возможен лишь переход одних видов энергии в другие.
Количественно это положение выражается в виде
уравнения первого начала термодинамики или
уравнения притока тепла.
Для вывода этого уравнения выделим в атмосфере частицу сухого воздуха единичной массы. К характеристикам, определяющим состояния этой частицы относятся рi, ρi,Ti, а к характеристикам, определяющим состояние окружающего эту частицу воздуха ре, ρе, Те.
В силу малой скорости движения частицы (по сравнению со скоростью звука), можно ввести допущение, что между характеристиками окружающего воздуха и выделенной частицы выполняются квазистатические условия, т. е.: рi = pe= p.
Рассмотрим изменение характеристик выделенной частицы при получении этой частицей количества тепла, равного dg. Это количество тепла будет израсходовано на увеличение внутренней энергии и
совершение работы на увеличение объема, занимаемого данной частицей.
В этом случае ее внутренняя энергия увеличится на du и совершится работа dw против внешних сил давления на увеличение объема:
Для идеального газа, к которому можно отнести и сухой и влажный ненасыщенный воздух, изменение внутренней энергии частицы справедливо выражение:
где cv — удельная теплоемкость сухого воздуха при постоянном объеме (v = const). Работа по расширению объема частицы определяется из выражения:
где dvi– приращение объема частицы.
С учетом полученных выражений (3.2) и (3.3) уравнение первого начала термодинамики для выделенного объема воздуха примет вид:
После преобразования выражения (3.4) получим:
Для изобарического процесса (dр = 0) выражение (3.7) примет вид:
Для данного вида процесса справедливо выражение:
где ср — удельная теплоемкость воздуха при постоянном давлении.
Соотношение (3.11) носит название уравнения Майера.
Для сухого воздуха: cv = 718 Дж/кг К, а сp = 1006 Дж/кг К,

Подставим (3.10) в (3.7), тогда с учетом (3.5) получим
уравнение первого начала термодинамики:
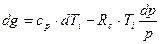
3.2. Адиабатический процесс
Термодинамический процесс называется адиабатическим, если он протекает без теплообмена частицы с окружающей средой.
При адиабатическом процессе dg = 0. Для такого процесса уравнения
(3.4) и (3.14) принимают вид:

Уравнение (3.15) показывает, что при адиабатическом процессе работа против внешних сил давления совершается только за счет внутренней энергии.
При этом, если работа положительная, т.е. направленная на расширение объема (dvi > 0), то внутренняя энергия частицы уменьшается (dТi 0), ее внутренняя энергия растет (dТi > 0).
При подъеме частицы объем ее увеличивается (dvi > 0), а давление падает (dр
Подставим (3.19) в (3.17) и после сокращения запишем:

Разделим выражение (3.20) на выражение (cp · dz):

Полученное выражение (3.21) определяет изменение температуры воздушной частицы, отнесенное к единице высоты при адиабатическом процессе.
ü Данное выражение показывает, что при адиабатическом подъеме воздушной частицы температура ее всегда падает
Это связано с тем, что при подъеме воздушной частицы происходит расход внутренней энергии на работу расширения.
Сухоадиабатическимградиентом 

Подставим (3.22) в (3.21) и получим:

Для реальной атмосферы 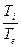
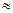
градиент для реальной атмосферы – величина постоянная (const).

Приближенно можно считать, что температура адиабатически поднимающейся воздушной частицы падает примерно на один градус при подъеме на каждые 100 м высоты.
Изменение с высотой температуры адиабатически поднимающейся воздушной частицы графически изображается в осях координат – температура – высота, в виде прямой линии. Она называется сухоадиабатой или кривой состояния сухой воздушной частицы.
3.4. Потенциальная температура
Потенциальной температурой ( 
Приближенное выражение для расчета потенциальной температуры имеет вид:

где р0 – давление воздуха на поверхности Земли;
Тi – температура воздуха на исходной поверхности;
z – расстояние перемещения частицы по вертикали.
В выражении (3.25) последнее слагаемое правой части представляет собой изменение температуры частицы при перемещении ее от поверхности Земли до уровня 1000 гПа.
Если давление воздуха у поверхности Земли менее 1000 гПа, то уровень 1000 гПа лежит ниже поверхности Земли. Поэтому при дополнительном перемещении частицы от поверхности земли до уровня 1000 гПа частица нагревается.
Потенциальная температура обладает важными свойствами.
§ При сухоадиабатическом перемещении частицы ее потенциальная температура сохраняет постоянное значение, хотя ее температура (как степень нагретости) изменяется.
Это свойство сохранения (консервативности) потенциальной температуры используется в качестве характеристики воздушных масс и оценки их вертикальных перемещений.
§ Если при перемещении частицы ее потенциальная температура изменилась, то это свидетельствует о притоке, либо оттоке тепла.
Другим свойством потенциальной температуры является ее связь с полной энергией воздушной частицы.
§ При адиабатическом перемещении частицы ее полная энергия не изменяется.
3.5. Критерии устойчивости атмосферы на основе метода частицы
Распределение температуры окружающего частицу воздуха в различных слоях атмосферы характеризуется вертикальным градиентом температуры
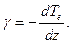
Распределение температуры и других метеорологических величин по высоте называется стратификацией атмосферы.
Для определения устойчивости к движению воздуха выделим в атмосфере воздушную частицу единичного объема. Характеристикой изменения температуры частицы является сухоадиабатический градиент 
При вертикальном движении частицы возможны три случая с разными соотношениями между вертикальным и сухоадиабатическим градиентами.
Первый случай: 


При 



Второй случай: 


Термическое состояние атмосферы в этом случае при 
Третий случай: 
Температура и теплота
Содержание:
Температура — это физическая величина, которая характеризует тепловое состояние тела. Так, температура горячей воды выше, чем холодной; зимой температура воздуха на улице ниже, чем летом.
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Температура и теплота
Температура и теплота — это внутренняя энергия термодинамической системы которая может изменяться двумя способами: посредством совершения работы над системой и посредством теплообмена с окружающей средой. Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется коли́чеством теплоты́ или просто теплотой.
Температура — это физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Теплота — это одна из основных термодинамических величин в классической феноменологической термодинамике. Количество теплоты входит в стандартные математические формулировки первого и второго начал термодинамики.
Тепловое равновесие
Про тело, у которого все свойства остаются неизменными, мы говорим: состояние тела не меняется. Напротив, при изменении какого-либо свойства тела меняется его состояние. Состояние тела можно изменить, совершая над ним работу. Однако возможно достигнуть таких же результатов и немеханическим путем. Вода нагреется как после интенсивного перемешивания, так и после поднесения к ней газовой горелки. Если внешняя среда или окружающие тела воздействуют на рассматриваемое тело или систему тел и меняют состояние этого тела или системы тел немеханическим путем, то говорят о теплообмене.
Если теплообмен между телами отсутствует, то тела находятся в тепловом равновесии, имеют одинаковую температуру. Если тела соприкасаются друг с другом, то наличие теплового равновесия обнаруживается непосредственно: состояния тел длительно остаются теми же. Теплообмен возможен и в случае далеких друг от друга тел. Обнаружить тепловое равновесие в этом случае можно при помощи третьего тела, которое играет роль термометра. Если термометр находится в равновесии с обоими телами, то температура этих тел одинакова. Это значит, что и при непосредственном соприкосновении они находились бы в состоянии теплового равновесия. При помощи «третьего тела», термометра, всегда можно сказать, обладают ли тела разными или одинаковыми температурами.
При помощи термометра можно не только устанавливать наличие или отсутствие теплового равновесия, но можно и судить о степени отклонения от равновесия. Чтобы термометр мог служить этой цели, нужно условиться о веществе термометра (ртуть, спирт, вода, газ) и о свойстве (признаке), по которому мы будем судить о достижении или отклонении от теплового равновесия предмета с термометром. Как и всегда в физике, важно условиться, какие приборы, в данном случае термометры, должны быть положены за основу. Далее всегда можно проградуировать любой термометр по эталонному. В качестве эталонного вещества для термометра берется газообразный водород. Признак, по которому судят о температуре, — это давление газа 
Выбор шкалы температур производится следующим образом. Температура тающего льда называется 0°, температура кипящей воды 100° (при давлении 760 мм ртутного столба). Измеряя давление водорода 
Прямая линия пересекает ось 

Градуирование рабочих термометров по эталонному водородному может производиться в ограниченном интервале температур. При высоких температурах может начаться диффузия водорода через стенки сосуда. При низких температурах водород может превратиться в жидкость. Тем не менее принятое определение температуры имеет совершенно общий смысл, как будет видно ниже (стр. 141).
Внутренняя энергия
Основные черты поведения тел при механическом и тепловом взаимодействии превосходно отражает так называемая молекулярно-кинетическая модель. Состоящее из молекул тела расматриваеться как система движущихся и взаемодействующих частиц,поднимающаяся законом механики. Такая система молекул должна обладать энергией, складывающейся из потенциальной энергии движения частиц. Эту энергию и называют внутренней энергией тела.
Определенному, состоянию тела соответствует определенная внутренняя энергия. Изменения взаимного расположения или характера движения частиц связаны с изменением внутренней энергии. Каким бы способом ни менялась внутренняя энергия тела, окружающие тела должны передать энергию молекулам рассматриваемого тела. Если тело подвергается механическому воздействию, то передача энергии происходит упорядоченным образом; при тепловом обмене энергия передается со стороны среды путем случайных импульсов, передаваемых то одной, то другой молекуле.
Количество энергии, переданной телу механическим путем, измеряется величиной произведенной над телом работы. Количество энергии, переданной при теплообмене, измеряется количеством тепла.
Так как строгий подсчет внутренней энергии тела затруднителен, а большей частью и невозможен, и так как само представление о внутренней энергии как о чисто механической величине является лишь приближением, то надо ввести строгое определение этой величины. Это удается сделать, изучая процессы,_ происходящие без теплообмена с окружающей средой. Такие явления называют адиабетическими. Производя опыт внутри теплоизолирующей обо-лочки и ограничивая измерения краткими сроками (пока тепло не успело «уйти» из изучаемого объема), удается вполне точно осуществить адиабатические условия. Многочисленные опыты, приведшие в свое время к установлению закона сохранения энергии, показывают, что каким бы путем ни изменялось в таком процессе состояние тела, на это потребуется одна и та же работа, Величина этой работы А по определению приросту внутренней энергии тела
Абсолютное значение внутренней энергии, разумеется, не может быть найдено из опыта.
Если бы механическая модель тела была вполне точна, то утверждение, записанное выше, являлось бы простым следствием закона сохранения механической энергии. Однако молекулярно-кинетиче-ская модель есть только модель, и поэтому тот факт, что каждому состоянию тела можно сопоставить определенную энергию, так что разность энергий двух состояний равна адиабатической работе перехода, является важнейшим законом природы, приводящим к закону сохранения энергии.
Теплообмен и механическое воздействие могут приводить в ряде случаев к одинаковому изменению состояния, т. е. к одинаковым изменениям внутренней энергии тела. Это дает нам возможность сравнивать тепло и работу и измерять количество тепла в тех же единицах, что работу и энергию.
Для представления о величинах внутренней энергии приведем следующие цифры.
При нагревании воды на 1° энергия 1 г воды возрастает на
При этом одна молекула воды увеличивает в среднем свою энергию на
При сгорании 1 г угля вещество отдает внутреннюю энергию в количестве
При расчете на один атом углерода эти цифры примут вид
При ядерном делении 1 г урана-235 выделяется энергия
Одно атомное ядро отдает при этом внутреннюю энергию в количестве
что более чем в 50 миллионов раз превышает энергию химических реакций
Первое начало термодинамики
В самом общем случае, обмениваясь энергией со средой или окружающими телами, рассматриваемая система может получать или отдавать количество тепла 
Это утверждение нельзя было бы подвергнуть опытной проверке, если бы мы не добавили, что прирост энергии при переходе системы от одного состояния к другому всегда один и тот же вне зависимости от характера или способа перехода от начального состояния к конечному. Принцип сохранения энергии заключен именно в последнем утверждении. Его-то мы, несомненно, можем подвергнуть .всесторонней экспериментальной проверке, измеряя сообщенные системе теплоту и работу в различных переходах от одного и того же начального к одному и тому же конечному состоянию. Прирост энергии во всех случаях должен быть одним и тем же.
Закон сохранения энергии, выраженный в приведенной конкретной форме, носит название первого начала термодинамики. Этот важнейший закон природы был установлен работами ряда ученых в середине прошлого столетия. Роль Роберта Майера, Джоуля и прежде всего Гельмгольца следует оценить особенно высоко.
Для записи первого начала термодинамики в виде формулы надо условиться о выборе знака для теплоты и работы. Мы примем, что теплота положительна тогда, когда она сообщается системе, а работу будем считать положительной тогда, когда тело совершает ее против действия внешних сил. Тогда первое начало термодинамики запишется в виде
т. е. подведенное телу тепло идет на изменение внутренней энергии и на произведенную телом работу. Разумеется, мыслимы любые превращения, при которых каждая из входящих в равенство величии может быть положительной и отрицательной.
Не случайно в записи первого начала знак дифференциала использован только для энергии. Работа и тепло не являются полными дифференциалами. При переходе тела из одного состояния в другое величины работы и тепла, полученные или отданные телом, будут зависеть от «пути» перехода, и лишь прирост энергии, как это имеет место для полного дифференциала какой-либо функции, не зависит от способа перехода:
Применение закона сохранения энергии и, в частности, первого начала термодинамики охватывает все разделы физики. Ценность его для науки заключается в исключительной предсказательной силе. Не имея каких бы то ни было сведений о характере процесса, зная лишь начальное и конечное состояния системы, можно делать ряд ценных выводов. Пусть, например, проводит химическая реакция присоединения молекулы 








Энергия микроскопических систем
Закон сохранения энергии и правила обмена энергией справедливы, разумеется, как для больших тел, так и для частиц, из которых построены тела. Однако при изучении частиц (атомов, ядер, молекул) или систем, состоящих из небольшого числа частиц, необходимо учитывать еще один важнейший закон природы. Энергия микроскопических систем не может принимать любые значения. Каждая система имеет свою, характерную для нее и только для нее, последовательность возможных значений энергии: 
Строго говоря, закон о квантовом характере энергии, о наличии для каждой микроскопической системы «лестницы» возможных энергетических уровней является вполне общим законом природы, справедливым и для больших тел. Однако, как показывает теоретическая физика, у большого тела число энергетических уровней, грубо говоря, возрастает в п раз, если тело состоит из п атомов.
По мере возрастания энергии, как это видно из рисунка для водорода, уровни располагаются все теснее. Сближение этих уровней происходит у большого тела несравненно быстрее, чем у отдельного атома. Лишь самые низкие, бедные энергией уровни выглядят раздельно. Более высокие уровни сливаются, и практически оказывается, что большое тело может изменять свою энергию непрерывным способом. Если от тела отнимать энергию, то оно «спускается» на более низкие уровни. Квантовый характер изменений энергии проявляется поэтому тем резче, чем ниже температура тела, чем ближе она к абсолютному нулю.
При механическом воздействии энергетические уровни тела или системы смещаются. В подавляющем большинстве случаев проследить за этим смещением не удается. Для микроскопических систем — атомов и молекул — влияние давления очень мало.
Тепловое взаимодействие состоит в переходах системы с одного уровня энергии на другой.
Тепловое равновесие является подвижным равновесием. Каждое тело не имеет все время какую-то одну энергию, а непрерывно обменивается энергией со средой так, что в среднем энергия остается неизменной. Обмен энергией происходит порциями — квантами. Если в какой-то момент энергия равна 
Энергия отдается в виде излучения. Если


Если температура не остается постоянной, а падает, то число переходов на нижние уровни с верхних подавляет обратные переходы. Энергия снижается скачками, тело отдает один квант излучения за другим.
Схематически описанные явления энергетического обмена были установлены вначале для атомов. Несколько позже стал очевидным вполне универсальный характер этой картины. Мы ограничимся сейчас этими общими замечаниями, отсылая читателя к ч. 
Уравнение состояния
Среди разнообразных свойств тела можно выделить три основных свойства, или параметра состояния. Это — давление 


Если оставить без внимания электромагнитные поля и ограничиться рассмотрением простейших систем — газов, жидкостей и изотропных твердых тел, то окажется, что всегда лишь два параметра определяют состояние тела. В качестве этих двух параметров одинаково удобно выбрать любую пару из 




Исследуя поведение вещества, довольно часто характеризуют его не уравнением состояния, а производными одних параметров по другим. Чтобы знать, как расширяется тело при неизменном давлении с увеличением температуры, следует вычислить производную 



равен относительному изменению давления при изменении температуры на один градус (при постоянном объеме). Коэффициенты 
Третьей полезной величиной является сжимаемость
равная относительному уменьшению объема при увеличении давления на единицу (при постоянной температуре).
Эти три коэффициента связаны соотношением, которое мы сейчас легко выведем. Так как 



Этот интересный результат показывает, что, зная, скажем, сжимаемость и термический коэффициент давления, можно вычислить значение коэффициента температурного расширения. Выведенное соотношение верно для любых тел.
Коэффициенты 
Вот несколько примеров.
а) Температурный коэффициент расширения а и сжимаемость х некоторых жидкостей:
Для твердых тел коэффициенты температурного расширения и сжимаемости могут сильно различаться. Так, например, при нормальных температуре и давлении плавленный кварц имеет 
б) Для поды, ртути и эфира рассчитаем термический коэффициент давления
Это означает, что при нагревании на 
Уравнение газового состояния
Самым простым уравнением состояния обладают разреженные газы. Это уравнение записал Менделеев, объединив в одной формуле «уравнение Клапейрона и закон Авогадро. Уравнение Клапейрона
Но грамм-молекулы разных газов занимают при одинаковых давлениях и температурах одинаковые объемы (22,41 л при 0 °С и одной атмосфере *)) — закон Авогадро. Следовательно, отнесенная к одному грамм-молю постоянная в уравнении Клапейрона должна иметь универсальное значение. Ее обозначают буквой 


Так как объем произвольной массы газа равен 

Здесь 

Для ряда расчетов может оказаться полезной формула плотности 
Газы, подчиняющиеся уравнению газового состояния, носят название идеальных. Оправданием этому термину была бы уже крайняя простота уравнения, однако мы увидим позже (стр. 169), что это уравнение можно вывести, представляя газ некоторой идеальной моделью, а именно: идеальный газ — это система молекул, силами притяжения и размерами которых можно пренебречь.
Идеальные газы имеют коэффициенты расширения и давления и сжимаемость, выражающиеся следующими простыми формулами:
При температуре
Насколько реальные вещества близки к идеальным, некоторое представление дают следующие числа:
Газообразные вещества, находящиеся при давлениях, существенно превосходящих атмосферное, перестают подчиняться (>юрму-лам идеального газа. Вычисления могут привести к ошибкам в несколько процентов уже при давлениях в несколько десятков атмосфер.
Существенный вывод, к которому можно прийти, изучая поведение разреженных газов, заключается в том, что любой из них, вообще говоря, с тем же успехом, что и водород, мог быть положен в основу определения температуры. Водород ничем не выделяется среди разреженных газов. Можно поэтому сказать, что температурная шкала, принятая в физике,— это не водородная шкала, а шкала давлений идеального газа. Именно это обстоятельство и оправдывает сделанный выбор способа определения температуры: большой класс веществ приводит к температурным шкалам, в точности совпадающим. Молекулярно-кинетическое обоснование выбора температурной шкалы будет дано ниже (стр. 170).
Уравнения состояния реальных газов
Для газов при больших давлениях, для паров, близких к насыщению, и в ряде других случаев уравнение газового состояния начинает давать очень грубые результаты. В этих случаях прибегают к другим уравнениям состояния. Часть из них найдена опытным путем, некоторые (как наиболее известное из них — уравнение Ван-дер-Ваальса) имеют качественное теоретическое обоснование. Так или иначе, ценность того или иного уравнения может быть установлена лишь сравнением чисел, полученных из опыта и вычисленных из уравнения. Приведем примеры уравнений состояния.
Простейшая поправка, которая может быть введена в уравнение идеальных газов,— это, конечно, учет объема газовых молекул. Очевидно, даже бесконечно большим давлением нельзя сжать газ до нулевого объема. Это оправдывает уравнение состояния вида
где 
Чем больше число констант, которые будут введены в уравнение состояния, тем легче добиться хорошего совпадения опытных и рассчитанных чисел. Однако тем меньше предсказательные возможности формул. Не так уж удивительно превосходное совпадение с опытом в широком интервале значений параметров состояния, которое дает формула Бриджмена и Битти, содержащая пять констант 

Три константы 
Две константы 
Достоинства последнего уравнения заключаются в том, что оно правильно передает общий характер зависимости между параметрами для всех газообразных веществ. Однако не удается подобрать для данного вещества такие постоянные значения 
Обоснование уравнения Ван-дер-Ваальса заключается в следующем. Давление удовлетворяет уравнению газового состояния,


Почему же 
Услуги по физике:
Лекции по физике:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://lektsii.org/13-77028.html
http://natalibrilenova.ru/temperatura-i-teplota/










































