Уравнение движения электрона по орбите
Н. Бор (1885-1962) работал в 1912-1913 гг. у Резерфорда, когда тот проводил опыты по рассеянию альфа-частиц, и вернулся в 1913 г. в Копенгаген с множеством новых идей. Отказ от модели атома Томпсона, узкие, дискретные спектральные линии в излучении разрядных трубок, фотоэффект требовали своего объяснения.
М. Планк (1858-1947) первым привлек идею квантования для объяснения наблюдаемого спектрального состава излучения нагретых тел. Ему удалось объяснить спектр, предположив, что гармонические осцилляторы поглощают и излучают лишь дискретные порции энергии hν.
Бор блестяще применил квантовую гипотезу к описанию движения электронов в атомах и спектров излучения. Он отбросил идею о том, что электроны ведут себя подобно осцилляторам, а вместо этого представил динамику атома в виде движения электронов по орбитам вокруг ядра, наподобие движения планет по орбитам вокруг Солнца. Уравнение движения электрона по орбите имеет вид: 

а полная энергия, т.е. сумма кинетической и потенциальной энергий, равна
Эти соотношения следуют из обычных законов механики и электростатики.
Бор, в дополнение к приведенным законам, сформулировал следующие постулаты, составляющие основу квантовой теории атома.
I. Разрешены только такие круговые орбиты, для которых момент импульса равен целому числу в единицах постоянной Планка, деленной на 2p. (Момент импульса тела, движущегося по круговой орбите, равен произведению его массы m на скорость v и радиус орбиты r.) Таким образом,
Хотя, согласно электромагнитной теории, любая заряженная частица, движущаяся с ускорением, должна испускать излучение, электроны не испускают излучения, двигаясь по своим орбитам внутри атома. Излучение возникает только при переходе электрона с одной квантованной орбиты на другую.
III. Частота этого излучения определяется изменением полной энергии, т.е. разностью энергий атома в начальном и конечном состояниях: hn = E2 — E1.
Эти условия квантования энергии приводят к дискретным орбитам электронов. Решая уравнение относительно скорости и подставляя полученное значение, получаем

или, если ввести «боровский радиус»:
Энергии состояний атома, отвечающих каждому целому значению n, также квантованы:
Используя третий постулат Бора и соотношение с = λν между скоростью, длиной волны и частотой, можно объяснить эмпирическую формулу, найденную Бальмером для его серии линий как частный случай формулы Бора:

Таким образом, модель атома Бора позволила дать не только качественное, но и количественное объяснение линий водородного спектра.
Уравнение движения электрона по орбите
| Элементарная теория Бора |   |
Выход из тупика был найден датским ученым Нильсом Бором в 1913 году, получившим Нобелевскую премию в 1922 году.
Бор высказал предположения, которые были названы постулатами Бора. · Первый постулат(постулат стационарных состояний): электроны движутся только по определенным (стационарным) орбитам. При этом, даже двигаясь с ускорением, они не излучают энергию. · Второй постулат(правило частот): излучение и поглощение энергии в виде кванта света (hn) происходит лишь при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается скачок электрона: Отсюда следует, что изменение энергии атома, связанное с излучением при поглощении фотона, пропорционально частоте ν:
Правило квантования орбит: из всех орбит электрона возможны только те, для которых момент импульса равен целому кратному постоянной Планка:
где n = 1, 2, 3,… – главное квантовое число. Получим выражение для энергии электрона в атоме. Рассмотрим электрон (рис. 6.6,а), движущийся со скоростью
Уравнение движения электрона имеет вид:
Из формулы (6.3.3) видно, что центробежная сила равна кулоновской силе, где Подставим значение υ из (6.3.2) в (6.3.3) и получим выражение для радиусов стационарных орбит (рис.6.6,б):
Радиус первой орбиты водородного атома называют боровским радиусом. При n =1, Z = 1 для водорода имеем: Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и потенциальной энергией взаимодействия электрона с ядром: Из уравнения движения электрона следует, что Подставим сюда выражение для радиуса первой орбиты и получим:
Здесь учтено, что постоянная Планка Для атома водорода при Z = 1 имеем:
Из формулы (6.3.6) видно, что Схема энергетических уровней, определяемых уравнением (6.3.6) показана на рис. 6.1 и 6.7. При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией: Получена обобщенная формула Бальмера, которая хорошо согласуется с экспериментом. Выражение перед скобками, как уже было сказано, носит название постоянной Ридберга: Серьезным успехом теории Бора явилось вычисление постоянной Ридберга для водородоподобных систем и объяснение структуры их линейчатых спектров. Бору удалось объяснить линии спектра ионизованного гелия. Он теоретически вычислил отношение массы протона к массе электрона Однако, наряду с успехами, в теории Бора с самого начала обнаружились существенные недостатки. Главнейшим из них была внутренняя противоречивость теории: механическое соединение классической физики с квантовыми постулатами. Теория не могла объяснить вопрос об интенсивностях спектральных линий. Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров атома гелия, содержащего два электрона на орбите и тем более для многоэлектронных атомов (рис. 6.8). Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и правильной теории. Такой теорией и явилась квантовая механика. Постулаты Бора. Опыты Франка и Герца.Первая попытка создать новую – квантовую – теорию ядра была осуществлена Н. Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу новой теории Бор положил два постулата. Первый постулат Бора (постулат стационарных состояний). В атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные круговые орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон имеет дискретные значения момента импульса, удовлетворяющие условию где Второй постулат Бора (правило частот). При переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией где Существование дискретных энергетических уровней атома подтверждается опытами Франка и Герца. Схема их установки приведена на рис. 19.1 В трубке, заполненной парами ртути под небольшим давлением ( 1 мм рт. ст.), имелись три электрода: катод К, сетка С и анод А. Термоэлектроны, вылетевшие из катода, ускорялись разностью потенциалов U, приложенной между катодом и сеткой. Между сеткой и анодом создавалось слабое электрическое поле (разность потенциалов порядка 0,5 В), тормозившее движение электронов к аноду. В опыте исследовалась зависимость силы тока I в цепи анода от напряжения U между катодом и сеткой. Характерная для таких опытов вольтамперная характеристика приведена на рис.19.2. Ход кривой можно объяснить следующим образом. При столкновении электрона с атомами ртути возможно взаимодействие двух типов: 1) упругое столкновение, в результате которого энергия электронов практически не изменяется, изменяется только направление движения; 2) неупругое столкновение электрона с атомом ртути. При этом энергия электронов уменьшается, за счет передачи ее атому ртути. В соответствии с постулатами Бора атом ртути может поглотить энергию в виде порции Атомы паров ртути, получив энергию от электронов, переходят в возбужденное состояние, из которого спустя 10 –8 с самопроизвольно возвращаются в основное состояние. При этом должен излучается фотон с длинной волны l»255 нм. В опыте действительно обнаруживается одна ультрафиолетовая линия с такой длиной волны. Таким образом, опыты Франка и Герца экспериментально подтверждают постулаты Бора. Теория водородоподобного атома по Бору. Постулаты Бора позволяют рассчитать спектр атома водорода и водородоподобных ионов, состоящих из ядра Ze и одного электрона, и теоретически вычислить постоянную Ридберга. Рассмотрим движение электрона в поле атомного ядра. Уравнение движения электрона имеет вид Исключив v из уравнений (19-4) и (19-6), получим выражение для радиусов допустимых орбит Для атома водорода (Z=1) радиус первой орбиты называется боровским радиусом. Его значение равно Полная энергия электрона в водородоподобном атоме складывается из его кинетической энергии и потенциальной энергии взаимодействия с ядром (при ее получении использована формула (19-6)). Учитывая квантование радиусов (19-7), получим, что энергия электрона принимает дискретные значения Согласно второму постулату Бора при переходе атома водорода из состояния n в состояние m излучается фотон откуда частота излучения Таким образом, теория Бора приводит к обобщенной формуле Бальмера, причем для постоянной Ридберга получилось значение Теория Бора была крупным шагом в развитии теории атома. Она отчетливо показала, что процессы в микромире описываются не классическими, а иными, квантовыми законами. источники: http://ens.tpu.ru/POSOBIE_FIS_KUSN/%D0%9A%D0%B2%D0%B0%D0%BD%D1%82%D0%BE%D0%B2%D0%B0%D1%8F%20%D0%BE%D0%BF%D1%82%D0%B8%D0%BA%D0%B0.%20%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D0%B0%D1%8F%20%D0%B8%20%D1%8F%D0%B4%D0%B5%D1%80%D0%BD%D0%B0%D1%8F%20%D1%84%D0%B8%D0%B7%D0%B8%D0%BA%D0%B0.%20%D0%A4%D0%B8%D0%B7%D0%B8%D0%BA%D0%B0%20%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%80%D0%BD%D1%8B%D1%85%20%D1%87%D0%B0%D1%81%D1%82%D0%B8%D1%86/06-3.htm http://helpiks.org/3-16916.html |








 .
. или
или  .
. ,
, в поле атомного ядра с зарядом Ze (при Z = 1 – атом водорода).
в поле атомного ядра с зарядом Ze (при Z = 1 – атом водорода).

 .
. .
. .
. Å = 0,529·10 –10 м.
Å = 0,529·10 –10 м. .
. , т.е. кинетическая энергия равна потенциальной. Тогда можно записать:
, т.е. кинетическая энергия равна потенциальной. Тогда можно записать: .
. .
. , т.е.
, т.е.  .
. .
. принимает только дискретные значения энергии, т.к. n = 1, 2, 3….
принимает только дискретные значения энергии, т.к. n = 1, 2, 3….

 .
. .
. .
. , что находилось в соответствии с экспериментом, является важным подтверждением основных идей, содержащихся в его теории. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913–1925) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.
, что находилось в соответствии с экспериментом, является важным подтверждением основных идей, содержащихся в его теории. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913–1925) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.
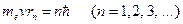 , (19-4)
, (19-4) – масса электрона, v – его скорость по n-й орбите радиуса
– масса электрона, v – его скорость по n-й орбите радиуса 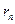 .
.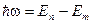 , (19-5)
, (19-5)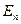 и
и 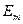 – соответственно энергии стационарных состояний атома до и после излучения (поглощения). Набор возможных дискретных частот
– соответственно энергии стационарных состояний атома до и после излучения (поглощения). Набор возможных дискретных частот 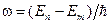 квантовых переходов и определяет линейчатый спектр атома.
квантовых переходов и определяет линейчатый спектр атома.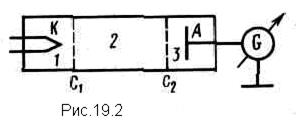
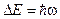 и перейти в возбужденное состояние на выше расположенный энергетический уровень. Первому возбужденному состоянию атома ртути соответствует энергия 4,9 эВ. При U
и перейти в возбужденное состояние на выше расположенный энергетический уровень. Первому возбужденному состоянию атома ртути соответствует энергия 4,9 эВ. При U . (19-6)
. (19-6)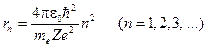 . (19-7)
. (19-7)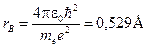 . (19-8)
. (19-8)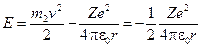
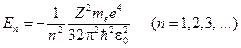 . (19-9)
. (19-9) ,
,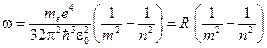 .
.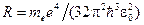 . При подстановке в это выражение значений универсальных постоянных получается величина, превосходно согласующаяся с экспериментальным значением постоянной Ридберга.
. При подстановке в это выражение значений универсальных постоянных получается величина, превосходно согласующаяся с экспериментальным значением постоянной Ридберга.