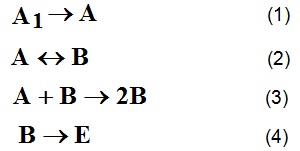Уравнение Джонсона — Мела — Аврами — Колмогорова
Связанные понятия
Согласно концепции переме́нной ско́рости све́та (ПСС) считается, что скорость света в вакууме, обычно обозначаемая c, в некоторых случаях может не быть константой. В большинстве ситуаций в физике конденсированного состояния распространение света в среде действительно происходит с меньшей скоростью, чем в вакууме. Кроме того, в некоторых расчётах квантовой теории поля необходимо учитывать, что виртуальные фотоны должны двигаться на короткие расстояния в том числе со скоростью, отличной от скорости.
M-тео́рия — современная физическая теория, созданная с целью объединения фундаментальных взаимодействий. В качестве базового объекта используется так называемая «брана» (многомерная мембрана) — протяжённый двухмерный или с бо́льшим числом измерений (n-брана) объект.
Метод ренормализационной группы (также часто называемый методом ренормгруппы, методом РГ) в квантовой теории поля — итеративный метод перенормировки, в котором переход от областей с меньшей энергией к областям с большей вызван изменением масштаба рассмотрения системы.
КИНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ СТРУКТУРООБРАЗОВАНИЯ В ВЯЖУЩИХ СИСТЕМАХ
М.С. Гаркави
Магнитогорский государственный технический университет им. Г.И. Носова
При твердении вяжущих систем происходит смена различных структур твердения, начиная с истинно коагуляционной и кончая конденсационно‑кристаллизационной. Этот процесс проходит через ряд промежуточных состояний, т. е. все структурные состояния характеризуются преобладанием в них межчастичных контактов с определенной интенсивностью взаимодействия. Исходя из этого, структурообразование в вяжущих дисперсиях ‑ это процесс формирования межчастичных контактов различного типа и, соответственно, прочности.
Согласно [ 1 ], любые термодинамические процессы, в том числе и структурообразование, могут быть выражены в терминах химических реакций, поэтому представим изменение структурного состояния вяжущей системы в виде следующих квазиреакций:
где A1 ‑ точечные контакты в исходном вяжущем; A ‑ коагуляционные контакты; B ‑ коагуляционно‑конденсационные контакты; E ‑ конденсационно‑кристаллизационные контакты.
Реакция (1) описывает образование истинных коагуляционных контактов при смешении вяжущего вещества с жидкостью затворения ( водой ). Эти контакты образуются практически мгновенно в результате объединения частиц в единую систему через поляризованные жидкие оболочки. Вяжущая дисперсия при этом представляет собой периодическую коллоидную структуру (ПКС‑1), в которой частицы зафиксированы во вторичном потенциальном минимуме [2].
Эта реакция представляет собой обычную реакцию первого порядка, кинетика которой описывается уравнением
где A( t ) ‑ концентрация коагуляционных контактов в момент времени t; A0 ‑ то же в момент времени t = 0; A01 ‑ концентрация точечных контактов в исходном вяжущем; k1 ‑ константа скорости реакции (1).
Очевидно, что в момент времени t = 0 Ao= 0 и уравнение (5) имеет вид:
т. е. процесс образования коагуляционных контактов описывается экспоненциальной зависимостью ( рис.1).
Количество образующихся контактов зависит от длительности процесса смешивания и константы скорости процесса. Последняя же определяется соотношением между твёрдой и жидкой фазами в вяжущей дисперсии и интенсивностью процесса перемешивания [3].
В пределе число образующихся коагуляционных контактов стремится к величине A01, т. е. идеальная вяжущая дисперсия представляет собой систему, в которой все частицы окружены жидкими оболочками. Согласно [4], эта величина определяется соотношением
где xo ‑ расход вяжущего на единицу объёма дисперсии; so ‑ удельная поверхность вяжущего; gx ‑ плотность частиц вяжущего; mx = 6…10 ‑ коэффициент конфигурации частиц.
Для вяжущих типа гипса и цемента с удельной поверхностью so=300 м 2 / кг число коагуляционных контактов составляет порядка 10 8 в единице объёма системы. Поскольку вследствие химической реакции возрастает как число частиц, так и их удельная поверхность, то очевидно, что число контактов в единице объёма будет значительно больше.
Переход коагуляционных контактов в промежуточные коагуляционно‑конденсационные по реакции (2) связан с увеличением в системе количества твёрдой фазы и соответствующего изменения соотношения Т / Ж, а также с наличием на поверхности частиц особых гелеобразных плёнок с упорядоченной структурой [2, 3]. Это превращение можно рассматривать как образование псевдоконденсационной структуры, контакты в которой при оводнении могут разрушаться [5], поэтому в реакции (2.21) предусмотрено обратимое её развитие. Следует отметить, что эта обратимость относительна, так как восстанавливающаяся после разрушения структура не может быть равнозначна структуре до разрушения.
Кинетика образования коагуляционно ‑ конденсационных контактов по реакции (2) описывается уравнением:
где Aо и Во ‑ исходные концентрации коагуляционных и коагуляционно‑конденсационных контактов соответственно; k2 и k3 ‑ константы скорости прямой и обратной реакций;
Из уравнения (8) следует, что при k2> k3 образование коагуляционно-конденсационных контактов описывается экспоненциальной зависимостью (рис. 2).
Согласно приведенному уравнению, предел, к которому стремится количество коагуляционно‑конденсационных контактов, зависит от соотношения констант скоростей прямой и обратной реакций. Если же обратная реакция отсутствует, что соответствует закрытой системе, которая не взаимодействует с окружающей средой, то уравнение (8) превращается в уравнение, аналогичное (6). Поскольку реакция (2) является линейной, то она имеет одно стационарное состояние, которое всегда устойчиво и соответствует положению равновесия.
Возникшие по реакции (2) коагуляционно‑конденсационные контакты стимулируют своё «размножение» вследствие взаимодействия с имеющимися коагуляционными контактами и их уничтожения. Этот процесс описывается автокаталитической реакцией (3), т. е. в вяжущей системе реализуется механизм положительной обратной связи [6]. Это связано с тем, что для плёночных гелей характерен процесс спонтанной поляризации молекул воды и их ориентации, что обеспечивает сильное межчастичное взаимодействие и фиксацию частиц в промежуточном потенциальном минимуме [2,7]. Кроме того, образование коагуляционно‑конденсационных контактов связано с возникновением между частицами контактных зародышей по принципу цепных реакций [4,8].
Образующаяся по реакции (3) коагуляционно-конденсационная структура обладает ярко выраженной индивидуальностью, что не позволяет однозначно определить, ближе ли она по своим свойствам к твёрдым телам или к коагуляционным системам [3]. Эта структура образуется за счёт «уничтожения» предшествующей коагуляционной структуры, т. е. её возникновение носит деструктивный характер [9]. Коагуляционно‑конденсационные контакты служат основой для образования конденсационно‑кристаллизационных контактов по реакции (4), поэтому в совокупности реакции (3) и (4) представляют собой автокаталитический процесс с разветвлением [6,8].
Кинетика образования коагуляционно‑конденсационных контактов по реакции (3) описывается уравнением
где k4 ‑ константа скорости реакции.
Поскольку в вяжущей системе нет постоянного притока вещества (система является закрытой), то в ней наступает насыщение, соответствующее предельному количеству коагуляционно‑конденсационных контактов (рис. 3). Стабилизация этой структуры представляет собой характерный нелинейный эффект ‑ формирование нелинейной временной структуры (диссипативной структуры) [10].
Интенсивность катализа в значительной степени зависит от скорости переноса в системе. При недостаточной скорости наблюдается так называемый эффект диффузионного ингибирования автокаталитического процесса, который связан с его локальной природой. Применительно к процессу структурообразования он заключается в том, что коагуляционно‑конденсационные и особенно конденсационные контакты с большей вероятностью возникают в том месте, где частицы зафиксированы в промежуточном потенциальном минимуме и где имеются зародышевые контакты [11]. В результате возникает возможность образования структурных кластеров, причём так как подвижность частиц в вяжущей системе практически отсутствует [3], автокаталитическая реакция (3) развивается по типу фазового превращения, и кластеры будут увеличиваться в размерах. Таким образом, исходя из модельной автокаталитической квазиреакции образования коагуляционно‑конденсационных контактов, можно сделать вывод, что этот процесс связан с возникновением в вяжущей системе структурных кластеров, что согласуется с [12]. Следует также отметить, что ингибирование является, наряду с автокатализом, тем механизмом процесса, который приводит к бистабильности вяжущей системы. Последнее же, в соответствии с [13,14], служит предпосылкой для развития в системе колебательных процессов.
Изменение структурного состояния твердеющей системы характеризуется обобщённой термодинамической координатой ‑ степенью завершённости структурообразования h [15]. Её использование позволяет описать кинетику структурообразования, обобщённым уравнением Аврами ‑ Ерофеева - Колмогорова [6], следовательно, для изменения степени завершённости структурообразования можно записать:
где kh ‑ константа скорости структурообразования; n ‑ кинетический коэффициент, зависящий от природы образующихся межчастичных контактов.
Уравнение (10) представляет собой обобщённое кинетическое уравнение процесса структурообразования, хотя применение уравнения Аврами ‑ Ерофеева ‑ Коломогорова не позволяет однозначно судить о механизме процесса. Следует заметить, что в данном случае рассматривается изменение термодинамического параметра, а термодинамический подход вообще не дает возможность раскрыть механизм изучаемого процесса. Поэтому анализ уравнения (10) позволяет установить лишь направление развития процесса структурообразования и оценить термодинамическую устойчивость отдельных его стадий. Так как процесс структурообразования условно разделяется на несколько этапов, то каждому из них будут соответствовать собственные значения константы скорости структурообразования kh и кинетического параметра n.
Из структуры уравнения (10) следует, что рост степени завершённости структурообразования возможен только при n > 0. Возрастание h указывает на преобладание структурообразующих явлений, что соответствует образованию либо коагуляционных процессов, либо конденсационно ‑ кристаллизационных контактов [3,4]. Образование же коагуляционно ‑ конденсационных контактов связано, как показано ранее, с разрушением предшествующей структуры и должно сопровождаться снижением h. Последнее же возможно при n = 1 и n = 1 оно имеет смысл только при малых t, т. е. только в начале развития процесса, поскольку при t > 4 степень завершённости структурообразования h ® 1, что для вяжущих типа портландцемента не соответствует реальности. Поэтому наиболее вероятно, что в таких вяжущих системах положительные значения n меньше 1. Таким образом, наиболее вероятно появление бистабильности в вяжущей системе на той стадии структурообразования, где n
Лекция 9. Расчет кинетических параметров по данным термического анализа
Расчет кинетических параметров по данным термического анализа
Гетерогенные реакции – это реакции, происходящие на границе раздела фаз. К ним относятся реакции типа твердое –твердое, твердое – газ, твердое – жидкость, а также жидкость – газ и некоторые реакции жидкость –жидкость.
Степень превращения – это отношение изменения массы для каждой температуры к максимальному изменению массы в ходе процесса.
Степень превращения (a) позволяет судить о глубине протекания процесса. Степень превращения принимает значения от 0 до 1.
Скорость реакции – это отношение изменения глубины протекания реакции (da) ко времени (dt), необходимого для того, чтобы в системе произошло изменение:

Скорость реакции для открытых систем также связана со скоростью изменения массы (числа молей) во времени. Полное изменение массы в системе за время dt равно массе, приобретенной этой системой извне или потерянной, независимо от числа одновременно протекающих в системе реакций.
Если в системе газ ‑ твердое имеется возможность поддерживать постоянным парциальное давление газообразных компонентов, удобнее работать в открытых системах. Тогда твердый реагент всегда является лимитирующим и степень превращения достаточно легко определить и использовать в расчетах.
Для реакций в открытой системе закон сохранения массы будет сформулирован так: полное изменение массы в системе за время dt равно количеству вещества, поступившему в систему или удаленному из системы за то же время. Поэтому за такими реакциями легко следить при термическом анализе с помощью термовесов, которые регистрируют изменением массы во времени.
Энергия активации относится к фундаментальным характеристикам любого процесса. В газовой фазе – это энергия, необходимая для эффективного столкновения реагентов с образованием 1 моля продукта.
Для расчета энергии активации можно исходить из экспериментально наблюдаемой экспоненциальной зависимости скорости реакции от температуры:

Кинетические исследования включают два этапа:
1) экспериментальное определение степени превращения или скорости реакции в зависимости от условий реакции и математическое описание этой зависимости;
2) оценку кинетических параметров и их интерпретацию в соответствии с природой происходящих процессов.
Характерной особенностью твердофазных реакций является локализация реакционной зоны на поверхности раздела фаз. Общая поверхность и толщина реакционной зоны могут быть различны и зависят как от природы исследуемого процесса, так и от условий его проведения.
Методы установления макрокинетических и термохимических характеристик по дериватограмме
В настоящее время существует обширная литература по методам обработки данных, полученных при дифференциально-термическом (DТА) и термографическом (TG) анализах. Для расчета кинетических параметров используются экспериментальные данные, полученные из кривых DТА-Т и DТА-TG-Т. При рассмотрении термораспада исходят из уравнения Аррениуса, связывающего скорость процесса с температурой

где К — константа процесса;
A — предэкспоненциальный множитель;
E – энергия активации;
R – универсальная газовая постоянная;
T – температура протекания процесса
Принцип расчета кинетических параметров при использовании термографического анализа
Уравнение (1) в дифференциальной форме имеет вид

где 
a — степень превращения;
E, R, Т — энергия активации, газовая постоянная, температура (К) соответственно.
Уравнение (2) можно преобразовать к виду

Практика показывает, что часто можно довольно определенно указать вид функции f(a), наилучшим образом описывающий экспериментальные данные. Задавая различные виды f(a), можно получить:
1) уравнение 1-го порядка:

2) уравнение Рогинского — Шульц — Тодеса — Мампела:

3) уравнение Проута — Томкинса:

4) уравнение Колмогорова-Ерофеева-Аврами

Можно подобрать уравнение, которое в координатах 
Опыт показывает, что для уравнения термораспада приемлемо уравнение 1-го порядка (4). Графическая интерпретация экспериментальных данных в соответствии с уравнением (4) в координатах 
Для облегчения расчета и его большей точности рекомендуется после предварительного термографического анализа вещества и первичной обработки данных (рисунок 1) произвести повторный анализ с укрупненной съемкой тех участков, которые подлежат расчету. Для этого при сохранении режима работы прибора при повторном исследовании барабан (самописец) включают только при достижении заданной температуры, а скорость его вращения программируют так, чтобы нужный температурный интервал при той же скорости нагрева укладывался участок в интервале температур 150 — 275 °С. При съемке самописец следует включать при достижении температуры в печи на 20‑40° ниже заданной (110 — 130 °С). При скорости нагрева печи υ = 5 град/мин для полной съемки участка понадобится 
Рисунок 1 – Образец рабочей термограммы
Расчет кинетических параметров по данным DTG—TG—T
При расчете кинетических параметров из данных термогравиметрического анализа (кривые TG, DTG и Т на рисунке 2) на кривой температур Т в рассматриваемом интервале (t0—tn) отмечают точки ее пересечения с градуировочными горизонталями (t0, t1. tn). Удобен интервал между точками 5 или 10°. Обозначив нулевые линии для кривых TG и DTG, разбивают обе кривые на участки соответственно обозначенным температурам. Для этого через точки t0, t1. tn на кривой Т проводят ряд прямых, перпендикулярных нулевым линиям. При этом, на кривой DTG отрезки между нулевой линией и кривой DTG – 1.1, 2.2, …., n. n соответствуют 

Рисунок 2 – Дериватограмма термораспада (ускоренная съемка для обсчета кривых DTG—TG—T)
На кривой TG отрезки между нулевой линией и кривой TG (a1b1, а2b2, . anbn) соответствуют количеству разложившегося вещества – m1, m2. mn. Величину максимального разложения DM определяют из максимального отклонения кривой TG от нулевой линии.
Таблица 1 – Данные термического анализа для расчета кинетических параметров по кривым DTG-TG-T
http://sbcmi.ru/kineticheskie-zakonomernosti-strukturoobrazovaniya-v-vyazhuschih-sistemah/
http://pandia.ru/text/80/204/24012.php