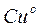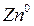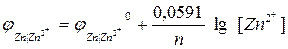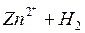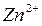Электродный потенциал. Уравнение Нернста.
Учение об электродвижущих силах гальванических элементов является одним из основных разделов электрохимии. Начало изучению электродвижущих сил было положено еще М. В. Ломоносовым (1750), который в своих работах отмечал связь между химическими и электрическими явлениями. Позднее наблюдения итальянского физиолога Гальвани (1780) и обширные работы итальянского физика Вольта (1780) привели к открытию гальванических элементов.
В 1800 г. Вольта изобрел первый химический источник тока, так называемый вольтов столб, который был собран из пластинок различных металлов, разделенных прослойками ткани, смоченной электролитом. Исследования привели Вольта к открытию контактной разности потенциалов, возникающей при соприкосновении металлов различной природы. В первых исследованиях в качестве чувствительного прибора для обнаружения малой разности потенциалов ученый использовал свежеанатомированные мышцы лягушки. Этот случай является наглядным примером того, как биологические методы исследования нередко могут способствовать успешному развитию физики и других точных наук.
Открытие химических источников тока и контактной разности потенциалов оказало большое влияние на все последующее развитие электрохимических явлений. В настоящее время методы электрохимии получили широкое распространение в агрохимии, физиологии растений, в биологии, почвоведении, а также во многих других смежных дисциплинах.
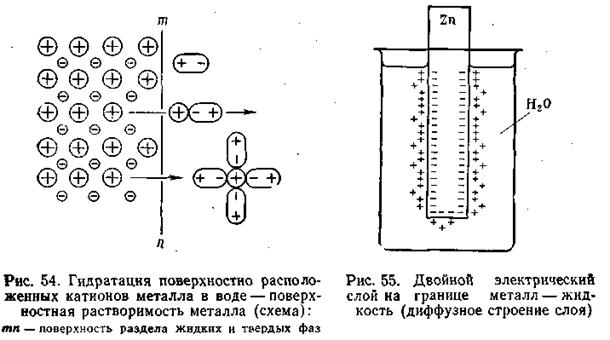
Если в чистую воду погрузить пластинку какого-либо металла, то согласно гидратной теории Д. И. Менделеева ионы металла будут взаимодействовать с полярными молекулами воды. Иными словами, поверхностно расположенные катионы этого металла будут гидратироваться молекулами воды и переходить в окружающий раствор, заряжая его положительно, т. е. металл будет как бы растворяться (рис.4.8).
Однако электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. В результате этого между ионами металла, перешедшими в раствор, и поверхностью металлической пластинки возникают силы электростатического притяжения, в силу чего ионы, окружающие пластинку, образуют так называемый двойной электрический слой, схема которого приведена на рис. 4.8. Этот слой препятствует дальнейшему растворению металла и в системе устанавливается подвижное равновесие, которое характеризуется равными скоростями как растворения, так и обратного осаждения ионов из раствора на поверхности металлической пластинки.
Первоначально считали, что двойной электрический слой имеет плоское строение. Он уподоблялся конденсатору, одна из обкладок которого расположена на поверхности металла, другая — в слое прилегающей к электроду жидкости. Расстояние между обкладками равно диаметру молекулы.
Согласно этой теории, которую обычно связывают с именем Гельмгольца (1879), учитывалось только проявление электростатических сил взаимодействия между зарядами противоположного знака и не учитывалось изменение свойств двойного электрического слоя с изменением концентрации электролита и его температуры, что явилось основным недостатком теории Гельмгольца.
В разработке современной теории строения двойного электрического слоя на границе твердая фаза—жидкость и методов его исследования ведущая роль принадлежит А. Н. Фрумкину и его школе. Работы А. Н. Фрумкина и его учеников установили, что слой ионов, располагающийся в жидкости, благодаря действию двух противоположно направленных сил (электростатического притяжения и теплового движения) имеет диффузное строение, т. е. он проникает в жидкость на некоторую глубину (рис. 4.8).
|
|
Определенная часть ионов удерживается вблизи поверхности раздела металл—электролит, образуя обкладку двойного слоя с толщиной, отвечающей среднему радиусу ионов электролита. Остальные ионы, входящие в состав двойного слоя, распределяются диффузно, с постепенно убывающей плотностью заряда.
Таким образом, при соприкосновении металла с водой ионы его находятся под действием двух конкурирующих сил: электростатического притяжения, возникающего между ионами металла и молекулами воды (явление гидратации), и электростатического притяжения со стороны электронного газа, определяющего прочность кристаллической решетки.
Вполне понятно, что чем прочнее кристаллическая решетка металла, тем труднее иону металла перейти в раствор. Чем выше величина энергии гидратации, тем с большей жадностью молекулы воды взаимодействуют с этими ионами, и тем легче им выделиться в раствор.
В результате взаимодействия двух указанных взаимно противоположных сил растворение металла в воде приобретает характер только поверхностного процесса и охватывает лишь очень узкую область на границе металл—жидкость. В этом поверхностном слое концентрация ионов металла, несмотря на его чрезвычайно малую растворимость, может быть довольно значительной. Кроме того, в поверхностном растворе гидратированные катионы в силу электростатических сил притяжения со стороны электронов кристаллической решетки металла совершают лишь ограниченное кинетическое движение в виде так называемых «пристенных» скачков. Они прочно связаны с жестким каркасом кристаллической решетки металла.
Таким образом, в системе металл — вода на границе раздела фаз возникает двойной электрический слой, блокирующий поверхность металла. Образовавшаяся пограничная разность потенциалов получила название электродного потенциала (дат. potentia — возможность, мощь).
Если жидкая среда — чистая вода, для всех металлов картина в качественном отношении будет однозначной: металл заряжается отрицательно, прилегающий слой жидкости — положительно. Однако количественно для разных металлов будут наблюдаться существенные различия, что объясняется не только неодинаковой энергией связи катионов этих металлов в кристаллической решетке, но и неодинаковой гидратируемостью этих катионов.
Несколько иная картина наблюдается в случае, если металлическую пластинку погрузить не в чистую воду, а в раствор соли этого металла. При этом могут иметь место три случая.
1. Исходная концентрация ионов данного металла в растворе С меньше концентрации Со, соответствующей равновесному состоянию ионов после погружения в раствор металлической пластинки, т. е. С С0. В этом случае наблюдается обратное явление: ионы металла из раствора выделяются на поверхности металлической пластинки. Чтобы ионы металла могли выделиться, они должны присоединить электроны согласно уравнению (б). Поскольку источника электронов в системе нет, выделение металла на поверхности пластинки происходит в виде ионов. В результате поверхность приобретает положительный заряд.
3. При условии С=С0 вся система будет находиться в состоянии подвижного равновесия, разность потенциалов между жидкостью и металлом равна нулю. В этом случае из раствора осаждается на единицу поверхности металла столько же катионов, сколько их выходит в двойной электрический слой.
Принимая это во внимание, нетрудно найти математическую зависимость между величиной скачка потенциала на границе соприкосновения металла и раствора и концентрацией (точнее, активностью) ионов этого металла в растворе.
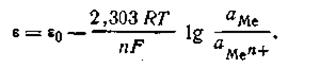 | 4.84 |
Так как активность металла принимается равной единице (аMе= 1), то с учетом этого уравнения (4.84) будет иметь следующее выражение:
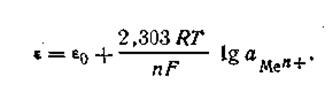 | 4.85 |
Уравнение (4.85) называется уравнением Нернста,
ε0— постоянная величина, характеризующая электрохимическую природу электрода.
Для расчетов удобнее предварительно вычислить значение R·T· 2,303/F при какой-либо температуре. Например, при 291 К это число будет равно 0,0577. Следовательно, для температуры 291 К уравнение Нернста будет иметь вид:
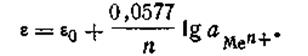 | 4.86 |
Обозначим численное значение выражения R·T·2,303/F буквой Ж.
Зависимость этого числа от температуры выразится следующей формулой:
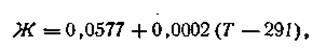 | 4.87 |
где Г —любая температура, при которой производится измерение разности потенциалов. С учетом этого обозначения уравнение электродного потенциала Нернста будет иметь следующий вид:
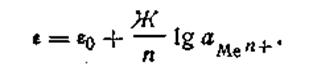 | 4.88 |

обращается в нуль, и тогда
 | 4.89 |
Таким образом, стандартным (нормальным) потенциалом называется такой потенциал, который возникает на металлической пластинке, находящейся в контакте с одноименными ионами в растворе, с концентрацией С=1 моль/л.
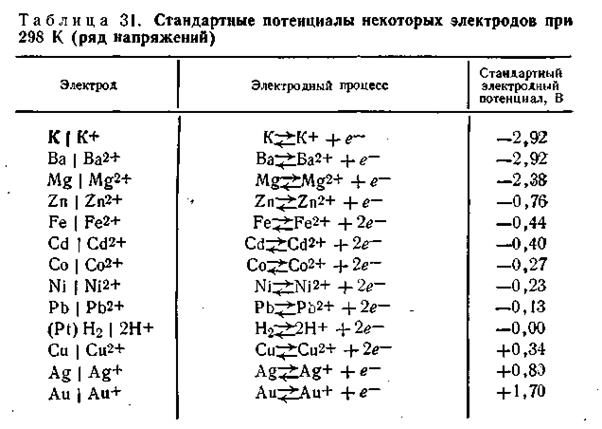
За нулевую точку измерения потенциалов условно принят нормальный потенциал водородного электрода. Для изготовления его используют способность платины растворять газообразный водород. Платиновая проволока или пластинка, содержащая растворенный водород, играет роль «водородной пластинки», а функции «раствора солей» может выполнять любой водный раствор, в котором всегда присутствуют ионы водорода Н + . Причем нормальный потенциал водородного электрода равен нулю при условии, что давление молекулярного водорода на пластинке равно 101,325 кПа и СН+ = 1 моль/л.
Если нормальный потенциал какого-либо металла больше водородного, его принято считать положительным, если меньше — отрицательном.
Если все металлы расположить последовательно по возрастающей величине их нормальных электродных потенциалов, получится ряд напряжений. В табл. 4.9 приведены стандартные потенциалы некоторых металлов.
В этой таблице каждый электрод обозначен символом элемента, из которого он состоит, и соответствующего иона, а вертикальная линейка изображает поверхность раздела двух фаз, где имеет место скачок потенциала.
Представленным в табл. 4.9 рядом напряжений широко пользуются в практике при составлении так называемых гальванических элементов, а также при изучении взаимодействия между металлами и кислотами, между солями и металлами. Зная ряд напряжений, можно предвидеть направление реакции вытеснения одних элементов другими. Так металлы, стоящие в ряду напряжений после водорода, не способны вытеснять водород из кислот. Вытеснение металла из солей другим металлом осуществляется только в том случае, если вытесняющий металл расположен в ряду напряжений до вытесняемого.
Например, при составлении гальванического элемента из цинка и свинца в качестве положительного электрода следует взять свинцовый (εо= -0,13 В), а в качестве отрицательного — цинковый (εо= -0,76 В).
|
Электроды подразделяются на электроды первого и второго рода. Электроды первого рода — это электроды из металла, погруженного в раствор, содержащий ионы того же металла (например, Cu|Cu 2+ , Zn|Zn 2+ ). Эти электроды обратимо обменивают катионы Ме↔Ме n + nе, где n — число теряемых (или приобретаемых) электронов (е — ).
Электроды второго рода состоят из металла, покрытого слоем труднорастворимой соли и погруженного в раствор какой-либо легкорастворимой соли с тем же анионом. Такие электроды обратимы относительно этого аниона.
Для электродов второго рода выражение электродного потенциала
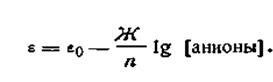 | 4.90 |
Дата добавления: 2016-02-20 ; просмотров: 2548 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Краткие теоретические седения
Федеральное бюджетное образовательное учреждение
Высшего профессионального образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ
МОРСКОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Гармашова И.В., Даниловская Л.П.
Методические указания для самостоятельной подготовки студентов к лабораторному занятию по теме
ЭЛЕКТРОХИМИЯ:
Гальванический элемент, электродные потенциалы
Санкт-Петербург
Краткие теоретические седения
Электрохимия — это раздел физической химии, изучающий взаимопревращение химической энергии в электрическую.
В технике применяется два основных электрохимических процесса, имеющих общую природу:
§ получение электрической энергии за счет химических реакций (химические источники тока);
§ протекание химических реакций под действием электрического тока (электролиз).
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из:
– проводников первого рода – веществ, обладающих электронной проводимостью и находящихся в контакте с электролитом — металлов;
– проводников второго рода – веществ, обладающих ионной проводимостью – электролитов.
ПОНЯТИЕ ОБ ЭЛЕКТРОДНОМ ПОТЕНЦИАЛЕ
При погружении металла в раствор происходит переход катионов с металла в раствор или из раствора на металл. На границе раздела двух фаз (металл-раствор) происходит перенос электрического заряда, т.е. протекает электрохимическая реакция, которая приводит к возникновению скачка потенциала.
Металлическая пластинка, погруженная в раствор электролита, называется электродом.
Переход ионов прекращается после установления динамического равновесия, заключающегося в том, что скорость растворения ионов равна скорости обратного процесса – выделения их на поверхность металла.
Возьмем две металлические пластинки, например, цинковую и медную. При погружении цинковой пластинки, более активного металла, в раствор соли цинка ZnSO4 происходит отрыв ионов цинка Zn 2 + от кристаллической решетки металла под влиянием полярных молекул растворителя (рис.1). В результате перехода катионов в раствор металл приобретает отрицательный заряд за счет оставшихся на нем электронов, а прилежащий к нему слой раствора заряжается положительно за счет катионов, удерживаемых отрицательным зарядом металла. При погружении медной пластинки, менее активного металла, происходит процесс осаждения катионов из раствора на металле. Пластинка приобретает положительный заряд (рис. 1).
Рис. 1. Механизм возникновения электродного потенциала
Схема записи цинкового электрода: Zn|Zn 2+
Реакция, протекающая в элементе: 
Схема записи медного электрода: Cu 2+ |Cu
Реакция, протекающая в элементе: 
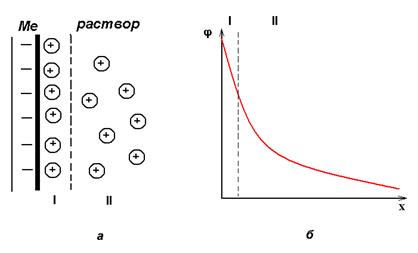
Переход заряженных частиц через границу «раствор-металл» сопровождается возникновением на границе раздела фаз двойного электрического слоя (ДЭС). ДЭС создается электрическими зарядами, находящимися на металле, и ионами противоположного заряда, ориентированными в растворе у поверхности электрода (рис.2).
Рис. 2 Структура двойного электрического слоя
а – строение ДЭС;
б- распределение потенциала в ДЭС.
I – плотная часть ДЭС, II – диффузная часть ДЭС
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода (φ). Эти потенциалы ограничивают процесс дальнейшего перемещения ионов с металла на металл. По мере удаления ионов от границы раздела величина потенциала в двойном электрическом слое убывает.
Потенциалы, возникающие на металлах, погруженных в растворы собственных солей, называются равновесными электродными потенциалами(φ р ).
Величина равновесного электродного потенциала зависит от природы электрода, температуры и концентрации ионов металла в растворе и выражается уравнением Нернста:

где j 0 – величина стандартного электродного потенциала, измеренного при Т =298 К в растворе соли этого же металла с концентрацией ионов металла Me n + , равной 1 моль/л (величины стандартных электродных потенциалов металлов указаны в ряду напряжений металлов; см. приложение №1);
R – универсальная газовая постоянная (8,314 Дж/моль·К)
T —температура в Кельвинах (K)
n– число электронов, участвующих в электродном процессе (или заряд катиона);
F – постоянная Фарадея (96,485 Кл/моль);
[Me n + ] – концентрация ионов Me n + в растворе (моль/л)
При температуре 25 0 C и множителя 2,303 для перехода от натуральных логарифмов и десятичным комбинация физических констант в уравнении (1) будет иметь вид:
Таким образом, уравнение Нернста примет вид:

Например, в электродной системе протекает полуреакция

Следовательно, уравнение Нернста для цинкового электрода можно записать как:
На металле, погруженном в электролит, не содержащий ионов этого металла (морская вода, раствор кислоты и т.п.), возникает неравновесный (коррозионный) потенциал ( 
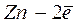


Значения абсолютных величин электродных потенциалов принципиально измерить невозможно. Следовательно, ограничиваются нахождением относительных величин электродных потенциалов по отношению к другому электроду, принятому в качестве стандартного электрода сравнения.
Основным стандартным электродом, потенциал которого условно принят за нуль, является водородный электрод(рис. 3). С ним сравнивают потенциалы других электродов.
Рис. 3. Схема устройства водородного электрода
Водородный электрод состоит из платиновой проволоки с приваренной к ней пластинки, покрытой платиновой чернью, погруженной в раствор кислоты с активностью ионов водорода, равной 1 моль/л. В сосуд подают химически чистый водород под давлением 1 атм.
Схема записи водородного электрода:
2 H + |H2(Pt).
На границе раздела фаз устанавливается равновесие:

Уравнение Нернста для расчета величины водородного электродного потенциала (n=1) имеет вид:
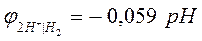
На практике для измерения электродных потенциалов металлов в качестве электрода сравнения не используют водородный электрод, т.к. он сложен в изготовлении и эксплуатации.
В качестве электрода сравнения используют хлорсеребряный электрод (см. приложение 2)
По величине стандартных электродных потенциалов (φ 0 ) металлические электроды располагаются в определенной последовательности, называемой электрохимическим рядом напряжений (см. приложение1).Положительные величины φ 0 указывают на то, что на данном электроде будет протекать реакция восстановления, а отрицательные величины φ 0 соответствуют тому, что на нем пойдет процесс окисления. Чем меньше значение φ 0 – потенциала, тем активнее металл.
Металлы с отрицательным значением потенциала вытесняют водород из растворов разбавленных кислот. Каждый металл способен вытеснять из растворов солей другие, менее активные металлы металлы, которые имеют большее алгебраическое значение потенциала. Так, если погрузить в раствор CuSO4 пластину из цинка, то часть ее растворится, а из раствора на поверхности пластины выделится красноватый слой меди:

Энергия этой окислительно-восстановительной реакции может быть превращена в электрическую энергию. Однако для этого необходимо пространственное разделение процессов окисления и восстановления.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Гальванические элементы относятся к химическим источникам электрического тока и позволяют получать ток за счет самопроизвольного протекания химической реакции.
Гальваническим элементомназывается обратимая электрохимическая система, состоящая из двух электродов, погруженных в раствор электролита, в которой энергия окислительно-восстановительного процесса превращается в электрическую.
Гальванический элемент состоит из двух электродов, различающихся величиной φ-потенциалов. Электрод с меньшим значением φ-потенциала является анодом, а электрод с бỏльшим значением потенциала – катодом.
Устройство и принцип работы гальванического элемента можно рассмотреть на примере электрохимического элемента Якоби-Даниэля (рис. 4).
Рис. 4. Устройство элемента Якоби-Даниэля
Такой элемент имеет электроды из цинка и меди, погруженные в сернокислые растворы этих металлов. Емкости соединены между собой солевым мостиком, заполненным раствором хлорида калия (KCl).
При замыкании цепи гальванического элемента между цинковым электродом и раствором электролита идет реакция окисления, т.е. цинковая пластинка растворяется:

Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны. Следовательно, цинковая пластинка заряжается отрицательно и становится анодом.
Между медным электродом и окружающим его раствором CuSO4 идет реакция восстановления:

Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом.
ЗАПОМНИТЕ!О к и с л е н и е – отдача электронов – происходит н а а н о д е, в о с с т а н о в л е н и е – приобретение электронов – н а к а т о д е. В гальваническом элементе анод имеет знак «-», а катод имеет знак «+».
Для гальванического элемента принята следующая форма записи:
 |
А(-) Zn | ZnSO4 || CuSO4 | Cu (+)К,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || — солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
Источником электрической энергии в элементе служит окислительно-восстановительная реакция, называемая суммарной или разрядной:
Cu 2+ + Zn = Cu + Zn 2+
Важнейшей характеристикой гальванического элемента является электродвижущая сила (ЭДС), которая определяется как предельная разность потенциалов, возникающая на границе раздела фаз в разомкнутой цепи элемента.
Э Д С – количественная характеристика эффективности работы гальванического элемента – она показывает, насколько полно осуществляется процесс перехода химической энергии в электрическую.
Величина Е всегда положительна (Е>0).
Для медно-цинкового гальванического элемента ЭДС равна:

Работа гальванического элемента связана с уменьшением энергии Гиббса 
А = — 



Окислительно — восстановительный потенциал
Электродные потенциалы. ЭДС реакции
Окислительно — восстановительный потенциал является частным, узким случаем понятия электродного потенциала. Рассмотрим подробнее эти понятия.
В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту.
Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию, если, например, окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества.
Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Элемент Даниэля-Якоби
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Значение и знак (+ или -) электродного потенциала определяются природой раствора и находящегося в нем металла.
При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn 2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e — = Zn 2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu 2+ + 2e — = Cu
Таким образом, в элементе Даниэля-Якоби происходит такая реакция:
Zn + Cu 2+ = Zn 2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
2Fe 3+ + 2I — = 2Fe 2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник.
В сосуды, содержащие растворы Fe 3+ и I — , поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток.
Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe 3+ :
2I — — 2e — = I2
2Fe 3+ + 2e — = 2Fe 2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом.
Факторы, влияющие на значение окислительно-восстановительного потенциала
Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
1) Природа вещества (окислителя и восстановителя)
2) Концентрация окисленной и восстановленной форм.
При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
При Cок > Cвос, E > E° и наоборот, если Cок 2- , CrO4 2- , MnO4 — ) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H + . И наоборот, окислительно-восстановительный потенциал падает с уменьшением H + .
4) Температура
При увеличении температуры окислительно-восстановительный потенциал данной пары также растет.
Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С.
Такие таблицы дают возможность сделать некоторые выводы:
Что можно определить по значению окислительно-восстановительного потенциала
- Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например
E°(F2/2F — ) = +2,87 В – сильнейший окислитель
E°(K + /K) = — 2,924 В – сильнейший восстановитель
Окислительно-восстановительная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
- Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами.
- Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
практически протекает в прямом направлении, т.к.
E° (Sn 4+ /Sn 2+ ) = +0,15 В,
E° (Fe 3+ /Fe 2+ ) = +0,77 В,
т.е. E° (Sn 4+ /Sn 2+ ) 3+ /Fe 2+ ).
Cu + Fe 2+ = Cu 2+ + Fe
невозможна в прямом направлении и протекает только справа налево, т.к.
В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
- Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая.
- Пользуясь справочными данными, можно определить ЭДС реакции.
Как определить электродвижущую силу (ЭДС) реакции?
Рассмотрим несколько примеров реакций и определим их ЭДС:
- Mg + Fe 2+ = Mg 2+ + Fe
- Mg + 2H + = Mg 2+ + H2
- Mg + Cu 2+ = Mg 2+ + Cu
E° (Mg 2+ /Mg) = — 2,36 В
E° (Fe 2+ /Fe) = — 0,44 В
Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя
ЭДС = Е 0 ок — Е 0 восст
- ЭДС = — 0,44 — (- 2,36) = 1,92 В
- ЭДС = 0,00 — (- 2,36) = 2,36 В
- ЭДС = + 0,34 — (- 2,36) = 2,70 В
Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0.
Связь константы равновесия и окислительно — восстановительного потенциала
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu 2+ = Zn 2+ + Cu
Применяя закон действующих масс, можно записать
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn 2+ и Cu/Cu 2+ , находим
В состоянии равновесия E 0 Zn/Zn2+ = E 0 Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2+ = +0,34 + (0,59/2)lgCCu2+, откуда получаем
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 10 37,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E1 0 -E2 0 )n/0,059, где
K — константа равновесия
E1 0 и E2 0 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E1 0 > E2 0 , то lgK > 0 и K > 1.
Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E1 0 — E2 0 ) достаточно велика, то она идет практически до конца.
Напротив, если E1 0 0 , то K будет очень мала.
Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E1 0 — E2 0 ) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
Как составить схему гальванического элемента?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции:
- ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
- Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода.
Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод).
- Граница раздела фаз обозначается одной чертой — |
- Электролитный мостик на границе двух проводников обозначается двумя чертами — ||
- Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую.
Например, составим схему гальванического элемента, в котором осуществляется следующая реакция:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0
В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый.
Анод Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Катод
Типичные задачи на составление схем гальванического элемента и вычисление ЭДС реакции с решениями вы найдете здесь.
http://poisk-ru.ru/s35030t11.html
http://zadachi-po-khimii.ru/obshaya-himiya/okislitelno-vosstanovitelnyj-potencial.html