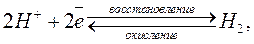Стандартный водородный электрод
Содержание:
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 21.04.2019 |
- Данный тип работы не является научным трудом, не является готовой выпускной квалификационной работой!
- Данный тип работы представляет собой готовый результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала для самостоятельной подготовки учебной работы.
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
Посмотрите похожие темы возможно они вам могут быть полезны:
Введение:
Причиной скачков потенциала является переход заряженных частиц (электронов, ионов) из одной фазы в другую.
Диффузионный потенциал — возникает на границе раздела растворов электролитов, которые различаются по природе или концентрации.
В элементе Якоби-Даниэля ионы переносятся во внутренней цепи от правой половины элемента к левой (это цепь переноса). Контакт растворов осуществляется через пористую диафрагму или солевой мостик с использованием растворов электролитов KCI, KNO3, NH4Cl, NH4NO3, ионы которых имеют примерно одинаковую подвижность (KCl = 73,5; = 76,35 Ом-1 см2 экв-1) уменьшить.
не всегда можно рассчитать, поэтому они часто пытаются его уменьшить. Для цепи (-) Pt, CI2 | Раствор HCI | CI2, Pt (+).
отсутствует (цепь без переноса), так как оба электрода помещены в один и тот же раствор соляной кислоты.
Характер потенциального скачка на границе раздела. Концепция электродного потенциала
Потенциал контакта возникает, когда два металлических электрода находятся в контакте или когда два металла связаны друг с другом через другие металлы. Разность контактных потенциалов определяется только природой крайних металлов. Если гальванический элемент имеет два одинаковых электрода в начале и в конце цепи = 0 (поскольку цепь правильно разомкнута).
Когда заряженные частицы переходят из одной фазы в другую, в дополнение к химической работе, также выполняется электрическая работа, и электрохимическое состояние заряженной частицы в фазе называется электрохимическим потенциалом (химический потенциал + электрическая энергия частицы).
В окислительно-восстановительной среде значение стандартного электродного потенциала через значения его химических окислительно-восстановительных потенциалов в стандартных условиях будет иметь вид.
Абсолютный электродный потенциал? потенциальный скачок между металлом и раствором.
Потенциальный скачок на границе раздела электрод — раствор
Когда проводник типа I (металлический) вступает в контакт с раствором электролита (проводник типа II), на границе раздела металл-раствор появляется двойной электрический слой (DES).
Во-первых, представьте, что цинковый электрод помещен в воду. Известно, что в кристаллической решетке металлов есть катионы и атомы, которые занимают определенные места в узлах решетки, и относительно свободные электроны движутся между катионами. Под воздействием полярных молекул воды катионы цинка отрываются от цинковой пластины и переходят в слой воды, прилегающий к поверхности металла. В этом случае электрод заряжается отрицательно, а раствор заряжается положительно благодаря катионам, которые в него попали. Между металлом и раствором образуется двойной электрический слой, и происходит скачок потенциала.
Появление электрического заряда на электроде предотвращает дальнейший переход катионов в раствор. При достижении определенной концентрации ионов в растворе устанавливается динамическое равновесие, которое сопровождается непрерывным обменом катионов между металлом и раствором.
Между металлом и раствором устанавливается скачок равновесного потенциала.
Подобные взаимодействия происходят, когда металл погружается в солевой раствор этого металла. Однако равновесие возникает при другом значении скачка потенциала, определяемом концентрацией ионов металлов в растворе.
В результате этих процессов раствор вблизи металла приобретает заряд, противоположный по знаку заряду металла, так как большинство катионов расположены на отрицательно заряженной поверхности металла, образуя плотный слой толщиной d. Двойной электрический слой DES сформирован. Этот слой характеризуется различным распределением ионов разных знаков в поверхностном слое раствора и неравномерным распределением зарядов в поверхностном слое металла. Это связано с определенной разностью потенциалов (скачок потенциала) на границе раздела металл / раствор. Некоторые из катионов металлов перемещаются из металла в глубину раствора и образуют диффузную часть ДЭС толщиной. Толщина этого слоя в растворе зависит от концентрации раствора, заряда металла и температуры.
Для металлов с низкой активностью, например меди, серебра и т. д., металл заряжен положительно, а соседний раствор заряжен отрицательно.
Очевидно, что если металл положительно заряжен при погружении в раствор, концентрация катионов в диффузном слое будет уменьшена, а концентрация анионов увеличена по сравнению с их концентрацией в растворе.
Таким образом, когда металл погружается в воду или раствор, содержащий ионы данного металла, на границе раздела металл / раствор образуется двойной электрический слой, и между металлом и раствором возникает разность потенциалов (скачок потенциала). Величина этой разности потенциалов зависит от свойств металла и раствора, в частности от концентрации ионов данного металла в растворе и от характера взаимодействия между частицами в двойном электрическом слое.
ДЭС по данным русского ученого Р.А. Колли похож на плоский конденсатор, одна пластинка которого находится на поверхности металла, другая находится в растворе на расстоянии диаметра молекулы воды.
Первые представления о структуре двойного электрического слоя были предложены русским ученым Р.А. Колли (1878), затем Л. Гельмгольц (1879), Т. Гай (1910) и Д. Чепмен (1913). Основы современной теории двойного электрического слоя были разработаны О. Штерном (1924), разработанным академиком А.Н. Фрумкин с сотрудниками.
Стационарный равновесный потенциал характеризуется непрерывным обменом заряженными частицами между электродом и раствором (это обменный ток, открытый В. Батлером (1936), его наличие было подтверждено методом меченых частиц).
Рассматриваемые металлические элементы являются обратимыми по отношению к катионам, т.е. обмениваются катионами с раствором — это ионы, определяющие потенциал (POI), поскольку скачок потенциала зависит от их концентрации.
В этом случае двойной электрический слой образуется в результате обмена анионами, которые определяют потенциал.
Стандартный водородный электрод. стандартные электродные потенциалы
Как упомянуто выше, абсолютное значение скачка потенциала на границе раздела электрод-раствор не может быть измерено экспериментально. Для практического определения потенциала электрода действуйте следующим образом: экспериментально измерьте ЭДС гальванического элемента, состоящего из двух электродов, и потенциал одного из них обычно принимается равным нулю.
Международным стандартом для сравнения электродных потенциалов является стандартный водородный электрод. Это платиновая пластина, покрытая платиновой сажей и насыщенная водородом H2 при p = 1 атм. Пластина погружается в раствор, где активность ионов водорода = 1 моль / дм3. Платина катализирует электродный процесс 2H + + 2e — H2. Электрохимическая схема стандартного водородного электрода: Pt, H2 (p = 1 атм) | H2SO4 (= 1 моль / дм3).
В этих условиях потенциал электрода водородного электрода принимается равным нулю = 0 и не зависит от температуры.
На основании решений Международной конвенции (Стокгольм, 1953 г.) для определения потенциала электрода создается гальваническая цепь, состоящая из измеряемого электрода и стандартного водородного электрода. При записи электрохимических цепей электрод с меньшим значением потенциала электрода (анод) записывается слева, а электрод с большим значением (катод) справа.
Например:
- (-) Zn | ZnSO4 || CuSO4 | Cu (+)
- (-) Zn — 2e> Zn2 + — процесс окисления
- (+) Cu2 + + 2e> Cu — процесс восстановления
- Zn + Cu2 +> Zn2 ++ Cu — общая токообразующая реакция.
Схема электрохимического контура с водородным электродом правильно написана в следующей последовательности: слева — стандартный водородный электрод, затем POI или весь электролит, а затем электрод: Pt, H2 (p = 1) | H2SO4 (= 1) || ZnSO4 | Zn.
В гальваническом элементе электроны перейдут от цинка к водородному электроду Pt, H2 (p = 1) | H2SO4 (= 1) || ZnSO4 | Zn.
Здесь будет происходить та же реакция, как если бы цинк был погружен в раствор серной кислоты (H2SO4). Электроны перешли бы от цинка к кислоте.
Для неактивных металлов, таких как медь, поток электронов идет от водородного электрода к медному электроду.
Измерьте ЭДС гальванического элемента в условиях равновесия.
Считается, что если поток электронов идет справа налево, то ЭДС отрицательна; если поток электронов идет слева направо, то ЭДС положительна.
В первом случае с цинком значение ЭДС отрицательно, во втором случае с медью значение ЭДС положительно, когда поток электронов идет слева направо.
Поскольку значение потенциала стандартного водородного электрода принимается равным нулю (= 0), ЭДС цепи равна потенциалу электрода измеряемого электрода.
При условии, что активность определяющих потенциал ионов составляет aPOI = 1 моль / дм3, потенциалы электродов называются стандартными, значения приведены в таблице при 25 ° C, они зависят от химической природы электрода, от заряда его ионы в растворе и выражаются в вольтах (V).
Расположенные в порядке возрастания стандартных электродных потенциалов, металлы представляют собой известную серию металлических напряжений.
Если aPOI ≥ 1, то потенциал электрода μ не является стандартным, и его зависимость от концентрации ионов определяется уравнением Нернста.
Уравнение Нернста. ЭДС равновесной электрохимической цепи, ее связь с изменением энергии Гиббса электрохимической реакции
Химическая энергия реакции в гальваническом элементе является источником электрической энергии. Наиболее важной количественной характеристикой гальванического элемента является ЭДС, которая равна разности потенциалов электрода: потенциал левого электрода (анода) вычитается из потенциала правого электрода, который больше по величине (катода).
Например, если в ячейке Якоби-Даниэля электрохимическая реакция Zn + Cu2 + = Zn2 + + Cu осуществляется в обратимых (равновесных) условиях, то выполняемая ею работа максимально равна работе электрических сил.
Если все процессы обратимы при постоянной температуре и давлении, то электрические работы, выполняемые гальваническим элементом, равны произведению ЭДС и количеству переданного электричества.
Максимальная работа реакции определяется уменьшением изобарико-изотермического потенциала согласно уравнению изотермы для элемента Якоби-Даниэля.
Это основное уравнение ЭДС гальванического элемента, состоящего из двух металлических электродов; его часто называют уравнением Нернста для определения ЭДС гальванического элемента.
Если активность ионов металлов в растворе не равна единице, то электродный потенциал металла не является стандартным. Зависимость потенциала металлического электрода от активности определяющих потенциал ионов в растворе определяется уравнением потенциала электрода Нернста.
Вывод этой формулы может быть дан на основе основного уравнения ЭДС гальванического элемента. Для определения потенциала электрода, как упомянуто выше, изготавливают гальванический элемент, один из полуэлементов которого является стандартным водородным электродом, а другой — испытательным, например медным.
Электрод представляет собой систему, в простейшем случае состоящую из двух фаз, из которых твердое тело имеет электронную, а другая — жидкость имеет ионную проводимость. Твердая фаза с электронной проводимостью считается проводником типа I, а жидкая фаза с ионной проводимостью считается II типом. Когда эти два проводника вступают в контакт, образуется двойной электрический слой (DES). Это может быть результатом ионного обмена между твердой и жидкой фазами или результатом специфической адсорбции катионов или анионов на поверхности твердой фазы, когда она погружена в воду или раствор.
С ионным механизмом образования DEL, например, в случае, когда химический потенциал атомов на поверхности металла (твердой фазы) больше, чем химический потенциал ионов в растворе, тогда атомы с поверхности металла перейдут в раствор в виде катионов: Me Mez + + ze-. Высвобожденные электроны заряжают поверхность твердой фазы отрицательно и, как следствие, притягивают положительно заряженные ионы раствора к поверхности. В результате на поверхности раздела образуются два противоположно заряженных слоя, которые являются пластинами своего рода конденсатора. Для дальнейшего перехода заряженных частиц из одной фазы в другую им необходимо выполнить работу, равную разности потенциалов пластин этого конденсатора. Если химический потенциал атомов на поверхности твердой фазы меньше, чем химический потенциал ионов в растворе, то катионы из раствора переходят на поверхность твердой фазы, заряжая его положительно: Mez ++ ze-Me , Как в первом, так и во втором случае эти процессы не протекают бесконечно, но до установления динамического равновесия, которое может быть представлено обратимым окислительно-восстановительным переходом типа Me — Mez + или, в общем случае, Ox + Редз +.
Процессы, в которых возврат или присоединение электронов происходит на электродах, называются электродом.
К сожалению, невозможно экспериментально установить внутренние потенциалы отдельных фаз (Me) и (p — p). Любая попытка подключить раствор с помощью провода к измерительному устройству вызывает появление новой поверхности контакта раствора металла, то есть появление нового электрода с собственной разностью потенциалов, которая влияет на измеряемый.
Однако можно измерить разницу (Me) — (p — p) гальванической ячейкой. Гальваническая ячейка — это система, состоящая из двух разных электродов, которая способна самопроизвольно преобразовывать химическую энергию окислительно-восстановительной реакции, происходящей в ней, в электрическую энергию. Электроды, которые составляют гальванический элемент, называются полуэлементами. Окислительно-восстановительная реакция, протекающая в гальваническом элементе, пространственно разделена. Полуреакция окисления происходит в полуэлементе, называемом анодом (отрицательно заряженный электрод), а полуреакция восстановления происходит на катоде.
Электродвижущая сила (ЭДС) гальванического элемента алгебраически состоит из различий во внутренних потенциалах составляющих его электродов. Поэтому, если электрод с известным значением разности внутренних потенциалов Me (Me) — (раствор) принимается за один полуэлемент, то измеренное значение ЭДС можно использовать для расчета требуемой разности потенциалов изучаемый электрод.
Для этой цели обычно используют стандартный (нормальный) водородный электрод. Он состоит из платиновой пластины или проволоки, покрытой платиновой сажей (мелкая платина), погруженной в раствор кислоты с = 1 моль / л, давление водорода выше которого составляет 0,1 МПа (1 атм). Под каталитическим воздействием платиновой сажи в электроде происходит обратимый окислительно-восстановительный переход. Разница внутренних потенциалов для водородного электрода в соответствии с формулой Нернста составляет:
Ионы, от концентрации которых непосредственно зависит потенциал электрода, называются определяющими потенциал для данного электрода.
По природе определяющих потенциал ионов, есть I, II типа, окислительно-восстановительные электроды и мембранные электроды.
Электроды типа I включают металл, амальгаму и газ. Для них определяющими потенциал ионами являются катионы. Они обратимы по отношению к катионам.
Металлические электроды состоят из металла, погруженного в раствор, содержащий его ионы. Они могут быть представлены в виде диаграммы: MeZ + / Me, например Ag + / Ag. На них отвечает обратимый окислительно-восстановительный переход: MeZ + + Me.
Газовые электроды состоят из инертного металла (обычно платины), контактирующего как с газом, так и с раствором, содержащим ионы этого газообразного вещества. Например, водородный электрод.
Электроды типа I обычно используются в EMA в качестве индикаторных электродов, то есть электродов, потенциал которых зависит от концентрации определенных ионов. Эта зависимость называется функцией электрода.
Электроды типа II состоят из металла, покрытого слоем его плохо растворимого соединения и погруженного в раствор растворимой соли, содержащей такой же анион, что и плохо растворимое соединение. Для них определяющими потенциал ионами являются анионы. Они обратимы по отношению к анионам.
Электроды типа II широко используются в электрохимических измерениях в качестве эталонов (электродов сравнения), поскольку их потенциал стабилен во времени и хорошо воспроизводится, если концентрация анионов поддерживается постоянной. Электроды Calomel и хлорид серебра чаще всего используются в качестве электродов сравнения.
Каломельный электрод состоит из ртути, покрытой пастой, содержащей каломель (Hg2Cl2), и в контакте с раствором KCl:
- Cl- / Hg2Cl2, Hg; ½ Hg2Cl2 + Hg + Cl-;
- E (Cl- (Hg2Cl2, Hg)) = 0,2678-0,0257 ln (Cl-) при 298 К.
Обычно используются каломельные электроды с содержанием KCl 0,1 М; 1М и рассол.
При использовании насыщенного раствора потенциал хлорида серебра при 298 К составляет 0,22 В.
В мембранных (ионоселективных) электродах наиболее важным компонентом является полупроницаемая мембрана. Это тонкая жидкая или твердая пленка с преимущественной проницаемостью только для ионов одного типа (например, Na в присутствии ионов других щелочных металлов). Механизм полупроницаемости мембраны может быть различным. В некоторых случаях мембрана имеет поры определенного размера, через которые не проходят ионы больших размеров, в других случаях она изготовлена из материала, который растворяет одно из веществ, присутствующих в растворе, и, таким образом, обеспечивает его прохождение через мембрану. Часто материал мембраны представляет собой органический или неорганический ионообменник, матрица которого содержит ионные группы. Последние могут обменивать ионы в своем составе на другие ионы и тем самым обеспечивать прохождение последних через мембрану.
Пусть, например, ионообменная мембрана разделяет внутренний раствор № 2 иона А + с концентрацией С2 и внешний анализируемый раствор № 1 того же иона с концентрацией С1. В результате ионного обмена ион A + из внутреннего и внешнего растворов попадет в мембранную фазу. Разница в концентрации ионов A + в растворе и мембранной фазе приведет к появлению граничных потенциалов E1 и E2 на обеих поверхностях мембраны.
Основной проблемой, возникающей при использовании мембранных электродов в качестве индикаторных электродов, является их селективность (селективность). В идеальном случае функция электрода должна выражать зависимость только от определенного типа ионов АЗ +. Однако почти невозможно найти мембрану, через которую проходили только эти ионы. Как правило, другие ионы проходят через мембрану, влияя на ее потенциал. Селективность мембранного электрода обычно оценивают по коэффициенту селективности CA, V, который учитывает вклад посторонних ионов в величину потенциала электрода. Чем ниже К, тем меньше влияние посторонних ионов на мембранный потенциал, тем выше селективность мембранного электрода. С учетом коэффициента селективности значение мембранного потенциала рассчитывается по формуле Никольского.
В качестве индикаторных электродов используются только мембранные электроды с K 1, то относительно иона B. Для определения CA, B измеряется EM в растворах с постоянным содержанием B и уменьшением A. При некотором минимальном значении pa (A) линейный характер зависимости E = f (pa (A)) нарушается. Это означает, что потенциал электрода перестает зависеть от a (A), т.е. теряет свою электродную функцию от A и не различает ионы A и B. В точке пересечения линейных участков EA = EB и при ZA = ZB: a (A) / a (B) = KA, B. Чем меньше CA, B, тем выше селективность электрода по отношению к иону A.
Вывод:
Время отклика ионоселективного электрода характеризует время, необходимое для достижения постоянного потенциала электрода. Чем короче время отклика, тем лучше электрод. Может варьироваться от секунд до минут. Это зависит от природы мембраны и метода измерения (перенос электрода из разбавленного раствора в концентрированный или наоборот). Для большинства электродов потенциал находится в пределах 1 мин. достигает 90% от окончательного значения.
Решение IUPAC принято считать равным 0,00 В. Очевидно, что в этом случае измеренное значение ЭДС гальванического элемента, который включает водородный электрод, равно разности внутренних потенциалов второго электрода. Эту ЭДС обычно называют потенциалом электрода или окислительно-восстановительным потенциалом и обозначают буквой Е. Переход от внутренних потенциалов к окислительно-восстановительным потенциалам не меняет природу формулы Нернста.
Для большинства электродов значение потенциала электрода при отдельных активностях окисленной и восстановленной форм (E0) измеряется и приводится в справочниках.
При нормальных условиях и при переходе от натурального к десятичному логарифму пре-логарифмический фактор становится равным 0,0591, и формула принимает вид
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Вопрос29. Водородный электрод. Устройство и электродные процессы. Стандартный водородный электрод. Зависимость величины потенциала водородного электрода от рН среды
Измеряют относительную величину электродного потенциала, сравнивая его с потенциалом электрода, выбранного в качестве эталона.
В качестве такого электрода, называемого электродом сравнения, часто используют стандартный водородный электрод.
Водородный электрод состоит из платиновой пластинки, покрытой платиновой чернью (электролитически осажденной платиной), которая абсорбирует продуваемый через электрод газообразный водород. Пластина погружена в раствор кислоты.
На электроде устанавливается равновесие:
Водородный электрод, находящийся при стандартных условиях ([Н + ] = 1 моль/л, Р 0 = 101,3 кПа), называют стандартным водородным электродом, а потенциал такого электрода условно принят за ноль при любой температуре. Условная запись водородного электрода:
рН влияет на величину равновесного потенциала.
Это означает, что при изменении рН на единицу потенциал водородного электрода уменьшается на 59 мВ.
Чем кислее раствор, тем большую величину имеет потенциал водородного электрода.
Вопрос30. Гальванические элементы. Как можно практически определить электродный потенциал металла? От каких факторов зависит величина электродных потенциалов? Уравнение Нернста. Уравнение Нернста для металлических электродов при стандартных условиях.
Устройства, в которых энергия химической окислительно-восстановительной реакции превращается в электрическую энергию, называются источниками электрической энергии, или гальваническими элементами. Всякий гальван. элемент сост. из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом – обычно через пористую перегородку. Переход Ме из кристалла в раствор электролита в виде гидратированных ионов с оставлением эквивалентного количества е в кристалле, называется анодным процессом — процесс окисления. Обратным анодному является катодный процесс – объединение каких-либо частиц среды с электронами металла, с восстановлением частиц на поверхности металла. Электродвижущая сила Е(э.д.с.)-максимальное напряжение гальванического элемента, отвечающего обратимому протеканию происходящей в нем реакции. В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов: 1) от природы веществ –участников электродного процесса. 2) от соотношения м/у концентрациями этих веществ 3) от температуры системы. Эта зависимость выражается уравнением Нернста (В. Нернст, 1889г.): E=E 0 +RT*ln(aокисл формы/aвосстан формы)/n*F, где E 0 – стандартный электродный потенциал, n – число е, принимающих участие в о.-в. реакциях , F – число фарадея (96500), а – активность (эффективная или условная концентрация, в соответствии с которой ион действует при хим активности) а=f*C(Для разбавленных растворов a=C, f->1).Формула Нернста для Ме электрода при T=298K: EМе=E0+0.059*lnaМе+n/n
Вопрос31. Типы гальванических элементов. Химические, концентрационные и термогальванические элементы. Э.Д.С. гальванических элементов. Приведите примеры. Укажите процессы, протекающие на электродах, и рассчитайте ЭДС какого-либо химического гальванического элемента.
Устройства, в которых энергия химической окислительно-восстановительной реакции превращается в электрическую энергию, называются источниками электрической энергии, или гальваническими элементами. Всякий гальван. элемент сост. из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом – обычно через пористую перегородку. Переход Ме из кристалла в раствор электролита в виде гидратированных ионов с оставлением эквивалентного количества е в кристалле, называется анодным процессом — процесс окисления. Обратным анодному является катодный процесс – объединение каких-либо частиц среды с электронами металла, с восстановлением частиц на поверхности металла. Типы гальванических элементов: Химические – состоят из разных электродов, концентрационные – составлены из одинаковых электродов с разными концентр электролитов, термогальванические – одинаковые электроды, но при разных температурах. Медноцинковый элемент –Zn\ZnSO4\\CuSO4\Cu. ЭДС – Eк – Eа=1,1В. Процессы на аноде – окисление (Zn 0 – 2е = Zn +2 ), на катоде – восстановление (Cu +2 + 2е = Сu 0 ).
Водородный электрод: определение, устройство, формула и особенности
В приведенной ниже статье мы определим значение понятия «водородный электрод». Не все знают, что это такое. Здесь будет раскрыто его общее значение. Также мы уделим внимание реакциям окисления и восстановления, которые связанны с видом эксплуатации подобного предмета, и отдельно поговорим о запчастях, которые его образуют.
Введение
Стандартным водородным электродом называют электроды сравнения. Их используют в ходе измерений электрохимической природы. Также они находят свое применение в составе гальванических элементов. Водородный электрод (ВЭ) – это металлическая пластинка или проволока, которая хорошо поглощает водород в газообразном виде. Сама пластина погружается в водные растворы, насыщенные кислородом и содержащие в себе его ионы.
Этот элемент обладает потенциалом, который обуславливается концентрацией ионов H + в толще раствора. Электрод используют в качестве эталона, по которому определяют потенциал исследуемых химических реакций. Если давление водорода равное одной единице атм., а концентрация протонов соответствует соотношению 1 моль/л, то потенциал ВЭ считают равным нулю. Если использовать в качестве поверхности для определенной реакции платину, а также ВЭ и определяемый электрод, то можно наблюдать интересную реакцию, в ходе которой образуется стабильный атом водорода:
Другими словами, происходит восстановление или окисление атомов H. Тип реакции обуславливается потенциалом водородного электрода, на котором протекает реакция.
Проводя измерения ЭДС гальванических приспособлений с использованием стандартных условий (раствор, о котором мы говорили выше), всегда используют понятие стандартного потенциала электрода. Он определяется типом химической реакции.
Окисление и восстановление
Говоря о водородных электродах, мы упомянули понятие реакции окисления и восстановления, которые могут происходить с атомами водорода при использовании соответствующих электродов.
Восстановлением в химии называют явление, в ходе которого:
- Атомарная, ионная частица или молекула принимает (каждая) по одному и более электронов.
- Наблюдается снижение степени окисления определенных атомов в конкретной частице.
- Вещества органической природы утрачивают кислородные атомы и/или приобретают водородные.
Ранее восстановлением считалось только третье определение (с середины XIX века), в то время как первое и второе начали применяться лишь в 20-х годах прошлого столетия. На сегодняшний день полагается, что второе определение можно считать общим для всех восстановительных процессов в химии. При помощи третьего вида описания, чаще всего выделяют и распознают реакции окислительно-восстановительного характера.
Рассмотрим подробнее. Под окислением подразумевают процесс, который сопровождается постепенным увеличением атомной степени окисления определенного вещества. Это происходит посредством «транспортировки» электронов от атома-донора, отвечающего за отдачу e — , к акцепторному атому, который будет принимать e — .
Введение термина в научный и повседневный оборот языковых единиц обязано академику В. М. Севергину. Это нововведение было совершено на рубеже между XVII и XIX веком. Ученый обозначал этим термином процессы взаимодействия кислорода (содержащегося в воздухе) с другими веществами. Иногда реакции окисления могут приводить к образованию нестабильных частиц и их последующему распаду на более мелкие составные компоненты реакции.
Применение
Водородные электроды чаще всего используют для проведения работ по измерению стандартного потенциала электрохимического характера. Также применяют с целью определения уровня концентрации ионов водорода и любых иных видов ионов. Еще с использованием ВЭ проводят исследования, которые помогают узнать произведение растворимости по отношению к конкретизированному константу скорости в ходе некоторых электрохимических реакций.
Самыми важными требованиями к электроду сравнения считаются:
- Способность работать в температурных интервалах.
- Стабильность рабочего процесса.
- Способность воспроизводить результат реакции и исследования.
- Совместимость с исследуемым расплавом.
- Отсутствие стационарного потенциала.
Механизм устройства
Устройство стандартных водородных электродов включает в себя:
- Электрод из платины – элемент системы, который обладает способностью исключать загрязнение раствора посторонним рядом ионов в ходе протекания электролиза. Подобные детали не обладают чистыми участками поверхности (исключая сравнительно узкие районы потенциалов). Область реагирования веществ называют двойнослойной. Она характеризуется тем, что здесь соприкасаются только металл, ионы и растворитель. Причем последний пребывает в особом состоянии. В зависимости от значения потенциала, металл может покрываться водородом в абсорбированном виде (низкое значение) или оксидами (высокое значение).
- Электролитический мостик – средство для сообщения двух половин гальванической структуры механизма.
- Подводимое вещество газообразного водорода.
- Растворы кислоты (чаще HCl) с концентрацией катионов водорода: H + =1 моль/литр.
- Препятствующий проникновению молекул кислорода (из воздуха) затвор.
Потенциал
Вычислить потенциал водородного электрода по применению к отдельному электроду является невозможным. Однако подобное утверждение справедливо только для экспериментальных путей.
Потенциометрические средства, которые играют важную роль в вопросе о потенциале электрода, основываются на определении электродвижущей силы (ЭДС):
Где E – это определяемое ЭДС, а E1 и Е2 выступают в роли потенциала электродов цепи, которую исследуют.
Как же высчитать? Потенциал водородного электрода равен числу, которое можно определять при помощи уравнения Нернста:
- E0 – стандартное значение потенциала редокс-системы;
- R – постоянная газа, равная 8.312 Дж/(К моль);
- T – значение абсолютной температуры;
- F – постоянная Фарадея (96485Кл/моль);
- n – количество электронов, которые являются участниками реакции;
- aox и ared– показатели активности различных форм редокс-системы (соответственно окисление и восстановление);
- [ox] и [red] – молярная концентрация веществ, отвечающих за явление окисления или восстановления;
- Гамма [ox] и [red] – величина коэффициента активности.
Исторические данные
ВЭ характеризуется сложностью процесса эксплуатации. Однако стал известным и начал применяться довольно давно.
ВЭ были собственной конструкцией С. П. Л. Серенсена. Он использовал их в качестве центрального инструмента для своих исследований, которые позволили появиться современной теории pH-материи.
Дж. Ф. Макклендон использовал ВЭ в ряде первых опытов по исследованию pH-метрии внутри желудка. Как это происходило? Ученый использовал электрод сравнения, в который помещался водородный электрод. Последний вводился вместе с pH-зондом внутрь желудка человека.
http://lektsii.org/7-61047.html
http://www.syl.ru/article/375135/vodorodnyiy-elektrod-opredelenie-ustroystvo-formula-i-osobennosti