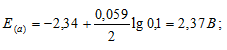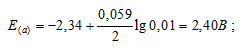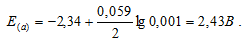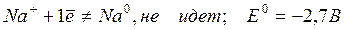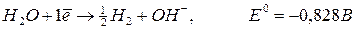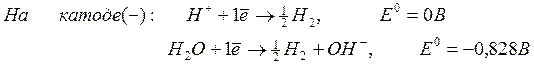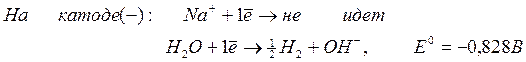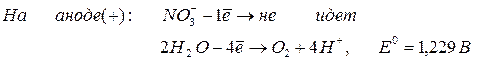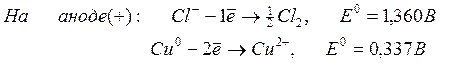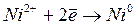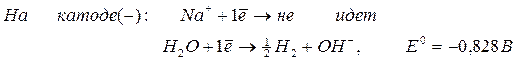Составление уравнений электродных процессов и суммарной реакции, происходящей при работе гальванического элемента
Задача 652.
Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с.?
Решение: 


H20 — 2 
Серебро, потенциал которой +0,80 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ag + + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим
H20 + 2Ag + = 2H + + 2Ag 0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:


Ответ: +0,80В.
Задача 653.
Э. д. с. гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1 М раствор соли свинца, равна 126 мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода? Составить схему элемента. Какие процессы протекают на его электродах?
Решение: 
Pb 0 — 2 
А на водородном – восстановительный:
2H + + 2 
Таким образом, свинцовый электрод будет анодом, а водородный – катодом.
Уравнение окислительно-восстановительного процесса, протекающего при работе данного гальванического элемента, можно получить, сложив электронные процессы на электродах:
Pb 0 + 2H + = Pb 2+ + H2 0
Для расчета электродного потенциала свинца, можно использовать уравнение определения ЭДС гальванического элемента:
E = 

Подставив в уравнение данные задачи, получим:
Е = 



Ответ: -0,126В.
Задача 654.
Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 2+ 0,1, 0,01 и 0,001 молы/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация (при точных измерениях активность) гидратированных ионов металла в растворе. Е 0 для магния равен -2,34 В.
Определим электродные потенциалы магния в растворах при разных значениях концентрации его ионов:
а) Mg 2+ = 0,1 молы/л.
б) Mg 2+ = 0,01 молы/л.
в) Mg 2+ = 0,001 молы/л.
Ответ: а) 2,37 В; б) 2,40 В; в) 2,43 В.
Правила записи реакций на электродах при электролизе
Для того, чтобы написать уравнение электрохимической реакции, идущей на электроде, необходимо записать все теоретически возможные электрохимические реакции на данном электроде. Затем по величине стандартного электродного потенциала в ряду напряжений следует выбрать наиболее вероятную реакцию для данного электрода. Наиболее вероятной будет та электрохимическая реакция, стандартный электродный потенциал которой (Е 0 ) будет самым маленьким по абсолютному значению.
Существуют эмпирические правила записи реакций на электродах при электролизе:
1. Все кислоты на катоде из любого материала разряжаются с выделением газообразного водорода:
2. Щелочные и щелочноземельные металлы (Li + , Na + , K + , Ca 2+ , Ba 2+ , Mg 2+ ) из водных растворов на катоде не выделяются из-за высокого потенциала разложения:
При электролизе водных растворов щелочных и щелочноземельных металлов на катоде идет выделение газообразного водорода из воды:
3. Все кислородсодержащие анионы ( 
При электролизе кислородсодержащих анионов на аноде идет выделение кислорода из воды:
4. Если анод изготовлен из растворимого металла (Сu 2+ , Zn 2+ , Cd 2+ , Pb 2+ , Co 2+ , Sn 2+ , Ag + ), то при электролизе происходит растворение материала анода:


Пример 5.6. Электролиз водного раствора соляной кислоты на инертных (Pt) электродах. Запишем все теоретически возможные электрохимические реакции на электродах и выберем наиболее вероятную:
Так как потенциал выделения водорода из протонов меньше, чем из молекул воды, то на катоде протекает реакция: 
Так как стандартные потенциалы выделения хлора и кислорода близки, следовательно, возможны обе реакции в зависимости от материала анода. На платиновом аноде преимущественно идет реакция выделения хлора: 
Суммарная реакция на электродах при электролизе водного раствора соляной кислоты:

Пример 5.7. Электролиз водного раствора нитрата натрия на инертных (Pt) электродах. Запишем все теоретически возможные электрохимические реакции на электродах и выберем наиболее вероятную:
Так как щелочные металлы на катоде не выделяются, идет выделение водорода из воды по реакции: 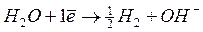
Так как кислородсодержащие анионы на аноде не разряжаются, идет выделение кислорода из воды по реакции: 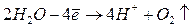
Суммарная реакция на электродах при электролизе водного раствора нитрата натрия – электролиз воды:

Пример 5.8. Электролиз водного раствора хлорида меди на медных электродах. Запишем все теоретически возможные электрохимические реакции на электродах и выберем наиболее вероятную:
Так как потенциал выделения меди меньше потенциала выделения водорода из воды, то на медном катоде будет выделяться медь по реакции: 
Так как потенциал растворения медного анода меньше потенциала выделения хлора, то медный анод будет растворяться по реакции: 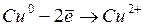
Суммарная реакция на электродах при электролизе хлорида меди – медь с анода переходит в раствор, и выделяется на катоде:

Законы Фарадея
Между количеством прошедшего через раствор электричества и количеством вещества, прореагировавшего на электроде, существуют определенные соотношения, выраженные законами Фарадея.
Первый закон Фарадея: масса вещества (m), прореагировавшего на электроде, пропорциональна количеству электричества (Q), прошедшего через раствор:

где kэ –электрохимический эквивалент (масса прореагировавшего вещества при протекании единицы количества электричества, г/A×c или г/А×ч).
Второй закон Фарадея: при прохождении через различные электролиты одного и того же количества электричества массы прореагировавших на электроде веществ, пропорциональны их молярным массам эквивалентов (Мэкв):
Из второго закона Фарадея следует, что для электрохимического превращения 1 моль-экв. любого вещества требуется одинаковое количество электричества F, которое называетсяпостоянной Фарадея (F = 96485 кулон).
Уравнение, объединяющее оба закона Фарадея:
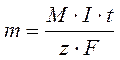
где М – молярная масса вещества; I – сила тока; t – время электролиза; z – число электронов, участвующих в электрохимической реакции.
Законы Фарадея являются общими и точными законами электрохимии. Однако при электрохимических процессах часто наблюдаются отклонения от этих законов: масса mддействительно полученного или разложившегося продукта не соответствует теоретической mТ, вычисленной по законам Фарадея. Эти отклонения – кажущиеся, они возникают за счёт одновременного протекания побочных электрохимических или химических процессов. Эффективность основного электрохимического процесса оценивается выходом по току:
В = 

Для измерения количества прошедшего электричества используются электролизеры, в которых нет параллельных электрохимических и побочных химических реакций. Они называются кулонометрами. По методам определения количества образующихся веществ кулонометры делятся на весовые, объемные, титрационные и др.
Например, действие серебряного кулонометра, представляющего собой электролизер с двумя серебряными электродами, погруженными в раствор нитрата серебра,
основано на взвешивании массы серебра, осевшей на катоде во время электролиза по реакции:
При пропускании одного Фарадея электричества на катоде выделяется один моль-эквивалент cеребра, равный 108 г.
Пример 5.9.Металлический предмет, поверхностью 100 см 2 , требуется покрыть никелем слоем в 0,3 мм. Плотность никеля 9,0 г/см 3 . Сколько времени требуется пропускать ток силой 3 А, если 10% тока теряется в аппарате для электролиза?
Решение:
При электролизе на катоде протекает реакция:
1. Определим массу никеля, необходимую для покрытия:


2. По закону Фарадея найдем необходимое количество электричества:

3. При силе тока в 3 А потребуется время электролиза:
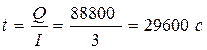
4. Учтем 10% возможных потерь:
t¢ = 
Пример 5.10. При электролизе раствора NaCl на платиновых электродах получено 400 мл раствора, содержащего 18 г NaOH. За это же время в медном кулонометре, включенном параллельно с электролизером, выделилось 20,2 г меди. Вычислите выход по току.
Решение: Запишем все теоретически возможные электрохимические реакции на электродах и выберем наиболее вероятную:
1. При электролизе водного раствора хлорида натрия на электродах идут реакции:
Так как щелочные металлы на катоде не выделяются, идет выделение водорода из воды по реакции: 
Так как стандартные потенциалы выделения хлора и кислорода близки, следовательно, возможны обе реакции в зависимости от материала анода. На платиновом аноде преимущественно идет реакция выделения хлора: 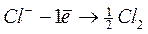
В результате выделения водорода и хлора в газовую фазу в растворе остаются ионы Na + и OH ¯ (NaOH).
2. Рассчитаем теоретическую массу гидроксида натрия, полученного в результате электролиза по второму закону Фарадея:


3. Рассчитаем выход по току:
В = 

Числа переноса
Числом переноса ионовназывается доля количества электричества, переносимая данным видом ионов, по отношению к общему количеству электричества, прошедшему через раствор:

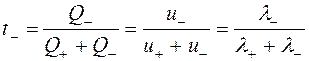
где t+ и t– – число переноса катиона и аниона.

К методам определения чисел переноса относят метод Гитторфа, основанный на определении изменения концентрации электролита в результате электролиза в катодном или анодном пространстве, а также метод движущейся границы, основанный на измерении изменения положения перемещающейся границы.
Вопросы для самоконтроля
1. Чем отличаются удельная и молярная электрические проводимости? Их зависимости от концентрации электролита.
2. В чем заключается практическое использование метода кондуктометрии?
3. Приведите примеры по применению электролиза.
Электродвижущие силы
Электрохимических элементов
Основные понятия и определения
Электрохимические элементы – это устройства для получения электрического тока за счет самопроизвольного протекания электрохимических реакций на электродах.
Электрод в электрохимическом элементе есть двух- или трехфазная система, состоящая из окисленной и восстановленной форм одного и того же вещества, находящихся в равновесии. Следовательно, электрод– электрохимическая система, состоящая из веществ, обладающих различными видами проводимости и находящихся в контакте друг с другом.
При переходе заряженных частиц (ионы, электроны) через границу раздела двух фаз, например, раствор электролита – металл, возникает электрохимическая реакция. В результате этого металл и раствор приобретают электрический заряд, и на границе их раздела создаётся двойной электрический слой, которому соответствуетскачок потенциала.
Электродные процессы представляют собой окислительно-восстановительные реакции. На отрицательном электроде идет процесс окисления: 

Различают обратимыеи необратимыеэлектроды. При перемене направления электрического тока на обратимых электродах возникают реакции, противоположные по направлению, на необратимых – протекают другие реакции.
Примером обратимого электрода служит электрод, состоящий из металлической меди, погруженный в раствор, содержащий ионы Cu 2+ . При прохождении тока в противоположных направлениях идут реакции:
К необратимым электродам относится, электрод, состоящий из металлической меди в растворе кислоты. Перемена направления тока приводит к реакциям:
Из обратимых электродов могут быть составлены обратимые электрохимические элементы(гальванические элементы).
Электролиз
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
http://lektsia.com/5×7176.html
http://chemege.ru/electrolysis/