Напишите уравнение реакции диссоциации гидроксида стронция?
Химия | 5 — 9 классы
Напишите уравнение реакции диссоциации гидроксида стронция.
Sr(oh)2 = sr(2 + ) + 2OH( — ).
1. напишите уравнения реакций взаимодействия лития и стронция с водой, если при этом образуется водород и соответствующий гидроксид?
1. напишите уравнения реакций взаимодействия лития и стронция с водой, если при этом образуется водород и соответствующий гидроксид.
2. напишите уравнения возможных реакций между бромоводородной кислотой и металлами : а)Fe ; б)Au ; в)K ; г)Ba.
Напишите уравнение процессов диссоциации фосфорной кислоты, гидроксида калия и сульфата алюминия?
Напишите уравнение процессов диссоциации фосфорной кислоты, гидроксида калия и сульфата алюминия.
Уравнения реакций 1?
Уравнения реакций 1.
Фосфорной кислоты и гидроксида кальция 2.
Дихромовой кислоты и гидроксида стронция.
Напишите реакции электролитической диссоциации следущих вещест : а)Сульфат натрия в)гидроксид калия с)хлорид кальция?
Напишите реакции электролитической диссоциации следущих вещест : а)Сульфат натрия в)гидроксид калия с)хлорид кальция.
Напишите уравнения реакций электролитической диссоциации гидроксида бериллия?
Напишите уравнения реакций электролитической диссоциации гидроксида бериллия.
Напишите реакции получения и докажите амфотерность гидроксида : олова (II), напишите диссоциацию амфотерного гидроксида : олова (II)?
Напишите реакции получения и докажите амфотерность гидроксида : олова (II), напишите диссоциацию амфотерного гидроксида : олова (II).
Напишите уравнения процессов диссоциации ортофосфорной кислоты, гидроксида калия и сульфата алюминия?
Напишите уравнения процессов диссоциации ортофосфорной кислоты, гидроксида калия и сульфата алюминия.
Уравнение диссоциации гидроксида кадмия?
Уравнение диссоциации гидроксида кадмия.
Напишите название и формулу гидроксида Cl, составьте уравнения диссоциации гидроксида?
Напишите название и формулу гидроксида Cl, составьте уравнения диссоциации гидроксида.
Напишите уравнения электролитической диссоциации Гидроксида калия и нитрата меди (II)?
Напишите уравнения электролитической диссоциации Гидроксида калия и нитрата меди (II).
Вопрос Напишите уравнение реакции диссоциации гидроксида стронция?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 5 — 9 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Дано : I = 5A m(Cr) = 0, 16 r F = 96500 Кл / моль t — .
Вот и всё последовательность разберёте.
Фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
V2O5 + 5Ca — > 5CaO + 2 V KOH + HCl — > KCl + H2O.
Cao кислотный оксид koh основание cuso4 соль so2 кислотный оксид h3po4 кислота.
M = 160 (г) M(Al(NO3)3) = 27 + 3 * 14 + 9 * 16 = 213 (г / моль) n = m / M = 160 / 213 = 0. 75 (моль) N = Na * n, гдеNa — число Авогадро = 6. 02 * 10 ^ 23 (молекул / моль) N = 6. 02 * 10 ^ 23 * 0. 75 = 4. 515 * 10 ^ 23 (молекул).
Ну если бы не зарубежные, то тогда о химии не узнали бы зарубежные люди, а наши ученые изобрели химию, если бы не они, ее бы и не было.
4)HCl + Fe(OH)2 = FeCl2 + H2O.
Метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан. Каждый раз на один углерод больше. Изомеры : сначала находите главную цепь (в той, которой больше углеродов), для удобства ее можно обвести, затем смотрите какие есть ответвле..
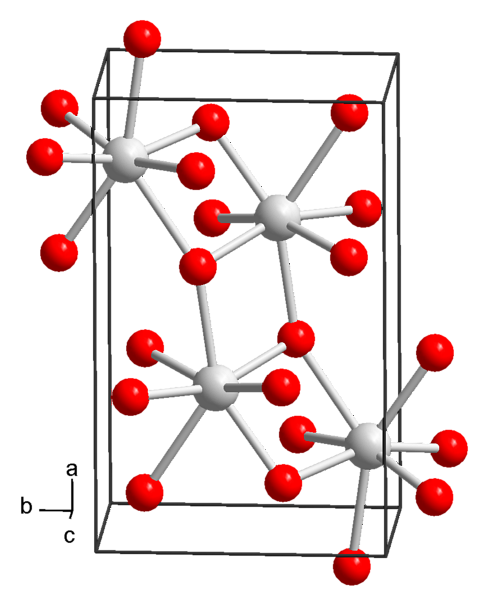
Гидроксид стронция (Sr (OH) ₂) химическая структура, свойства и применение
гидроксид стронция (Sr (OH) ₂) — неорганическое химическое соединение, состоящее из иона стронция (Sr) и двух ионов гидроксида (OH). Это соединение получают путем объединения соли стронция с сильным основанием, в результате чего получается соединение щелочной природы, химическая формула которого Sr (OH)2.
Обычно гидроксид натрия (NaOH) или гидроксид калия (KOH) используют в качестве сильного основания для получения гидроксида стронция. С другой стороны, солью стронция (или ионом стронция), который реагирует с сильным основанием, является нитрат стронция Sr (NO3)2 и процесс описывается следующей химической реакцией:
В растворе катион стронция (Sr + ) приводится в контакт с гидроксид-анионом (ОН — ) образуя основную ионную соль стронция. Поскольку стронций является щелочноземельным металлом, гидроксид стронция считается едким щелочным соединением.
- 1 Получение
- 2 Химическая структура и физико-химические свойства
- 2.1 Октагидрат гидроксида стронция
- 2.2 Моногидрат гидроксида стронция
- 2.3 Безводный гидроксид стронция
- 2.4 Растворимость
- 2.5 Химическая реактивность
- 3 использования
- 3.1 Извлечение мелассы и рафинирование сахарной свеклы
- 3.2 Стронциевые жиры
- 3.3 Пластиковый стабилизатор
- 3.4 Другие приложения
- 4 Ссылки
получение
В дополнение к описанному ранее процессу можно сказать, что после проведения реакции Sr (OH)2 осаждается в растворе. Затем его подвергают процессу стирки и сушки, в результате чего получают очень тонкий белый порошок..
Альтернативный способ получения гидроксида стронция заключается в нагревании карбоната стронция (SrCO)3) или сульфат стронция (SrSO)4) с паром при температуре от 500 до 600 ° С Химическая реакция происходит, как показано ниже:
Химическая структура и физико-химические свойства
В настоящее время известны 3 формы гидроксида стронция: октагидрат, моногидрат и безводный..
Октагидрат гидроксида стронция
Из растворов при нормальных условиях температуры и давления (25 ° C и 1 атм) гидроксид стронция осаждается в октагидратированной форме, химическая формула которой Sr (OH)2H 8H2О.
Это соединение имеет молярную массу 265,76 г / моль, плотность 1,90 г / см и осаждается в виде тетрагональных кристаллов (с пространственной группой P4 / ncc) четырехугольного и бесцветного призматического вида..
Кроме того, октагидрат гидроксида стронция обладает способностью поглощать атмосферную влагу, так как является легко растекающимся соединением..
Моногидрат гидроксида стронция
По данным оптических микроскопических исследований (выполненных с использованием техники дифракции рентгеновских лучей), путем повышения температуры примерно до 210 ° С — при постоянном атмосферном давлении — Sr (OH)2H 8H2Или он обезвоживается и превращается в моногидрат гидроксида стронция (Sr (OH)2∙ H2O).
Эта форма соединения имеет молярную массу 139,65 г / моль, а его температура плавления составляет -73,15 ° С (375 К). Из-за своей атомной конфигурации он обладает более низкой растворимостью в воде, чем описано в октагидратированной форме..
Безводный гидроксид стронция
Продолжая повышать температуру системы до примерно 480 ° С, дегидратацию продолжают до тех пор, пока не будет получен безводный гидроксид стронция..
В отличие от его гидратированных форм, он имеет молярную массу 121,63 г / моль и плотность 3,625 г / см. 3 . Его температура кипения достигается при 710 ° C (1310 ° F или 983 K), в то время как температура плавления составляет 535 ° C (995 ° F или 808 K)..
растворимость
Октагидратированный гидроксид стронция имеет растворимость в воде 0,91 грамма на 100 миллилитров (измерено при 0 ° C), в то время как его безводная форма при аналогичных температурных условиях имеет растворимость 0,41 грамма на 100 миллилитров..
Таким же образом, это вещество считается нерастворимым в ацетоне и полностью растворимым в кислотах и хлориде аммония..
Химическая реактивность
Гидроксид стронция не горюч, его химическая реакционная способность остается стабильной при умеренных температурах и давлениях и способен поглощать диоксид углерода из атмосферного воздуха, превращая его в карбонат стронция..
Кроме того, это сильно раздражающее соединение, если оно вступает в контакт с кожей, дыхательными путями или другими слизистыми оболочками тела..
приложений
Благодаря своим гигроскопическим характеристикам и основным свойствам, гидроксид стронция используется для различных применений в промышленности:
- Извлечение мелассы и рафинирование сахара из свеклы.
- Пластиковый стабилизатор.
- Смазки и смазки.
Извлечение мелассы и рафинирование сахарной свеклы
В начале XXI века гидроксид стронция использовался в Германии для рафинирования сахара из свеклы по технологии, запатентованной Карлом Шейблером в 1882 году..
Этот процесс состоит из смешивания гидроксида стронция и сахарной пульпы свеклы, что приводит к нерастворимому дисахариду. Этот раствор отделяют декантированием, и после завершения процесса рафинирования в качестве конечного продукта получают сахар..
Несмотря на то, что эта процедура все еще используется сегодня, существуют другие методы с гораздо большим спросом, потому что они дешевле, которые используются на подавляющем большинстве мировых сахарных заводов. Например, метод Барсил, в котором используется силикат бария, или метод Штеффена с использованием Cal в качестве экстрактора.
Стронциевые смазки
Это смазки, содержащие гидроксид стронция. Они способны прочно сцепляться с поверхностями с металлическими характеристиками, устойчивы к воде и выдерживают резкие перепады температур.
Благодаря хорошей физической и химической стабильности эти жиры используются в качестве промышленных смазочных материалов..
Пластиковый стабилизатор
Подавляющее большинство пластмасс при воздействии климатических факторов, таких как солнце, дождь и атмосферный кислород, изменяют их свойства и ухудшают качество.
Из-за значительной устойчивости к воде в эти полимеры добавляется гидроксид стронция — во время фазы плавления — выступает в качестве стабилизатора при производстве изделий из пластмасс для продления срока их службы..
Гидроксид стронция: способы получения и химические свойства
Гидроксид стронция Sr(OH)2 — неорганическое соединение. Белый, плавится без разложения, при дальнейшем нагревании разлагается. Умеренно растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 121,63; относительная плотность для тв. и ж. состояния d = 3,625; tпл = 460º C.
Способы получения
1. Гидроксид стронция получают в результате взаимодействия насыщенного нитрата стронция и насыщенного гидроксида натрия при комнатной температуре, на выходе образуется нитрат натрия и гидроксид стронция:
2 . При взаимодействии стронция с водой при комнатной температуре образуется гидроксид стронция и водород:
3. Оксид стронция при взаимодействии с водой при комнатой температуре образует гидроксид стронция:
Качественная реакция
Качественная реакция на гидроксид стронция — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид стронция взаимодействует со сложными веществами :
1.1. Гидроксид стронция реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом стронция и разбавленной соляной кислотой образуется хлорид стронция и вода:
1.1.2. Гидроксид стронция взаимодействует с концентрированной серной кислотой, образуя сульфат стронция и воду:
1.1.3. В результате взаимодействия гидроксида стронция и разбавленной фосфорной кислоты образуется фосфат стронция и вода:
1.1.4. С насыщенным и холодным гидроксидом стронция реагирует горячая сероводородная кислота , образуя сульфид стронция и воду:
1.1.5. Гидроксид стронция вступает во взаимодействие с концентрированной плавиковой кислотой с образованием фторида стронция и воды:
1.2. Гидроксид стронция взаимодействует с оксидами:
1.2.1. В результате взаимодействия гидроксида стронция и углекислого газа образуется карбонат стронция и вода:
если с углекислым газом реагирует карбонат стронция в виде суспензии, то образуется гидрокарбонат стронция в растворе:
1.2.2. Гидроксид стронция вступает в реакцию с оксидом серы (IV) , образуя на выходе сульфит стронция и воду:
если с оксидом серы (IV) взаимодействует гидроксид стронция в виде суспензии, то на выходе происходит образование гидросульфита стронция в растворе:
2. Гидроксид стронция разлагается при температуре 520 — 580º С, образуя на выходе оксид стронция и воду:
http://ru.thpanorama.com/articles/qumica/hidrxido-de-estroncio-sroh-estructura-qumica-propiedades-y-usos.html
http://chemege.ru/gidroksid-stronciya/