Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Диссоциация карбонатов и оксидовРазличные карбонаты и оксиды используются в качестве флюсующих добавок и для изготовления огнеупорных материалов. Диссоциация карбонатов различных металлов происходит при их нагревании по обратимой реакции общего вида Реакция протекает в неоднородной системе. Если диссоциация карбоната происходит без образования твердых растворов, то равновесная система состоит из двух твердых фаз (МеСО3 и МеО) одной газообразной (СО2), то есть количество фаз в системе Ф=3. Система двухкомпонентна (три вещества в системе минус одно уравнение, связывающее их). Принимая в выражении правила фаз число независимых факторов n = 2, получим число степеней свободы системы С = 2-3+2=1, то есть система одновариантная. Равновесное состояние такой системы обуславливается давлением СО2. Одновариантность системы означает, что каждой температуре должно соответствовать вполне определенное давление СО2 Вид данной функции можно получить из уравнения константы равновесия реакции Активности чистых твердых веществ примерно равны единице, и практически Величина Количественное соотношение конденсированных веществ, образующих твердую фазу, не оказывает влияния на соотношение между температурой и равновесным давлением СО2. Если в равновесную систему вводят или из неё удаляют углекислый газ, то в первом случае развивается реакция образования карбоната, во втором — его диссоциации. В обоих случаях давление СО2 изменяется до величины, которая для данной температуры является равновесной. Равновесное парциальное давление двуокиси углерода в реакции образования или диссоциации углекислого соединения называется упругостью диссоциации карбоната. При отсутствии в системе твердых растворов она является функцией только температуры и эквивалентна константе равновесия. При образовании твердых растворов переменой концентрации система будет состоять из одной твердой фазы (твердый раствор карбоната и оксида или твердый раствор карбоната и металла) и одной газообразной фазы (СО2), то есть Ф = 2. Согласно правилу фаз: С = 2-2+2=2, то есть система двухвариантная. При образовании твердых растворов, кроме температурной зависимости, появляется дополнительная зависимость состояния равновесия от концентрации раствора Зависимость Рис. 7. Зависимость упругости диссоциации карбоната График Если при температуре Та Если процесс идет при постоянном давлении Процесс диссоциации оксидов аналогичен диссоциации карбонатов. Описывается процесс уравнением реакции в общем виде Если диссоциация оксида происходит без образования твердых растворов, то равновесная система состоит из двух твердых фаз (МеО и Ме) одной газообразной (О2), то есть количество фаз в системе Ф=3. Система двухкомпонентна. Число степеней свободы системы С=1 — система одновариантная. Равновесное состояние такой системы обуславливается давлением О2. Одновариантность системы означает, что каждой температуре должно соответствовать вполне определенное давление кислорода Вид данной функции можно получить из уравнения константы равновесия реакции Принимая активности чистых твердых веществ равными единице, получаем Величина Равновесное парциальное давление кислорода в реакции образования или диссоциации оксида называется упругостью диссоциации оксида. При отсутствии в системе твердых растворов она является функцией только температуры и эквивалентна константе равновесия. При образовании твердых растворов переменой концентрации система будет двухвариантная, то есть кроме температурной зависимости, появляется дополнительная зависимость состояния равновесия от концентрации раствора Пример. В качестве примера проведем анализ условий конденсатной диссоциации оксида алюминия Al2O3 при температурах выше температуры плавления алюминия (температура плавления алюминия 931,7К). Конденсатная диссоциация оксида алюминия (диссоциация с образованием металлического алюминия) описывается реакцией: Для этой реакции изменение изобарно-изотермического потенциала в интервале температур 923…1800К определяется соотношением: Согласно закону действующих масс константа равновесия реакции определяется следующим образом Так как активности конденсированных веществ обычно принимают равными единице, то Энергия Гиббса и константа равновесия реакции связаны между собой соотношением Подставив значение газовой постоянной и выполнив переход к десятичному логарифму, получим: Отсюда получаем уравнение для расчета давления конденсатной диссоциации Al2O3 при температурах выше 931,7К. Оно имеет вид Величины давления конденсатной диссоциации оксида алюминия, вычисленные по полученному уравнению, для температур 932К и 1173К составляют 10 -47 Па и 10 -34 Па соответственно. Таким образом, с повышением температуры равновесное давление конденсатной диссоциации оксида алюминия повышается, но в реальных условиях оно не может быть реализовано. Следовательно, конденсатная диссоциация Al2O3 в реальных условиях невозможна. Анализ условий диссоциации закиси железа FeO и оксида никеля NiO, выполненные аналогично диссоциации оксида алюминия, показал, что равновесное давление кислорода при 1300К для диссоциации этих оксидов составляет 10 -9,4 Па. Согласно экспериментальным данным по исследованию состава газовой фазы при диссоциации NiO, конденсатная диссоциация возможна при температурах выше 1475К, при более низких температурах диссоциация NiO происходит конгруэнтно (в газовую фазу преимущественно переходит Ni). Незначительное развитие имеет реакция NiOтв.=Ni2+O2. Таким образом, термодинамическая оценка процессов диссоциации соответствует экспериментальным данным. Их сопоставление позволяет сделать вывод, что в равновесных условиях диссоциация низших оксидов никеля и железа при температурах выше 1400К возможна по механизму газовой диссоциации. При более низких температурах удаление оксидов с поверхности стальных, никелевых, железо-никелевых и железо-никель-кобальтовых сплавов должно протекать по другим механизмам. Дата добавления: 2014-12-05 ; просмотров: 3560 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ источники: http://acetyl.ru/o/nal12c1o33.php http://helpiks.org/1-31636.html |










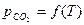 .
.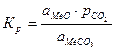 .
.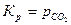 .
.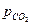 является количественной характеристикой полноты завершения обратимого превращения карбоната.
является количественной характеристикой полноты завершения обратимого превращения карбоната.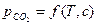 .
.





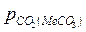 от температуры
от температуры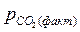 >
> 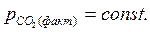 , например, при атмосферном, то этому давлению соответствует равновесная температура Тр. Если Т1 > Тр (точка 1), то
, например, при атмосферном, то этому давлению соответствует равновесная температура Тр. Если Т1 > Тр (точка 1), то 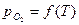 .
.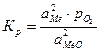 .
.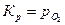 .
.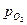 является количественной характеристикой полноты завершения обратимого превращения оксида. Если в равновесную систему вводят кислород, то идет окисление металла. Если из неё удаляют кислород, то происходит диссоциация оксида. В обоих случаях давление кислорода изменяется до величины, которая для данной температуры является равновесной.
является количественной характеристикой полноты завершения обратимого превращения оксида. Если в равновесную систему вводят кислород, то идет окисление металла. Если из неё удаляют кислород, то происходит диссоциация оксида. В обоих случаях давление кислорода изменяется до величины, которая для данной температуры является равновесной.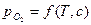 .
.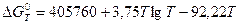 .
.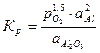 .
.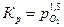 .
.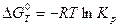 . Для рассматриваемой реакции:
. Для рассматриваемой реакции: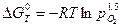 .
.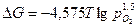 .
.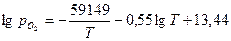 .
.