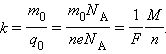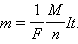Уравнение электролитической диссоциации медного купороса
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований .
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза .
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду ( катоду ), отрицательные ионы – к положительному электроду ( аноду ). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией . Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
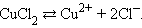 |
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис 1.15.1).
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
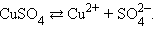 |
Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион 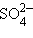
| SO4 + Cu = CuSO4. |
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
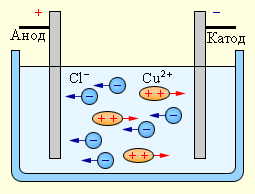 | |||||||
| Рисунок 1.15.1. Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов , выделяющихся на электродах при электролизе: Масса вещества, выделившегося на электроде, прямо пропорциональна заряду , прошедшему через электролит:
Величину называют электрохимическим эквивалентом . Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
Здесь 0 и 0 – масса и заряд одного иона, Так как заряд иона равен произведению валентности вещества на элементарный заряд (0 = ), то выражение для электрохимического эквивалента можно записать в виде
Здесь A – постоянная Авогадро, = 0A – молярная масса вещества, = A – постоянная Фарадея .
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества. Закон Фарадея для электролиза приобретает вид:
Явление электролиза широко применяется в современном промышленном производстве. Напишите уравнения электролитической диссоциации: а) нитрата меди(ii); б) соляной кислоты; в) сульфата алюминия; г) гидроксида бария; д) сульфата цинкаВаш ответрешение вопросаПохожие вопросы
Популярное на сайте: Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах. Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте. Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так. Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью. Схема диссоциации сульфата медиСкачать | |||||||
| Схема электролиза сульфата меди >> |
Схема диссоциации сульфата меди. + -. — +. — +. H2O. CuSO4=Cu2+ + SO42-. SO42-. Cu2+. Cu2+. SO42-. SO42-. Cu2+. Cu2+.
Слайд 4 из презентации «Процесс электролитической диссоциации». Размер архива с презентацией 73 КБ.
Химия 11 класс
«Производные карбоновых кислот» — Сложные эфиры минеральных кислот. Метанамид. Метановая (муравьиная) кислота. Амиды. Гидролиз сложных эфиров. Эфиры серной кислоты. Уходящий нуклеофил. Продукты замещения карбоновых кислот. Кетон. Химические свойства сложных эфиров и амидов. Сложные эфиры. Кислотный гидролиз. Гидролиз амидов. Функциональные производные карбоновых кислот. Этерификация. Обратимый процесс. Эфиры фосфорной кислоты. Катализатор.
«Способы защиты от коррозии металлов» — Металлы (например, алюминий) при коррозии покрываются плотной, оксидной пленкой. Нанесение защитных покрытий. Коррозия металлов. Электрохимические методы защиты. Способы защиты от коррозии. Значительно усиливает коррозию повышение температуры. Электрохимическая коррозия. Гидроксид железа(III) очень неустойчив. Рассмотрим разрушение железного образца в присутствии примеси олова. В результате коррозии железо ржавеет.
«Процесс электролитической диссоциации» — Масса вещества. Критерии оценивания. Майкл Фарадей. Масса, выделившегося вещества. Электрический ток. Схема диссоциации сульфата меди. Интегрированный урок по химии и физике. Применение электролиза. Схема электролиза сульфата меди. Распад молекул электролитов. Электролитическая диссоциация. Исследование электропроводности жидкостей.
«Внеклассное мероприятие по химии» — Получение газов — аппарат Киппа. Что готовили во Франции из оливкового масла третьего отжима и соды. Метан. Что можно доказать, используя данное оборудование. Этот элемент называют королем живой природы. Получение газов. Формулы. Выдающийся естествоиспытатель древности Плиний Старший. Петр Великий говорил: “Я предчувствую, что Россияне, когда–нибудь, а. Придумайте четверостишия. Вам не обойтись без темно-синих кристаллов.
«Роль химии в жизни общества» — Парфюмерная промышленность. Производство бумаги. Дела человеческие. Полимеры в медицине. Всемогущая химия. Химия служит человеку. Бытовая химия. Производство стекла. Производство строительных материалов. Роль химии в жизни общества. Развитие многих отраслей промышленности. Фармацевтическая промышленность. Производство металла.
«Химия и производство» — Химический состав стекла. Химический состав. Физические свойства стекла. Важнейшие составляющие химического производства. Применение. Основные функции воды в химической промышленности. Химическая промышленность в повседневной жизни. Химическая промышленность и химическая технология. Некоторые химические производства. Чугун. Сокращение расхода воды. Цемент. Крекинг. Научные принципы организации производств.
Всего в теме «Химия 11 класс» 35 презентаций
http://www.soloby.ru/469099/%D0%BD%D0%B0%D0%BF%D0%B8%D1%88%D0%B8%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9-%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D0%B8-%D0%B3%D0%B8%D0%B4%D1%80%D0%BE%D0%BA%D1%81%D0%B8%D0%B4%D0%B0
http://5klass.net/khimija-11-klass/Protsess-elektroliticheskoj-dissotsiatsii/004-Skhema-dissotsiatsii-sulfata-medi.html
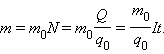
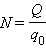 – число ионов, пришедших к электроду при прохождении через электролит заряда . Таким образом, электрохимический эквивалент равен отношению массы 0 иона данного вещества к его заряду 0.
– число ионов, пришедших к электроду при прохождении через электролит заряда . Таким образом, электрохимический эквивалент равен отношению массы 0 иона данного вещества к его заряду 0.