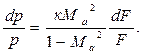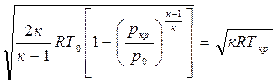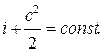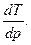ТЕРМОДИНАМИКА ГАЗОВОГО ПОТОКА
4.1. Уравнения и параметры движущегося газа
В рассмотренных выше процессах не учитывалась кинетическая энергия рабочего тела. Однако в теплотехнике широко распространены энергетические установки, в которых преобразование энергии осуществляется в движущемся газе. Такие процессы происходят в турбинах, реактивных двигателях, лопаточных и струйных компрессорах и т.п.
Рассмотрим уравнения термодинамики для стационарного одномерного потока идеального газа.
Для газового потока в любом сечении справедливо уравнение состояния, записанное через плотность:
где p – давление в рассматриваемом сечении;
ρ – плотность газа в этом сечении;
R – газовая постоянная;
T – термодинамическая температура (температура, которую покажет в данном сечении безинерционный термометр, перемещающийся со скоро-стью газового потока).
В термодинамике величину скорости потока газа обозначают с и измеряют в м/с. Часто с целью количественной оценки величины скорости потока ее сравнивают со скоростью распространения слабых возмущений в среде газа. При выведении газа из равновесия в каком-либо месте в нем возникает движение частиц. Эти возмущения передаются по всему газу (подвижному и неподвижному) с так называемой с к о р о с т ь ю з в у к а. Скорость звука обозначается a, измеряется в м/с и вычисляется поизвестной из физики формуле:
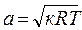
Если c 
4.1.1. Уравнение энергии
В движущемся газе выделим сечениями 1-1 и 2-2, Рис. 4.1, участок потока.
На основании первого закона термодинамики для энергоизолирован- ного потока (данная система не обменивается теплотой и работой с окружающей средой) можем записать Е1 = Е2. Отсюда для m = 1кг газа уравнение (1.7) в сечениях потока будет иметь вид:
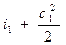
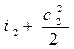
Это означает, что для любого сечения потока газа сумма энтальпии и кинетической энергии одинакова, т.е.
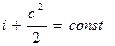
Выражение (4.3) называют у р а в н е н и е м э н е р г и и потока газа. Из него следует, что изменить скорость газа в потоке можно лишь только за счет изменения энтальпии.
Уравнение энергии можно записать в другом виде. Продифференцируем выражение (4.3) и получим: cdc = — di. Из первого закона термодинамики, записанного в виде dq = di -vdp, при dq = 0 следует, что di = vdp. Тогда
Выражение (4.4) приписывают Д. Бернулли, поэтому в технической литературе его называют у р а в н е н и е м Б е р н у л л и.
Это уравнение устанавливает связь скорости с давлением. Из него следует, что для увеличения скорости (dc > 0) необходимо снижение давления (dp
В окончательном виде формула температуры торможения имеет вид:
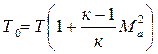
Используя адиабатную связь между температурой и давлением, получим формулу для давления торможения:
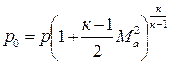
Плотность ρ0 определяется по p0 и T0 из уравнения (4.1).
4.1.3. Уравнение скорости движения газа
Уравнение скорости движения газа в произвольном сечении потока получим из уравнения энергии. Пусть газ вытекает из емкости, где его скорость была равна нулю. Тогда уравнение энергии для произвольного сечения потока газа и для сечения, где c = 0, будет иметь вид:
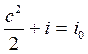
c = 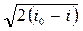
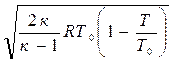
Если отношение температур заменить отношением давлений, то
c= 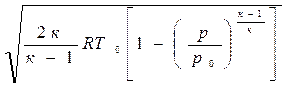
Из выражения (4.7) следует, что величина скорости газа в рассматриваемом сечении потока зависит от природы газа, от параметров в его исходном (заторможенном) состоянии и от давления газа в рассматриваемом сечении.
4.1.4. Уравнение расхода
Термодинамика газового потока в основном рассматривает стационарное движение газа. Это означает, что через все сечения канала в любой момент времени протекает одно и то же массовое количество газа. Обозначается секундный массовый расход 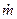
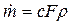
Выразим секундный массовый расход через параметры заторможенного газового потока, для чего в выражение (4.8) вместо c подставим его значение (4.7), а плотность представим в виде
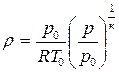
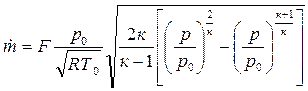
4.2. Течение газа в каналах
4.2.1. Уравнение обращения воздействия
Каналы, в которых газовый поток увеличивает свою скорость, называются с о п л а м и. Каналы, скорость в которых уменьшается, именуют д и ф -ф у з о р а м и. Геометрическая форма сопел может быть различной. Это зависит от того, каково внешнее воздействие на газовый поток.
В 1948 г. А.А. Вулис получил зависимость, выражающую связь геометрии сопла с характером внешнего воздействия на поток. Для неэнергоизолированного движения газа зависимость Вулиса имеет вид:
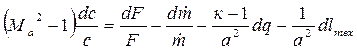
Здесь первое слагаемое правой части уравнения выражает г е о м е т-
р и ч е с к о е в о з д е й с т в и е на движущийся газ, второе – м а с с о в о е, третье – т е п л о в о е и четвертое – м е х а н и ч е с к о е. Уравнение (4.10) является математическим выражением принципа обращения воздействия, суть которого состоит в том, что характер влияния каждого воздействия на газовый поток противоположен при сверхзвуковых и дозвуковых течениях газа.
Проанализируем лишь геометрическое воздействие. В этом случае из уравнения (4.10) следует:
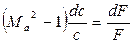
При дозвуковом течении газа (Мa 0, а в расширяющемся, где dF > 0, – тормозиться, т.е. dc 1) знаки у величин dc/c и dF/F одинаковые. Следовательно, для увеличения скорости необходим расширяющий канал, а для торможения — сужающийся.

4.2.2 Течение газа в соплах Лаваля
При движении газа вдоль сверхзвукового геометрического сопла своеобразно изменяются его параметры. Для выявления характера изменения давления по длине сопла из уравнений (4.4) и (4.11) можно получит выражение:
Из анализа данного уравнения следует, что давление вдоль сопла уменьшается. Кривая давления в дозвуковой части сопла имеет выпуклый вид, а в сверхзвуковой – вогнутый. Температура вдоль сопла уменьшается, так как процесс расширения газа адиабатный. С такой же закономерностью уменьшается по длине сопла и скорость звука.
Характер изменения скорости вдоль сопла устанавливается уравнением Бернулли (4.4), записанным в виде:
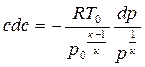
В сужающейся части сопла это вогнутая кривая. а в расширяющейся – выпуклая, асимптотически приближающаяся к максимально возможной скорости при р = 0. Качественные изменения давления, температуры, скорости звука и скорости потока по длине геометрического сопла представлены на рис.4.3 .Характерным для канала такой формы является участок перехода дозвукового течения в сверхзвуковой.
Сечение канала, в котором скорость потока достигает величины, равной местной скорости звука, называют к р и т и ч е с к и м .

Получим выражение для ркр и Ткр через параметры торможения. В критическом сечении 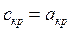
После незначительных преобра –
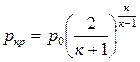
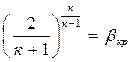
Величина β определяется только
значением показателя адиабаты к . Рис. 4.3
Так, для воздуха при к = 1,4 значение βкр = 0,528. Отсюда следует, что для воздуха критическое давление меньше давления торможения в 1,89 раза.
Значение критической температуры получим из выражения (4.12), заменив отношение давлений отношением температур:
Ткр= Т0 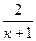
Теперь выражение для критической скорости можно представить в другом виде:
скр = 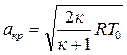
Скорость газа в каждом сечении сопла и на выходе из него вычисляется по формуле (4.7).
Если секундный массовый расход выразить через параметры торможения и площадь критического сечения, то зависимость (4.9) существенно упрощается:
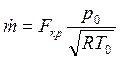
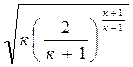
Если давление газа в выходном сечении сопла равно давлению окружающей среды ( 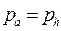
4.2.3. Дросселирование газа и пара
Д р о с с е л и р о в а н и е м называют процесс понижения давления в газовом потоке при преодолении местного сопротивления в канале.
При дросселировании газа или пара протекает необратимый процесс снижения давления без совершения внешней работы. Если в канале имеется местное сопротивление в виде резкого сужения вида перегородки с отверстием, задвижки, клапана и т.п., то газовый поток перестраивает свою геометрическую форму, как до сужения, так и после него. Перестройка формы потока и перетекание через само сужение связано с образованием вихревых движений газа. Часть кинетической энергии потока идет на образование вихрей, часть – на преодоление сопротивления трения. Затраченная на это энергия необратимо превращается в теплоту, которая воспринимается газом. Поэтому давление после местного сопротивления не восстанавливается до первоначального. Изменение давления, скорости и температуры по длине канала приведено на рис.4.4. Скорость газа при протекании его через сужение возрастает, что вызывает снижение давления и температуры. После сужения скорость понижается, но давление, вследствие указанных причин, не восстанавливается до первоначального.
Степень снижения давления газа при дросселировании зависит от природы газа и его состояния, относительной величины сужения, скорости газа. Обозначим степень снижения давления через 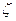

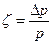
где ∆р – величина снижения давления;
р – давление на входе в сужение.
В энергетических установках дросселирование нежелательно, т.к. при падении давления снижаются энергетические возможности газа. Но иногда дросселирование является необходимым и создается искусственно, например, в редукторах, регуляторах и т.п.
При термодинамическом анализе особенностей процесса дросселирования целесообразно использовать общее уравнение энергии:
В канале можно обеспечить с1 = с2 , тогда i1 =i2. Из чего следует, что энта-
льпия газа в процессе дросселирования
остается постоянной. Рис. 4.4
Этот вывод справедлив как для идеальных, так и для реальных газов. При дросселирования идеального газа Т1 = Т2 , поскольку i1 = i2 . Это значит, что для идеального газа температура после дросселирования равна температуре на входе в дроссель.
Для реального газа изменение температуры при его дросселировании в отличие от идеального газа имеет своеобразный характер. Как показывают опыты, температура реального газа в результате дросселирования повышается, понижается или не изменяется. Это свойство впервые обнаружили ученые Д. Джоуль и У. Томсон, поэтому оно носит название э ф ф е к т а Д ж о у л я-Т о м с о н а.
Используя дифференциальные уравнения, связывающие i, s, ρ и T, можно получить для газа, подчиняющегося уравнению Ван-дер-Ваальса, следующую зависимость:
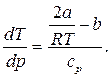
Отношение бесконечно малого изменения температуры к бесконечно малому изменению давления при дросселировании называется д р о с с е л ь—э ф ф е к т о м и обозначается
α =
Так как при дросселировании dp 0, т.е. dT 0 ( при T > 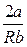
в) 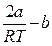
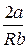
Изменение знака дроссель — эффекта α называется и н в е р с и е й,
а температура, при которой dT = 0, называется т е м п е р а т у о й и н в е р с и и и обозначается Tинв .
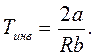
|
Понятие температуры инверсии особенно широко используется в холодильной и криогенной технике.
Каждый конкретный газ имеет индивидуальную температуру инверсии. Так, например, для воздуха Тинв = 650 К; для водорода Тинв = 204 К; для водяного пара Тинв= 682 К.
Для установления температуры реального газа после дросселя необходимо сравнить Tвх с Tинв .Если температура газа на входе в дроссель равна его температуре инверсии, то после дросселя она восстановится до прежнего значения. При Tвх Tинв — она возрастет. Характер изменения температуры при дросселировании

Внутренняя энергия идеального газа — формулы и примеры вычислений
Исторический экскурс
На середину XVII века приходится период расцвета экспериментальной физики. Во время опытов с заполненной ртутью стеклянной трубкой — прообразом барометра — Э. Торричелли в 1643 году обнаружил, что воздух имеет массу. Через девять лет в городе Магдебурге Отто фон Герике публично поставил эксперимент с медными полушариями, который наглядно продемонстрировал наличие атмосферного давления.
В 1662 году англичанин Р. Бойль установил, что при постоянной массе и температуре произведение давления газа на объём является величиной, которая не изменяется. Открытие стало одним из фундаментальных газовых законов, получившим имя Бойля-Мариотта.
В 1802 году французский академик Ж. Л. Гей-Люссак опубликовал статью, в которой сформулировал закон объёмов. По утверждению профессора химии, при постоянном давлении и массе между объёмом и температурой газа наблюдается прямо пропорциональная зависимость. При этом исследователь установил, что коэффициент изменения объёма одинаков для любой газовой среды.
В 30-х годах XIX столетия Гей-Люссак и офицер французской армии Николя Сади Карно независимо друг от друга объединили в одном уравнении законы Бойля-Мариотта и Шарля-Гей-Люссака. Однако математическому выражению, описывающему состояние газового тела, присвоили имя Б. Клапейрона, который в 1834 году подробно изложил идеи предшественников в мемуаре «О движущей силе огня». Во второй половине XIX века немецкий физик Р. Клаузиус опубликовал труды по теории термодинамики, где впервые ввел понятие «идеальный газ».
Значительным шагом в описании состояния идеального газа стал переход к универсальной газовой постоянной, которая обозначается физиками латинской буквой R. Первую математическую формулировку представил русский военный инженер И. П. Алымов в статьях, опубликованных в выпусках «Морского сборника» за 1861 и 1864 гг. Те же результаты получил Д. И. Менделеев в 1874 году.
Итогом работы великого русского химика стала формула идеального газа, которая в современной науке носит название уравнения Менделеева-Клапейрона:
P ∙ V = R ∙ T, где:
- P — давление газа.
- V — объём в молях.
- R — универсальная газовая постоянная.
- T — температура газовой среды.
Теоретическая формулировка
Элементарные частицы тела, обладая кинетической энергией, находятся в постоянном хаотическом движении. А также молекулы и атомы взаимодействуют между собой посредством электрических сил отталкивания и притяжения, что свидетельствует о наличии потенциальной энергии. Кроме того, энергией обладают электроны в атомах. Таким образом, тело наполнено силой, слагаемые которой имеют различную природу.
Компоненты внутренней энергии объекта, не подверженному внешнему воздействию:
- кинетическое движение частиц;
- потенциальное межмолекулярное взаимодействие;
- электронные силы;
- внутриядерная энергия.
При теоретическом изучении процессов термодинамики используется понятие «идеальный газ». Упрощённая модель газообразного тела, в отличие от реального газа, предполагает отсутствие гравитационного и электромагнитного взаимодействия между атомами вещества, а также не берётся во внимание энергия ядра. При этом движение молекул, которые представляются материальными точками, не имеющими объёма, ограничивается упругим соударением.
Теория термодинамики предлагает следующую формулировку: «В идеальном газе внутренняя энергия определяется суммарной кинетической энергией теплового движения составляющих его молекул». В Международной системе единиц СИ за единицу измерения энергии принят Джоуль.
В термодинамике главным свойством энергии является функция состояния системы в конкретный момент времени. Поэтому изменение энергии зависит от первоначальных и конечных параметров газового тела и происходит при совершении механической работы или путём теплопередачи. Если работа совершается самим газовым объектом, то внутренняя энергия уменьшается. В случае внешнего физического воздействия энергетический потенциал газового тела увеличивается.
Теплопередачей считается переход внутренней энергии без механического воздействия на газовую среду. Иногда этот процесс называют теплообменом. Существуют следующие разновидности явления:
- Теплопроводность.
- Конвекция.
- Тепловое излучение.
Теплопроводность веществ
При нахождении тела в области повышенной температуры, например, под пламенем горелки или в горячей воде, атомы начинают совершать интенсивные колебательные движения. Тем самым увеличивается кинетическая энергия соседних частиц и происходит постепенная передача теплоты от участка к участку. Таким образом, теплопроводностью называется перенос энергии от тёплых фрагментов объекта к холодным посредством теплового движения частиц среды.
Лучшими тепловыми проводниками являются металлы. Меньшую теплопроводность имеют жидкости, а хуже всего передают тепло газы. Предметы из плотного материала проводят тепло лучше, чем тела из пористого вещества.
Явление конвекции
Если в газообразную среду поместить горячий предмет, то нагретая субстанция устремится вверх. Освободившееся пространство заполнит газ с меньшей температурой. Аналогичное явление наблюдается в жидкостях.
Конвекцией называется перемещение внутренней энергии в процессе циркуляции газовых или жидкостных потоков, приводящей к перемешиванию вещества. За счёт конвекции, например, происходит обогрев помещений с помощью отопительных приборов. Перемещение воздушных масс в атмосфере также основано на принципах конвекции.
Тепловое излучение
Как известно, атомы состоят из заряженных положительно протонов, вокруг которых вращаются электроны, имеющие отрицательный заряд. Хаотическое движение элементарных частиц порождает электрические поля. Принято считать, что тепловое излучение является проявлением электромагнитных волн, которые возникают в результате теплового колебания атомов.
Тепловое излучение, способное распространяться в любом веществе и вакууме, испускает каждое тело. Влияние данного явления испытывает человек, который решил погреться под солнечными лучами. Наглядно увидеть тепловое излучение позволяют приборы ночного видения.
Математическое выражение
Согласно теоретическому определению идеального газа, внутренний потенциал слагается из кинетических энергий всех частиц. На языке математике это выражается следующей формулой:
где: U — внутренняя энергия тела;
N — количество элементарных частиц;
Ek — кинетическая энергия одной молекулы.
Число молекул определяется по формуле:
где: ν — количество вещества;
NA — постоянная Авогадро, константа, равная 6,02 ∙ 10 23 моль -1
Энергия движения молекулы вычисляется из уравнения:
где: i — количество степеней свободы, которые полностью определяют пространственное положение системы;
k — постоянная Больцмана, значение которой равно 1,38 ∙ 10 -23 Дж/К;
T — температура объекта измеряется по абсолютной шкале Кельвина.
Постановка уравнений количества молекул и кинетической энергии в формулу даёт следующее выражение:
U = (i/2) ∙ ν ∙ k ∙ NA ∙ T.
Произведение постоянных величин (k ∙ NA) называется универсальной газовой постоянной R, которая равна 8,31 Дж/(моль ∙ К). Тогда формула изменения внутренней энергии газа принимает окончательный вид:
где ∆T — разница между начальной и конечной температурой газового тела.
Полная кинетическая энергия складывается из поступательного и вращательного движения частиц. В одноатомном газе отсутствует вращательное движение молекул. В многоатомном газе необходимо принимать во внимание вращение молекул. Соотношение поступательного и вращательного моментов учитывается законом распределения энергии по степеням свободы. Это правило утверждает, что на одну степень свободы i приходится ½ ∙ (k ∙ T) всей энергии.
Таблица 1. Зависимость числа степеней свободы от количества атомов в молекуле.
| Количество атомов в молекуле газа | Количество степеней свободы i | ||
| Поступательное движение | Вращательное движение | всего | |
| Один | 3 | — | 3 |
| Два | 3 | 2 | 5 |
| Три и больше | 3 | 3 | 6 |
Решение практической задачи
Задача.
Термоизолированный баллон, заполненный водородом, чья молярная масса равна 2,00 г/моль, движется со скоростью 250 м/с. Как изменится газовая температура при мгновенной остановке сосуда, теплоёмкостью которого можно пренебречь?
Решение.
Полная энергия газового тела W складывается из энергии водорода U и кинетической энергии движущегося тела E, или W = U + E. При движении сосуда:
W₁ = U₁ + E₁ = [(i/2) ∙ ν ∙ R ∙ T₁] + [mv²/2] = [(5/2) ∙ (m/M) ∙ R ∙ T₁] + [mv²/2],
где i = 5, так как молекула водорода состоит из двух атомов;
ν — является частным от деления массы газа m на молярную массу водорода M;
R — универсальная газовая постоянная;
T₁ — начальная температура газа;
v — скорость движения.
После остановки сосуда, когда E₂ = 0, полная энергия равна:
W₂ = U₂+ E₂ = [(i/2) ∙ ν ∙ R ∙ T₂] = [(5/2) ∙ (m/M) ∙ R ∙ T₂], где T₂ — конечная температура газа.
Поскольку в термоизолированном баллоне не происходит теплообмена между окружающей средой и газом, то можно записать:
W₁ = W₂, или [(5/2) ∙ (m/M) ∙ R ∙ T₁] + [mv²/2] = [(5/2) ∙ (m/M) ∙ R ∙ T₂].
Из полученного уравнения можно найти разность температур:
∆T = (v² ∙ M)/(5 ∙ R), или [(250)²∙ 2,0 ∙ 10ˉ³]/[5 ∙ 8,31] = 3 K.
Ответ. При мгновенной остановке баллона с водородом температура газа повысится на 3 градуса по шкале Кельвина.
Законы термодинамики изучаются в старших классах общеобразовательной школы. Понимание смысла теории идеального газа поможет на выпускном экзамене, а умение решать задачи облегчит применение знаний на практике.
Основные уравнения газового потока
Основные уравнения газового потока
- Если движение газа по каналу стабильно, то одинаковое количество газа в единицу времени протекает по каждому участку канала. В этом случае (рис. 10.1), при определенном расходе газа в каждом участке канала расход газа равен(10.1). Где O-2-й массовый расход газа. Рх, РГ-площадь поперечного сечения канала. w и r-это скорости потока соответствующих поперечных сечений. Определенный объем одного и того же поперечного сечения; формула (10.1) называется уравнением неразрывности или непрерывности, поскольку постоянство массового расхода всех участков канала в каждый момент времени устанавливает условия неразрывности струи.
В рассматриваемом процессе первый закон термодинамики. Форма газа урав-кг газа через канал является = Фунт / + 4-С—(- (3% Си、 (10.2), где же буква «Л». Основное количество тепла, подаваемого или отводимого к газу в целевом участке движения. L / — изменение внутренней энергии газа в соответствующем сечении. го /. ’- Работа газа против внешних сил; С-приращение кинетической энергии газа при движении газа в выбранной области. С ^ а ^ — элемент Сила против работы тары 10.1 Этот компонент в олове; газ можно проигнорировать. Работа газа по противодействию внешним силам движущегося газа — это работа, которая тратится на прессование. Рассмотрим поток газа в канале рис.
За пределами пограничного слоя градиент скорости, нормальный к направлению потока, обычно настолько мал, что вязкостью можно пренебречь. Людмила Фирмаль
В 1-мерном измерении stream. In в разделах/-/и 11-11 различают газы определенной массы. Поток, поступающий в секцию 1-1, действует как поршень, отталкивая газ, заполняющий канал. сила pP действует на массу газа, выделенную в левом канале, а сила (p + Lp) (P4-LR) действует справа. Учитывая признаки работы, признанные в термодинамике, работа движения является Л ’=(П 4-С / П)(П 4-ЛХ) (Н + Ла») — ППУ>-(10 3) Если вы уменьшите небольшое количество 2 или более и отбросите его, это будет выглядеть так: Л ’ — rRLchi 4-Рих / Р 4-shRLr, (10.4) L ’= pL (Pu>) 4-PsLr.
Где N-уравнение неразрывности ТЧ = ТС. Расход потока постоянн и в непрерывной среде Если мы связываем работу против внешних сил с 1 кг газа、 L ’=(1 (ri) = Рио + ойр. (U. Seven) Количество cir, масса экстрагируемого вещества Это за гранью несжимаемости. 2-й член pc1i представляет собой основную работу, выполняемую движущимся телом продукта газа в результате деформации под действием равномерно распределенного давления. При замене работы на внешние силы в уравнениях первого закона термодинамики записывается около 1 кг газа 1е = c1u + c1G + =(1и + С1 (ПУ) 4- = я(п + Пи)+.(10.8) Потому что, как известно,+ ri = I — Си+ .
- Эта формула показывает, что тепло, подводимое к движущемуся газу, расходуется в двух направлениях: увеличение энтальпии газа и увеличение внешней кинетической энергии. То есть скорость потока газа увеличивается. Формула (10.9) является основой течения газа или пара, она эффективна как для обратимых течений без действия сил трения, так и для необратимых течений с трением.
Для потока, в котором присутствует сила трения, необходимо добавить 2 члена к формуле (10.9).1 учитывает работу, затраченную на преодоление силы трения — / тр, еще 1 представляет собой приращение теплоты газового потока за счет трения-поскольку работа над силой трения проходит полностью, в тепле эти 2 элемента имеют одинаковый размер, а так как знаки различны, то они исчезают друг от друга. Поэтому наличие сил трения не может нарушить общий энергетический баланс.
Это явление, весьма важное для гидродинамики и теории теплообмена, было впервые установлено Людвигам Прандтлем в 1904 г. Людмила Фирмаль
В изолированных потоках газа, если тепло не передается при движении газа ПО КАНАЛУ (1 / = 0)、 Из уравнения (10.10) следует, что в изолированном стационарном потоке газа через канал сумма удельной энтальпии и удельной кинетической энергии остается постоянной. Выражение (10.9), как и в (10.10), справедливо как для обратимых, так и для необратимых flows. It следует отметить, что эти формулы эффективны только в том случае, если газ на ходу выполняет работу расширения и не производит полезной (технической) работы (например, вращение рабочего класса турбины).
Приводимый в движение потоком газа. Первый закон термодинамики (10.8). Вам нужно записать В форме че = ух + ^(Р’) + ^ МС,+ — ^ г — = а + г(ТЭН+ -^ -, (10.11) Здесь/ т» — техническая работа*. Если техническая работа осуществляется потоком, то работа деформации при расширении отдается внешнему потребителю, но в канале она воспринимается соседними элементами, изменяя его кинетическую энергию. Из сравнения формулы (10.11) и формулы первого закона термодинамики (4.9) получается интегральная форма, записанная о выделенных элементах деформированного, но не смещенного потока. ’тек = С П’ ^ + P1V!-.




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://nauka.club/fizika/vnutrenny%D0%B0%D1%83%D0%B0-energi%D1%83%D0%B0-idealnogo-gaza.html
http://lfirmal.com/osnovnye-uravneniya-gazovogo-potoka/