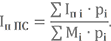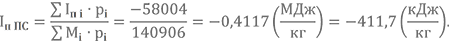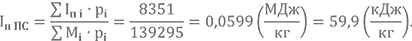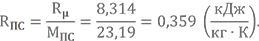УРАВНЕНИЕ ЭНЕРГИИ РАБОЧЕГО ПРОЦЕССА ДЛЯ КАМЕРЫ СГОРАНИЯ
Уравнение энергии рабочего процесса выражает закон сохранения тепловой энергии, выделяемой топливом при горении и при преобразовании ее в различные виды энергии, которые проявляются в разнообразных процессах, протекающих в камере сгорания при работе двигателя.
Уравнение энергии устанавливается для собственно камеры сгорания. Поэтому при его выводе будем учитывать, что на характер протекания рабочего процесса в камере сгорания влияет только общее количество энергии, уносимой продуктами сгорания, поступающими из камеры РДТТ в сопло, а не ее распределение на различные виды внешних работ.
Согласно закону сохранения энергии тепло, получаемое рабочим телом при горении топлива dQψ, в основном расходуется на:
изменение внутренней энергии рабочего тела dU, находящегося в камере сгорания;
энергию, уносимую продуктами сгорания, поступающими из камеры в сопло dQh;
нагревание элементов камеры двигателя dQa в процессе его работы.
Помимо перечисленных затрат энергии имеют место потери энергии на преодоление газодинамических сопротивлений, на трение и другие потери. Перечисленные потерн относительно невелики, а учет их представляет весьма большие трудности, поэтому ими обычно пренебрегают или учитывают косвенно. За время dt образуется следующее количество продуктов сгорания
Если температура горения и удельные теплоемкости воспламенителя и заряда соответственно равны Тuв и Тu, (сu)в и сu, то энергия, выделяемая при горении за элементарный промежуток времени, будет
Найдем изменение внутренней энергии рабочего тела за время dt. Энергия, заключенная в продуктах сгорания, находящихся в камере в некоторый момент времени, будет
где (сu)S – теплоемкость смеси продуктов сгорания.
Следовательно, изменение внутренней энергии за время dt
За бесконечно малый промежуток времени вытечет mтdh продуктов сгорания. Это количество рабочего тела обладает определенным запасом потенциальной и кинетической энергий. При движении газов вдоль сопла внутренняя энергия убывает, кинетическая возрастает, а общий запас энергий, содержащийся в потоке, не меняется, если не учитывать потери из-за кратковременности процесса истечения. Поэтому энергию, уносимую истекающими газами, можно определить из условия, что вся внутренняя энергия перешла в кинетическую. В этом случае скорость газа достигает своего максимального значения
где kS – показатель адиабаты смеси продуктов сгорания.
Следовательно, наибольшее значение кинетической энергии, равное всей энергии, уносимой вытекающими газами, найдется по соотношению
Так как RS = (сu)S (kS — 1), получаем
Потери энергии на нагревание найдем из выражения для коэффициента c, которое для бесконечно малого промежутка времени запишется так
Таким образом, найдены значения всех составляющих уравнения энергии. Подставляя их в (1.12), окончательно получим
Уравнение энергии, взятое в отдельности, непосредственно не интегрируется. Однако при некоторых допущениях, вытекающих из специфики рабочего процесса РДТТ, это интегрирование возможно, что позволяет получить ряд приближенных соотношений, имеющих важное прикладное значение.
Для стационарного периода работы двигателя можно принять следующие предпосылки:
горит только один основной заряд;
скорость прихода продуктов сгорания в камеру двигателя равна скорости их расхода через сопло;
изменение температуры рабочего тела является малым.
При принятых ограничениях уравнение энергии существенно упрощается и принимает вид
откуда Тк = cТu / k (1.14)
Полученные соотношения определяют связь между различными температурами продуктов сгорания.
Введя газовую постоянную, можем записать
(1.16)
Таким образом, при условиях, характерных для установившегося режима работы двигателя, температуру рабочего тела в камере РДТТ можно считать постоянной и равной
что равносильно соотношению
Более строгое исследование уравнения энергии показывает, что температура рабочего тела в камере двигателя является величиной переменной. Наибольшее изменение температура имеет при выходе двигателя на стационарный режим. За этот период выгорает очень малая доля заряда, которая не превышает ψ £ 0,02. После выхода РДТТ на стационарный режим температура в течение всего остального времени горения заряда изменяется незначительно (очень медленно убывает), практически оставаясь постоянной и равной Тк = cТр.
Беседы о ракетных двигателях
Просто о том, что кажется сложным
Урок 08. Тепловой расчёт камеры. Способ второй – лирический (ч.4)

Мы продолжаем рассматривать особенности теплового расчёта и сегодня поговорим о том, как определить температуру продуктов сгорания в камере сгорания.
Если помните, при определении парциальных давлений газов мы задавались тремя значениями температуры в окрестности ожидаемой. Однако мы так и не выяснили, каково же её действительное значение. Для определения температуры можно использовать уравнение сохранения энергии, выраженной через энтальпии топлива и продуктов сгорания. Т.е., согласно этому закону можно утверждать, что полная энтальпия топлива равна полной энтальпии продуктов сгорания на входе в сопло при температуре, равной температуре газов в камере сгорания. Полную энтальпию топлива мы с Вами считать уже умеем. Если что-то подзабылось, вернитесь к уроку 3. Остаётся дело за малым – определить полную энтальпию продуктов сгорания при «не очень известной» температуре.
Здесь нам на помощь опять придут справочные данные. Значения полной энтальпии для простейших газов, таких как CO2, H2O, NO и пр., в зависимости от температуры известны и занесены в справочники. Посмотреть их можно, например, здесь. Конечно, возникает некоторая сложность, связанная с тем, что значения энтальпии приведены только для вполне конкретных температур, и её промежуточные значения нужно как-то определить. Здесь существует два пути: с помощью интерполяции находить промежуточные значения, вычислять полную энтальпию смеси и сравнивать с энтальпией топлива, либо можно выбрать значения для трёх заданных нами ранее температур, опять же вычислить полную энтальпию для этих трёх точек и построить по ним сглаживающий график. Затем графическим путём определить температуру, соответствующую полной энтальпии топлива. Точность такого способа определения оказывается вполне приемлемой для тепловых расчётов (единицы Кельвинов), к тому же он, на мой взгляд, более удобен и не лишён некоторого изящества 🙂 .
Для вычисления полной энтальпии продуктов сгорания воспользуемся формулой
Здесь Mi – молярная масса i-го газа в кг/кмоль, численно равная относительной молекулярной массе.
Продолжим расчёт камеры на основе НДМГ+АТ, несколько отложенный в сторону с позапрошлого урока. Состав продуктов сгорания для Т1 = 3300 К; Т2 = 3400 К; Т3 = 3500 К мы посчитали. Определим полную энтальпию продуктов сгорания для этих температур.
Выпишем значения энтальпий составляющих газов и занесём их в таблицу. Также для удобства подсчитаем произведения энтальпий и молярных масс на соответствующие парциальные давления.
Т1 = 3300 К
| pN2 | pCO2 | pCO | pH2 | pH2O | pOH | pNO | pH | pO2 | pO | pN | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Iп i , МДж кмоль | 104,1 | -221,0 | -5,655 | 100,2 | -100,6 | 143,2 | 197,0 | 280,6 | 110,4 | 310,7 | 420,9 | |
| Mi , кг кмоль | 28 | 44 | 28 | 2 | 18 | 17 | 30 | 1 | 32 | 16 | 14 | |
| pi , кПа | 1743 | 548,6 | 813,5 | 408,7 | 2156 | 151,7 | 43,95 | 73,97 | 39,10 | 19,15 | 2,205 | ∑pi = 6000 кПа |
| Iп i·pi | 181446 | -121241 | -4600 | 40952 | -216894 | 21723 | 8658 | 20756 | 4317 | 5950 | 928 | ∑Iп i·pi = =-58004 |
| Mi·pi | 48804 | 24138 | 22778 | 817 | 38808 | 2579 | 1319 | 74 | 1251 | 306 | 31 | ∑Mi·pi = =140906 |
Таким образом полная энтальпия при Т1 = 3300 К
Аналогично поступаем для двух других температур.
Т2 = 3400 К
| pN2 | pCO2 | pCO | pH2 | pH2O | pOH | pNO | pH | pO2 | pO | pN | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Iп i , МДж кмоль | 107,9 | -214,6 | -1,910 | 103,9 | -95,09 | 147,0 | 200,8 | 282,7 | 114,4 | 312,8 | 423,0 | |
| Mi , кг кмоль | 28 | 44 | 28 | 2 | 18 | 17 | 30 | 1 | 32 | 16 | 14 | |
| pi , кПа | 1716 | 504,7 | 841,8 | 434,1 | 2067 | 193,6 | 57,08 | 97,53 | 55,31 | 29,94 | 3,248 | ∑pi = 6000 кПа |
| Iп i·pi | 185156 | -108309 | -1608 | 45103 | -196551 | 28459 | 11462 | 27572 | 6327 | 9365 | 1374 | ∑Iп i·pi = =8351 |
| Mi·pi | 48048 | 22207 | 23570 | 868 | 37206 | 3291 | 1712 | 98 | 1770 | 479 | 45 | ∑Mi·pi = =139295 |
Полная энтальпия при Т2 = 3400 К
Т3 = 3500 К
| pN2 | pCO2 | pCO | pH2 | pH2O | pOH | pNO | pH | pO2 | pO | pN | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Iп i , МДж кмоль | 111,6 | -208,3 | 1,840 | 105,8 | -89,59 | 150,8 | 204,6 | 284,8 | 118,5 | 314,9 | 425,1 | |
| Mi , кг кмоль | 28 | 44 | 28 | 2 | 18 | 17 | 30 | 1 | 32 | 16 | 14 | |
| pi , кПа | 1684 | 457,2 | 870,8 | 464,4 | 1962 | 239,6 | 71,40 | 127,2 | 73,50 | 44,68 | 4,672 | ∑pi = 6000 кПа |
| Iп i·pi | 187934 | -95235 | 1602 | 49134 | -175776 | 36132 | 14608 | 36227 | 8710 | 14070 | 1986 | ∑Iп i·pi = =79392 |
| Mi·pi | 47152 | 20117 | 24382 | 929 | 35316 | 4073 | 2142 | 127 | 2352 | 715 | 65 | ∑Mi·pi = =137371 |
Полная энтальпия при Т3 = 3500 К
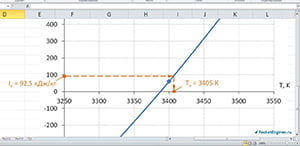
Построим график и, отложив на оси ординат величину энтальпии топлива, найдём температуру продуктов сгорания. Как видно на рисунке, Тк ≈ 3405 К.
Аналогично посчитаем молярную массу продуктов сгорания для трёх температур по формуле
Значения числителя и знаменателя записаны в таблицах. Подставляем в формулу и получаем МПС1 = 23,49 кг/кмоль, МПС2 = 23,21 кг/кмоль, МПС3 = 22,90 кг/кмоль.
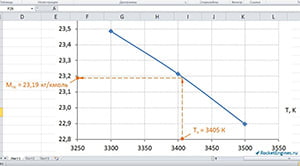
Строим график (см. рис.) и графически определяем для найденной температуры 3405 К значение молярной массы продуктов сгорания. МПС ≈ 23,19 кг/кмоль.
Также, нам понадобится газовая постоянная продуктов сгорания
Напоминаю, что Rμ = 8,314 кДж/(кмоль·К) — универсальная газовая постоянная.
На сегодня всё. Продолжим в следующем уроке.
Всем удачи!
Частные случаи уравнения энергии
Понятие об энтропии
В термодинамике есть еще одна очень важная функция состояния газа — энтропия (S). Математически прирост энтропии dS определяется выражением
 | (3.19) |
где dq — полное количество тепла, подводимое к газу как извне, так и изнутри за счет сил трения;
Т — абсолютная температура.
Если в формуле (2.9) вместо dq подставить его выражение согласно первому закону термодинамики
и произвести ряд преобразований, то можно получить
 | (3.20) |
Согласно (2.10) в идеальном адиабатическом процессе, который является обратимым, изменение энтропии равно нулю, так как в этом случае
и изменение энтропии не происходит. В реальном адиабатическом процессе за счет трения выделяется тепло (dqтр>0) и процесс протекает в таком направлении, что энтропия возрастает S2-S1>0.
Таким образом, численное значение S2-S1, может служить мерой потерь механической энергии на преодоление сил трения. Если известны параметры состояния газа в точках 1 и 2, то изменение энтропии в процессе 1 — 2 определяется по формуле (3.20).
Рис. 3.4. Процесс расширения газов
В термодинамике процессы принято представлять в Р — V и Т — S координатах (рис. 3.4).
На рис. 3.4, а представлен процесс расширения газа в турбине. Заштрихованная площадь характеризует техническую работу, которая может быть получена на валу турбины. На рис. 3.4, б тот же процесс представлен в координатах Т — S. Здесь заштрихованная площадь характеризует количество тепла, выделившееся в результате работы, затраченной на преодоление сил трения. Если бы процесс был идеальным, т.е. шел без потерь энергии на трение, то он изображался бы вертикальным отрезком 1 — 2ад. Соответственно площадь под отрезком 1 — 2ад равна нулю. Таким образом, использование энтропии позволяет количественно оценить потери механической энергии на трение.
Частные случаи уравнения энергии
Запишем еще раз уравнение энергии
 | (3.21) |
При отсутствии технической работы (отсутствует турбина или компрессор в потоке газа) и теплообмена с окружающей средой имеем
Из этого уравнения следует, что изменение скорости в энергетически изолированном потоке газа (q=0, L = 0) однозначно связано с изменением температуры. Если скорость газа не изменяется, то остается постоянной и температура независимо от того, есть трение или нет. Процесс расширения газа в канале от давления Р1 до давления Р2 можно представить на диаграмме в Т — S координатах (рис. 3.5).
Рис. 3.5. Процесс расширения газа: а — идеальная адиабата; в — расширение газа с трением; с — адиабатическое дросселирование
Расширение газа от давления Р1 до давления Р2 может идти различными способами. Процесс расширения а соответствует идеальной адиабате. Потерь на трение нет. Увеличение скорости на участке канала 1- 2 максимальное; уменьшение температуры также максимальное. Уравнение энергии для случая а
Другой случай- с. Вся потенциальная энергия газа переходит в тепло. Скорость не увеличивается, температура не изменяется. Количество тепла, выделившееся в результате работы сил трения, соответствует площади треугольника 1 2 g d е. Уравнение энергии для случая с
Случай в соответствует течению газа по сужающемуся каналу с трением. Скорость увеличивается. Тепло, выделившееся в результате работы сил трения, соответствует площади 1 2 р f е. Уравнение энергии для случая в
Уравнение энергии (3.21) можно записать в виде
 | (3.22) |
т.е. суммы энтальпии и кинетической энергии газа для энергетически изолированного потока газа в сечениях 1 и 2 равны между собой. Это соотношение можно записать и для любых других сечений. Поэтому уравнение (3.22) записывается без индексов в виде
Отсюда видно, что если поток газа затормозить полностью (w=0), то энтальпия достигнет максимально возможного значения
Получающееся при этом значение энтальпии i* будем называть полной энтальпией, а соответствующую ей абсолютную температуру
В дальнейшем всем параметрам, определенным для заторможенного потока газа будет, присваиваться верхний индекс *.
С помощью (3.23) из уравнения энергии можно исключить скорости, и тогда уравнение энергии записывается в виде
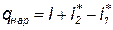 | (3.24) |
Теплоемкость Ср не является строго постоянной величиной, а изменяется в зависимости от температуры, но незначительно. Пользуясь средним значением теплоемкости, можно вычислить температуру торможения по следующей формуле
 | (3.25) |
Для воздуха Ср=1005 Дж/кг К и, следовательно,
В воздушном потоке с нормальной температурой воздуха 300 К при скорости движения w=100; 350; 1000 м/с получается соответственно температура торможения Т * =305, 360,800 К.
Итак, температура торможения за входным устройством самолета (перед компрессором) может быть определена по формуле (3.25).
Для расчета компрессора или турбины обычно пользуются уравнением энергии в форме (3.24). Так как принято, что работа турбины положительна IK>0, а работа компрессора 1К * , если известны температура на входе Т1 * и работа на валу турбины IT По (3.27) можно определить температуру на выходе из компрессора Т2 * , если известны температура на входе Т1 * и работа, подводимая к валу компрессора IK.
В формулах (3.26) и (3.27) потери на трение в подшипниках, трение дисков о газ или воздух, перетекание через радиальный зазор в лопаточных машинах не учитываются. Применительно к камере сгорания I = 0 уравнение энергии (3.24) будут иметь вид
 | (3.28) |
где gT — количество топлива, приходящееся на 1 кг воздуха;
Нu — теплотворная способность топлива т.е. количество тепла, выделяющееся при сгорании 1 кг топлива, кДж/кг;
СP2 — теплоемкость продуктов сгорания, кДж/кг К;
Т2* — температура продуктов сгорания, К;
Т1 * — температура воздуха на входе в камеру сгорания, К.
Уравнение (3.28) записано для 1 кг воздуха. Расход продуктов сгорания больше расхода воздуха на величину gТ, поэтому в правой части уравнения (3.28) появился сомножитель (1+gT). Уравнение (3.28) дает возможность определить расход топлива для получения необходимой температуры Т2 * .
http://rocketengines.ru/rocket-engines-studying/practice/chamber-computation/lesson-eight.html
http://poisk-ru.ru/s1475t4.html