Изменение энтропии
Вы будете перенаправлены на Автор24
Энтропия – это фундаментальная физическая величина. Введение этого понятия завершило этап становления понятийного аппарата термодинамики. Следующим этапом развития этой науки было выяснение физического смысла энтропии.
Установление принципа Больцмана (формулы Больцмана) и таким образом связи между термодинамикой и статистической физикой, позволило энтропии покинуть пределы физики и войти в другие области знаний.
Энтропия – это общезначимое понятие, применяемое во множестве наук, например, в:
Введено это понятие было Р. Клаузиусом. Важные работы посвятил энтропии Л. Больцман, М. Планк.
Функция состояния полным дифференциалом которой является δQ/T называется энтропией ($S$):
где $\delta Q$ – элементарное тело, получаемое термодинамической системой; $T$- термодинамическая температура.
Отметим, что формула (1) справедлива только для обратимых процессов. Например, для процессов, проводимых в идеальном газе.
Важно, что выражение (1) определяет не саму энтропию, а ее изменение, или разность энтропий. При помощи данной формулы можно вычислить, каково изменение энтропии, если термодинамическая система переходит из одного состояния в другое, но нельзя понять, какова энтропия каждого из этих состояний.
Напомним формулу Больцмана для энтропии, так как она нам поможет понять физический смысл, процессов, которые происходят с энтропией:
$S=klnW\, \left( 2 \right)$
где ($W$) – термодинамическая вероятность (статистический вес состояния), то есть количество способов, реализации данного состояния термодинамической системы. $W$ ≥1; $k$- постоянная Больцмана.
Изменение энтропии, исходя из статистической формулы Больцмана, найдем как:
Готовые работы на аналогичную тему
Вычисление изменения энтропии в изотермическом процессе
Вычислим изменение энтропии в одном моле идеального газа при изотермическом процессе ($T=const$). Оттолкнемся от первого начала термодинамики в дифференциальной форме:
$\delta Q=dU+pdV\, \left( 3 \right)$,
где $dU$ — изменение внутренней энергии идеального газа; $pdV$=$\delta A$ – работа, совершаемая газом.
Найдем отношение всех слагаемых выражения (3) и температуры:
где $C_V$ – теплоемкость газа при $V=const$.
Для идеального газа справедливо уравнение Менделеева – Клапейрона, учитывая, что у нас 1 моль газа:
$\frac
в этом случае мы можем записать для уравнения (4):
$\frac<\delta Q>
По определению (1), и принимая во внимание (7), запишем:
$dS=d\left( C_
Формула (8) показывает нам, что в изотермическом процессе изменяется только второе слагаемое правой части:
- при увеличении объема энтропия увеличивается,
- с уменьшением объема энтропия уменьшается.
Данный результат очевиден, так как если увеличивается объем, то возрастает количество мест, которое смогут занять частицы при неизменяющемся их количестве. Следовательно, растет число разных возможностей расположения на этих местах (увеличивается количество пространственных микросостояний). Увеличение числа микросостояний означает увеличение энтропии (см формулу (2)).
Изменение энтропии в изохорическом процессе
Рассмотрим изохорный процесс в идеальном газе ($V=const$ или $dV=0$). Из формулы (7) для изохорного процесса следует:
$dS=d\left( C_
После интегрирования (9), получим:
Формула (10) показывает, что в изохорическом процессе при увеличении температуры происходит рост энтропии. Данный результат можно пояснить так:
- при увеличении температуры растет средняя энергия частиц газа;
- увеличивается количество возможных энергетических состояний.
Изменение энтропии в адиабатном процессе
Адиабатный процесс характеризуется тем, что он происходит без теплообмена (δQ=0). Исследуя адиабатный процесс в идеальном газе, за основу для вычисления энтропии примем выражение (8). Найдем интеграл правой и левой частей этого выражения, получим:
Запишем уравнение адиабатного процесса в параметрах $T,V$:
где $\gamma =\frac
$\ln \left( \frac
Преобразуем выражение (11), приняв во внимание формулу (13):
Вспомним соотношение Майера:
и сделаем вывод о том, что изменение энтропии в адиабатном процессе нет:
Адиабатный процесс является изоэнтропийным ($S=const$).
При адиабатном расширении газа увеличение энтропии может идти только за счет увеличения объема, но при этом происходит уменьшение температуры, и энтропия уменьшается из-за уменьшения температуры. Данные тенденции взаимно компенсируют друг друга.
Рассмотрим пример. Два сосуда разного объема содержат по $\nu$ молей одинакового идеального газа. Температуры газов равны $ T_1$ и $ T_2$. Сосуды соединяют, газы перемешиваются. Система приходит в состояние равновесия. Определим изменение энтропии в этом процессе.
Рисунок 1. Изменение энтропии в адиабатном процессе. Автор24 — интернет-биржа студенческих работ
Будем считать, что изобарное расширение каждого из газов до конечного объема является обратимым. В этом процессе температура каждой из газовых компонент изменяется до конечной температуры $\frac
$\Delta S_<1>=\int\limits_a^b \frac
\ln \left(\frac
где $a=T_<1>;b=\frac
Изменение энтропии второго газа запишем аналогично:
$\Delta S_<2>=\nu c_
\ln \left( \frac
Поскольку энтропия является аддитивной величиной, то полное изменение энтропии найдем как сумму:
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Работы, изменения внутренней энерги, энтальпии и энтропи
Изобарный процесс, протекает при постоянном давлении. Уравнение изобарного процесса Р=const.
В соответствии с уравнением политропы Рv n = const политропа превращается в изобару Р=const при показателе политропы n=0.
Теплоемкость изобары cp при n=0 соответствует выражению c=cvк=cp .
Доля теплоты, идущая на увеличение внутренней энергии в изобарном процессе, соответствует величине a=1/к.
Кроме уравнения Р=const, для изобарного процесса можно записать уравнение Tv n-1 = const, которое при n=0 превращается в уравнение T/v=const.
Таким образом, основные величины, характеризующие изобарный процесс, будут представлены выражениями
Р=const, T/v=const, n=0, c=cp, a=1/к.
Теплота изобарного процесса соответствует выражению
а работа изменения объема – выражению
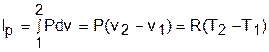
Изменение внутенней энергии, энтальпии и энтропии в изобарном процессе соответствует выражениям
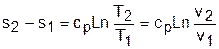
Изохорный процесс, протекает при постоянном объеме.
Уравнение изохорного процесса v=const.
В соответствии с уравнением политропы 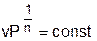
Теплоемкость изохоры при n=±¥ соответствует выражению c=cv. Доля теплоты, идущая на увеличение внутренней энергии в изохорном процессе, соответствует величине a = 1.
Кроме уравнения v=const, для изохорного процесса можно записать уравнение TP (1-n)/n = const, которое при n=±¥ превращается в уравнение T/P=const.
Таким образом, основные величины, характеризующие изохорный процесс, будут представлены выражениями
v = const, T/P = const, n = ±¥, c = cv, a = 1.
Теплота изохорного процесса соответствует выражению
а работа изменения объема равна нулю, т.к. dv=0:
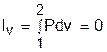
Изменение внутенней энергии, энтальпии и энтропии в изохорном процессе соответствует выражениям
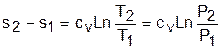
Изотермический процесс, протекает при постоянной температуре. Уравнение изотермического процесса T=const.
В соответствии с уравнением политропы Tv n-1 =const политропа превращается в изотерму Т=const при показателе политропы n=1.
Теплоемкость изотермы при n=1 равна бесконечности: cт=±¥. Доля теплоты, идущая на увеличение внутренней энергии в изотермическом процессе, равна нулю (a = 0).
Кроме уравнения Т=const, для изотемического процесса можно записать уравнение Pv n = const, которое при n=1 превращается в уравнение Pv=const.
Таким образом, основные величины, характеризующие изотермический процесс, будут представлены такими выражениями:
T = const, Pv = const, n = 1, cт = ±¥, a = 0.
Теплота изотермического процесса равна работе, т.к. изменение внутренней энергии идеального газа при Т=const равно нулю:
а работа изменения объема определяется по уравнению
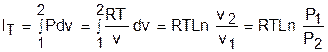
Изменение внутенней энергии и энтальпии в изотермическом процессе для идеального газа равно нулю:
а изменение энтропии определяется выражением
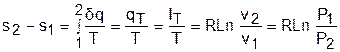
Адиабатный процесс – это процесс без теплообмена с окружающей средой, т.е. для него dq = 0 или q = 0.
Уравнение адиабатного процесса соответствует выражению s=const, т.к. dq=Tds=0 при ds=0. Поэтому адиабатный процесс имеет еще одно название – изоэнтропный процесс.
Теплоемкость адиабаты равна нулю (сs=0), т.к. температура в этом процессе изменяется, а dq=cdT=0.
Показатель политропы при сs=0 будет соответствовать выражению n=cp/cv=к, т.е. показатель политропы в адиабатном процессе равен коэффициенту Пуассона.
Доля теплоты, идущая на увеличение внутренней энергии в адиабатном процессе, равна бесконечности (a=±¥).
Таким образом, основные величины, характеризующие адиабатный процесс, будут представлены выражениями
s = const, Pv к = const, n = к, cs = 0, a = ±¥.
Теплота адиабатного процесса равна нулю, следовательно, для идеального газа в адиабатном процессе работа равна изменению внутренней энергии, взятой с обратным знаком:
Изменение энтальпии в адиабатном процессе ведется традиционно – h2-h1=cp(T2-T1), а изменение энтропии в этом процессе равно нулю – s2-s1=0.
4.3. Изображение политропных процессов
в Р,v и T,s- диаграммах
Политропа в Р,v- диаграмме
На рис.4.2 изображены характерные политропные процессы в Р,v- координатах. Все процессы проведены через общую точку А, что позволяет наглядно сопоставить изображение политроп с различными значениями показателя политропы n.
Показатель политропы определяет характер процесса. В Р,v- координатах политропа описывается уравнением Рv n =const, в соответствии с которым основные процессы будут представлять:
изобара – горизонтальная прямая, n=0, Р=const;
изохора – вертикальная прямая, n=±¥, v=const;
изотерма – равнобокая гипербола с осями асимптот в виде осей координат Р и v, т.к. при n=1 уравнение изотермы p=const/v, причем константа – величина положительная;
адиабата – неравнобокая гипербола, т.к. при n=к>1 уравнение адиабаты Р=const/v к , адиабата круче изотермы.
Политропы при 0 n представляют собой гиперболы, крутизна которых возрастает с увеличением показателя n. Самая крутая из них – изохора (n=¥), а самая пологая – изобара (n=0). Все политропы с положительным показателем n>0 располагаются во II и IV квадрантах относительно точки А.
Политропы с 1 |q|, т.е. в этом случае будет увеличение внутренней энергии (Du=q-l>0) и температуры газа при отводе от него теплоты.
Политропы с отрицательным показателем -¥ -n проходят через начало координат, причем если
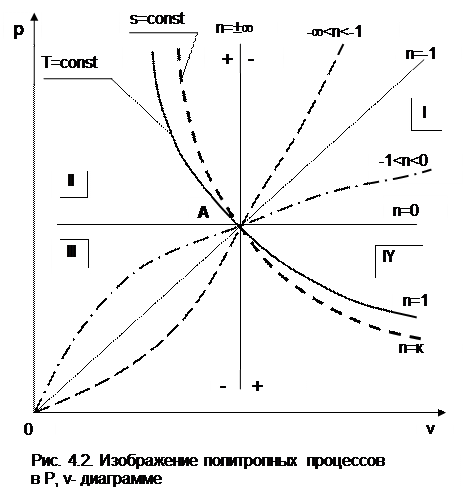 |
n = -1 – это прямая линия,
-1 Т1. Кроме этого, исходя из уравнения изобары Т2/Т1=v2/v1, изотермы в P,v- диаграмме находятся одна над другой (или одна правее другой) по
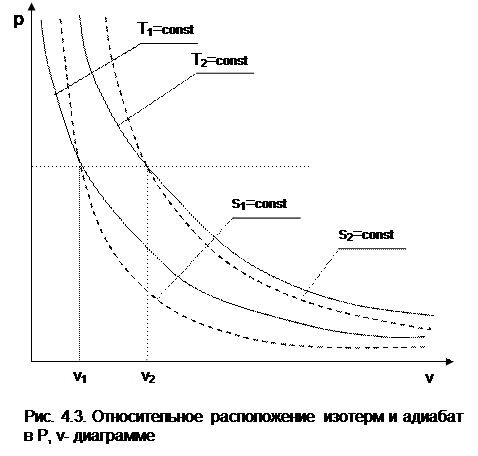 |
возрастающей, т.к. Т2>T1 только при v2>v1.
Для двух адиабат s1=const и s2=const расстояние между ними по оси v можно оценить по любой изобаре P=const. Исходя из уравнений адиабатного и изобарного процессов,
следует, что точке на данной изобаре с большим объемом будет соответствовать большее значение энтропии, т.е. при v2>v1 будет s2>s1. Следовательно, в Р,v- диаграмме адиабаты (изоэнтропы) чем выше (или правее), тем большее значение энтропии им соответствует.
Для изоэнтропы s2 в уравнении Pv к =const=А2 константа А2 будет больше, чем константа А1 изоэнтропы s1 в уравнении Pv к =const=А1, поскольку при Р=const Pv2 к -Pv1 к =А2-А1>0. Выразив объем из уравнения адиабаты v=const/P 1/к , получим расстояние между двумя адиабатами вдоль оси v в виде выражения
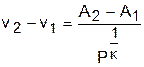
Из этого выражения видно, что с увеличением давления расстояние между адиабатами вдоль оси v в P,v- диаграмме уменьшается, т.е. адиабаты в Р,v- диаграмме не являются эквидистантными кривыми, хотя на всем своем протяжении не пересекаются друг с другом.
Политропа в T,s- диаграмме
Для политропного процесса идеального газа изменение энтропии определяется уравнением (4.13):
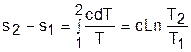
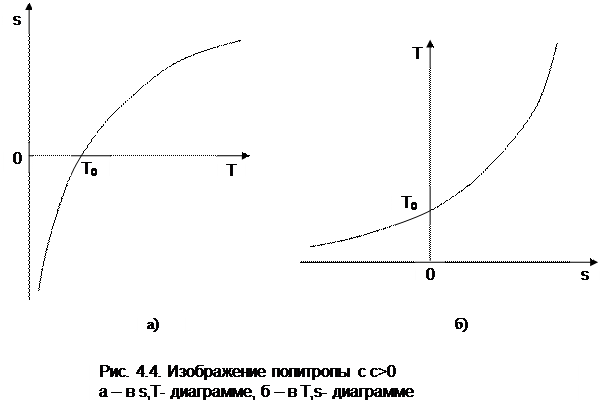 |
Изображение политропы в Т,s- диаграмме ведется в соответствии с этим уравнением при фиксации начала отсчета энтропии (рис.4.4).
В общем случае начало отсчета энтропии so=0 можно зафиксировать любой парой независимых параметров состояния. Для упрощения анализа политропы зафиксируем so=0 точкой, находящейся на нашей политропе при температуре То. В этом случае второй параметр состояния, определяющий so=0, при расчете абсолютного значения энтропии не потребуется, т.к. он определен своим местонахождением на данной политропе. При необходимости его несложно определить через параметры любой точки на данной политропе, воспользовавшись одним из уравнений политропы, включающим температуру, например
Таким образом, расчетное выражение абсолютного значения энтропии можно представить в виде
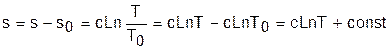
Выражение (4.31) соответствует логарифмической кривой. При положительной теплоемкости c>0 эта кривая в s,T- координатах изображена на рис. 4.4, а. Та же кривая в Т,s- координатах (перевернутых) показана на рис. 4.4, б. Таким образом, в Т,s- координатах политропа представляет логарифмическую кривую.
Политропа с отрицательной теплоемкостью представляет собой логарифмику в виде зеркального отражения политропы с такой же, но положительной теплоемкостью относительно оси Т (рис.4.5).
 |
Причем, если подкасательная любой точки политропы (подкасательная в Т,s- координатах соответствует теплоемкости данной точки процесса) расположена слева от нее, то теплоемкость этой политропы положительная (c>0), если подкасательная расположена справа от точки – теплоемкость политропы отрицательная (с cv. Самая крутая политропа – адиабата, для нее теплоемкость равна нулю. Самая пологая политропа – изотерма, для нее теплоемкость равна бесконечности.
Политропы, проходящие через II и IV квадранты, имеют отрицательную теплоемкость.
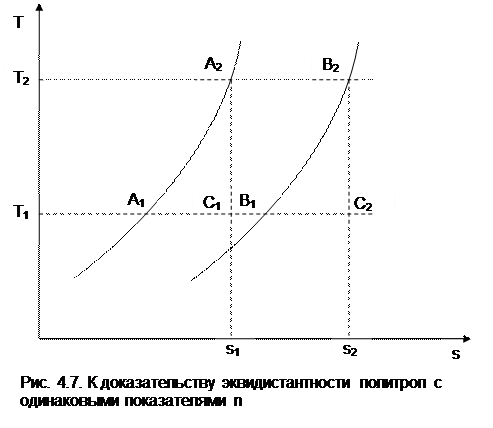
Процессы идеальных газов с одинаковыми показателями политропы в T,s- диаграмме представляют собой эквидистантные по оси s кривые (непересекающиеся, с одинаковым расстоянием друг от друга по оси s). На рис.4.7 изображены в Т,s- диаграмме две политропы идеального газа А1А2 и В1В2 с одинаковым показателем n и соответственно с одинаковыми теплоемкостями. Доказать, что эти политропы эквидистантны несложно. Достаточно рассмотреть расстояние между ними вдоль оси s по двум произвольным изотермам Т1 и Т2. Поскольку теплоемкости этих процессов одинаковые, то изменение энропии на интервале температур Т1-Т2 в этих процессах тоже одинаковое и соответствует отрезкам
А1С1 = В1С2 = 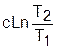
В прямоугольнике С1А2В2С2 противоположные стороны равны (А2В2=С1С2), равны и отрезки А1С1 и В1С2 (А1С1 = В1С2), следовательно, равны и отрезки А1С1 и В1С2 (А1С1 = В1С2). Расстояние между этими политропами по иси s можно рассчитать по формуле оределения изменения энтропии изотермического процесса (4.13) при любой температуре:
s2 — s1
 |
= sB — sA = А1В1 = А2В2 = 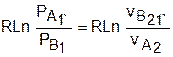
Изобары и изохоры являются частными случаями политроп, следовательно, и они представляют в Т,s- диаграмме эквидистантные по оси s кривые. В Т,s- координатах (рис.4.8) изобары находятся одна над другой по возрастающей, а изохоры одна под другой по возрастающей, т.к. если брать расстояние между ними по изотерме, оно будет равно положительной разности энтропий,
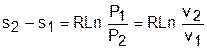
http://energoworld.ru/theory/osnovnyie-termodinamicheskie-protsessyi/
http://mydocx.ru/1-38640.html














