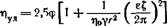Вязкость дисперсных систем
Важной характеристикой структурно-механических свойств является течение. Течение бывает ламинарным и турбулентным.
Ламинарное течение – движение жидкости в виде параллельных слоев, имеющих различную скорость и не смещающихся между собой. Возникает при низкой скорости течения и малом перепаде давления.
Турбулентное течение – течение, сопровождающееся вихреобразованием.
В соответствие с уравнением Ньютона сила сопротивления при течении F прямо пропорциональна градиенту скорости du и площади поверхности потока S:
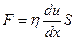
где η – коэффициент пропорциональости или вязкость, зависит от природы жидкости Единицей измерения вязкости является пуаз (пз), 1 пз = Па∙с= Н∙с/м 2 . Единица измерения вязкости названа в честь франц. учёного Пуазейля, который впервые изучал движение жидкости в капиллярах.
Ламинарное течение по трубкам или скорость течения жидкости из капилляра описывается уравнением Пуазейля (1842г.), которое было найдено экспериментальным путём:
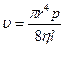
где u — объемная скорость течения;
r – радиус капилляра трубки;
Δp – перепад давления или разность давления на обоих концах трубки;
Η – вязкость жидкости;
l – длина капилляра.
Величина, обратная вязкости 

Жидкости, у которых отсутствует зависимость вязкости от характера взаимодействия частиц, подчиняются законам Ньютона и Пуазейля и называются ньютонскими жидкостями. Уравнение Ньютона и Пуазейля соблюдается, если жидкость движется ламинарно.
Вязкость дисперсных систем всегда превышает вязкость чистой дисперсионной среды. Зависимость вязкости коллоидной системы от концентрации дисперсной фазы выражается уравнением Эйнштейна (1906г.):
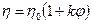
где η – вязкость коллоидной системы;
η0 – вязкость чистого растворителя (дисперсионной среды);
φ – объемная доля частиц дисперсной фазы;
k – коэффициент, характеризующий форму частицы. Для сферической формы k = 2,5.
Для структурированных систем законы Ньютона не выполняются.
Экзаменационные билеты по коллоидной химии. Экзаменационный билет 1
| Название | Экзаменационный билет 1 |
| Анкор | Экзаменационные билеты по коллоидной химии.doc |
| Дата | 10.04.2017 |
| Размер | 3.47 Mb. |
| Формат файла |  |
| Имя файла | Экзаменационные билеты по коллоидной химии.doc |
| Тип | Документы #4693 |
| Категория | Химия |
| страница | 9 из 12 |
| Подборка по базе: квартальные и годовые зачёты 2018 билеты новые .doc, экзамен Психология. Билет 5.doc, 13 БИЛЕТ.docx, 1 билет.docx, анализ билет 12.docx, Ответы на билеты по автоматизации.docx, ответы на билеты 6 класс (1).docx, Экзаменационные билеты по дисциплине «Микроэкономика».doc, бх 3 апта билеттер.docx, Ответы на экзаменационные вопросы по экономике морского транспор Общее определение поверхностной активности дается соотношением: Поверхностная активность, как и гиббсовская адсорбция, может быть положительной и отрицательной. Абсолютное значение и ее знак зависят от природы как адсорбируемого вещества, так и среды (растворителя). Если с увеличением концентрации вещества поверхностное натяжение на границе раздела фаз понижается, то такое вещество называют поверхностно-активным. Для таких веществ Вещества, повышающие поверхностное натяжение на границе раздела фаз с увеличением концентрации, называют поверхностно-инактивными. Для них
Ж Общую зависимость напряжения сдвига от скорости деформации можно выразить в виде степенной функции: Если n = 1, то данное соотношение переходит в уравнение Ньютона. Это двухпараметрическое уравнение известно под названием математической модели Оствальда — Вейля. Ньютоновская вязкость η неньютоновской стационарной жидкости определяется уравнением Если n = 1, жидкость является ньютоновской и константа k совпадает со значением ньютоновской вязкости (кривая 1). Таким образом, отклонение n от единицы характеризует степень отклонения свойств жидкости от ньютоновских. Основы теории вязкости разбавленных лиозолей (суспензий) были заложены Эйнштейном. Он исходил из гидродинамических уравнений для систем макроскопических твердых сферических частиц,, которые при сдвиге приобретают дополнительное вращательное движение. Возникающее при этом рассеяние энергии является причиной возрастания вязкости. Эйнштейном была установлена связь между вязкостью дисперсной системы η и объемной долей дисперсной фазы φ: Формула Эйнштейна не учитывает наличия у частиц поверхностных слоев, таких как адсорбционные, сольватные и двойные электрические. Оно было получено в предположении отсутствия взаимодействия между частицами дисперсной фазы, поэтому оно справедливо только для разбавленных растворов. С увеличением концентрации дисперсной фазы взаимодействие частиц возрастает, и его необходимо учитывать. Одним из приборов для определения вязкости является капиллярный вискозиметр. При измерении капиллярным вискозиметром, вязкость рассчитывают по уравнению Пуазейля: Для исследования вязкости неньютоновских жидкостей используется ротационный вискозиметр.
Экзаменационный билет № 18
Адгезия, смачивание и растекание относятся к межфазным взаимодействиям, которые происходят между конденсированными фазами. Межфазное взаимодействие, или взаимодействие между приведенными в контакт поверхностями конденсированных тел разной природы, называют адгезией (прилипанием). Смачивание— это поверхностное явление, заключающееся во взаимодействии жидкости с твердым или другим жидким телом при наличии одновременного контакта трех несмешивающихся фаз, одна из которых обычно является газом (воздухом). Степень смачивания количественно характеризуется косинусом краевого угла (угла смачивания), или просто краевым углом (углом смачивания). Капля жидкости, нанесенная на поверхность, может оставаться на ее определенном участке, и система будет находиться в равновесии в соответствии с законом Юнга, или же растекаться по поверхности. В обоих этих случаях система переходит в состояние с минимальной энергией Гиббса. Если капля не растекается, то, кал было показано выше, краевой угол зависит от соотношения работ адгезии Wа и когезии Wк смачивающей жидкости. Рассмотрим условия растекания жидкости 2 по поверхности 3. Изменение энергии Гиббса можно записать следующим пбразом: Для самопроизвольного процесса dG 0: Если разность заменить выражением из уравнения Дюпре, то получим или Разницу между левой и правой частями этих неравенств называют коэффициентом растекания f по Гаркинсу: При положительном значении коэффициента f жидкость растекается по поверхности, при отрицательном — нe растекается. Введение ПАВ уменьшает работу когезии (поверхностное натяжение) жид к ости а значит, как следует из уравнения Дюпре-Юнга, увеличивает смачивание. Лучше смачивает та жидкость, которая имеет меньшее поверхностное натяжение или работу когезии.
Принцип седиментационного метода анализа дисперсности состоит в измерении скорости осаждения частиц, обычно в жидкой среде. По скорости осаждения с помощью соответствующих уравнений рассчитывают размеры частиц. Метод позволяет определить распределение частиц по размерам и соответственно подсчитать их удельную поверхность. П Имеются графические и аналитические методы расчета кривой седиментации. Реальная кривая седиментации полидисперсной системы обычно получается плавной и ей отвечает множество бесконечно малых участков, касательные в каждой точке этой кривой отражают седиментацию данной бесконечно малой фракции. Р Кривая распределения является наглядной и удобной характеристикой полидисперсности системы, по которой легко определить содержание различных фракций. Ее строят подобно кривой распределения пор по размерам. Обычно сначала получают интегральную кривую распределения, проводят ее выравнивание с учетом точности получаемых средних значений радиусов частиц фракций и затем по ней строят дифференциальную кривую распределения. Иногда дифференциальную кривую строят сразу. На оси абсцисс откладывают значения радиусов; на ось ординат наносят отношение приращения массовых долей к разности радиусов частиц соседних фракций Δx/Δri. Построив на графике отдельные прямоугольники для каждой фракции (гистограмму) и соединив плавной кривой середины их верхних сторон, получают дифференциальную кривую распределения частиц полидисперсной системы по размерам. Для осуществления седиментации ультрамикрогетерогенных систем русский ученый А. В. Думанский в 1912 г. предложил использовать центробежное поле. Этот способ удалось реализовать шведскому ученому Сведбергу, который разработал центрифугу с частотой вращения в несколько десятков тысяч оборотов в секунду. Центробежная сила Fц, как и нормальное ускорение а, пропорциональна кривизне траектории движения частицы (при постоянной линейной скорости u): Равновесие между Fтр и Fц, которое наступает при седиментации, удобнее записать таким образом (чтобы оставить одну переменную от времени): Разделяя переменные в полученном соотношении и интегрируя его в пределах от начального расстояния x0 до x и соответственно от τ = 0 до τ, получим: По характеристикам седиментации в центробежном поле при частоте вращения ротора в несколько десятков тысяч оборотов в секунду можно рассчитывать молекулярную массу, например, полимеров. Определив массу m или размер r макромолекулы, мольную массу (численно равную молекулярной массе) рассчитывают по формуле:
Экзаменационный билет № 19
Дисперсность является самостоятельным и полноправным термодинамическим параметром системы, а для дисперсных систем правило фаз Гиббса принимает следующий вид: F – количество степеней свободы, К – количество компонентов, Ф – количество фаз. Р Кривизна вызывает изменение площади и положения межфазной поверхности, что можно выразить приращением поверхностной энергии σds. Кроме того, изменяются объемы фаз V1 и V2 на dV1 и dV2. При условии постоянства объема всей системы dV1 = — dV2. Изменение объемов вызывает соответствующие изменения энергий фаз 1 и 2 на p1dV1 и p2dV2 (где p1 и р2 — давления внутри фаз). Соотношение между поверхностной энергией и «объемной» можно записать с помощью обобщенного уравнения первого и второго начал термодинамики относительно энергии Гельмгольца F при T=const: При равновесии между фазами ΔF = 0, тогда Это уравнение называется уравнением Лапласа. Для сферической поверхности Капиллярные явления наблюдаются в содержащих жидкость узких сосудах (капилляры, капиллярно-пористые тела), у которых расстояние между стенками соизмеримо с радиусом кривизны поверхности жидкости. Кривизна возникает в результате взаимодействия жидкости со стенками сосуда (адгезия, смачивание). Специфика поведения жидкости в капиллярных сосудах зависит от того, смачивает или не смачивает жидкость стенки сосуда, точнее, от значения краевого угла. Р Чтобы высоту капиллярного поднятия связать с характеристикой смачивания, радиус мениска необходимо выразить через угол смачивания θ и радиус капилляра r0. На рисунке показан мениск жидкости в капилляре. Видно, что r0 = r·соsθ, тогда высоту капиллярного поднятия можно представить в виде формулы Жюрена: Н
Основой доказательства теплового молекулярного движения в телах явилось обнаруженное английским ботаником Робертом Броуном в 1827 г. с помощью микроскопа непрерывное движете очень мелких частичек — спор папоротника (цветочной пыльцы), взвешенных в воде. Более крупные частицы находились в состоянии постоянного колебания около положения равновесия. Колебания и перемещения частиц ускорялись с уменьшением их размера и повышением температуры и не были связаны с какими-либо внешними механическими воздействиями. Теоретически обоснованная интерпретация броуновского движения — участие частиц дисперсной фазы ультрамикрогетерогенных систем в тепловом движении — была дана независимо друг от друга Эйнштейнии (1905 г.) и Смолуховским (1906 г.). Проведенными исследованиями была окончательно доказана природа броуновского движения. Молекулы среды (жидкости или газа) сталкиваются с частицей дисперсной фазы, в результате чего она получает огромное число ударов со всех сторон. Э Под микроскопам наблюдают проекцию смещения частицы на плоскость за какое-то время, поэтому При равновероятных отклонениях частицы ее направление будет находиться между направлениями x и у, т. е. под углом 45° к каждой координате. Отсюда Из-за равновероятных отклонений среднеарифметическое значение сдвигов равно нулю. Поэтому используются среднеквадратичные расстояния, проходимые частицей: Эйнштейн и Смолуховский, постулируя единство природы броуновского движения и теплового движения, установили количественную связь между средним сдвигом частицы (называемым иногда амплитудой смещения) и коэффициентом диффузии D. Если броуновское движение является следствием теплового движения молекул среды, то можно говорить о тепловом движении частиц дисперсной фазы. Это означает, что дисперсная фаза, представляющая собой совокупность числа частиц, должна подчиняться тем же статистическим законам молекулярно-кинетической теории, приложимым к газам или растворам. Д Так как |Q1| > |Q2| (ν1>ν2), то суммарное количество перенесенного вещества через плоскость MN вправо определится соотношением Градиент концентрации по расстоянию в направлении диффузии можно выразить так: Подставляя, получим: Сравнивая это соотношение с первым законом диффузии Фика: Лако-красочные материалы — производствоТехнологии и оборудование для изготовления красок, ЛКМЗАВИСИМОСТЬ ВЯЗКОСТИ КОЛЛОИДНЫХ СИСТЕМ ОТ КОНЦЕНТРАЦИИ ДИСПЕРСНОЙ ФАЗЫВязкость коллоидных систем всегда выше вязкости чистой дисперсионной среды. Эйнштейн в 1906 г., исходя из чисто гидродинамических представлений, вывел уравнение, устанавливающее связь между вязкостью системы rj. и концентрацией дисперсной фазы: 11 = т1о(1 +2,5Ф) (X, 17) Где Т]0 — вязкость дисперсионной среды; ф — объемная концентрация дисперсной фазы. Уравнение (X,17) пригодно только при условии, что взвешенные в жидкости частицы являются твердыми шарообразными телами, концентрация дисперсной^ фазы сравнительно невелика и между частицами отсутствуют взаимодействия. Кроме того, для Соблюдения уравнения Эйнштейна необходимо, чтобы система была несжимаема, течение жидкости носило ламинарный характер, между частицами и жидкостью отсутствовало скольжение и, наконец, чтобы частицы были велики по сравнению со свободным пробегом молекул среды, но малы по сравнению с пространством, в котором происходит течение. Значение численного коэффициента в уравнении (X, 17) зависит от формы частиц. Поэтому в общем виде уравнение Эйнштейна можно записать так: Где а — множитель, зависящий от формы частиц. Уравнение Эйнштейна часто пишут также следующим образом: (тіЛіо) — 1 = (ті — чіо)/тіо = a Где ti/tjo — отношение вязкости системы к вязкости среды (относительная вязкость) ; п — общее число частиц в системе; о — объем одной частицы дисперсной фазы; V — объем системы, мл. ‘ Величину (т] — Ло)/»По. характеризующую относительное увеличение вязкости дисперсионной среды при введении в нее определенного количества дисперсной фазы, не совсем правильно называют удельной вязкостью. Ее обычно обозначают символом т]уд. Из предыдущего следует, ЧТО Из всего сказанного следует, что, по Эйнштейну, между вязкостью системы и содержанием в ней дисперсной фазы должна су-» ществовать прямолинейная зависимость. Весьма существенно также, что, согласно Эйнштейну, вязкость не зависит от дисперсности суспензии. Экспериментальную проверку уравнения Эйнштейна проводили Банселен на суспензиях гуммигута, Оден на золях серы и наиболее обстоятельно Эйрих на суспензиях мельчайших стеклянных шариков, шарообразных спор грибов и дрожжевых клеток. Во всех этих исследованиях при сферической форме частиц и малых концентрациях дисперсной фазы численный коэффициент при (р имел значение, близкое к 2,5. Отклонения наблюдались, когда частицы не были шарообразны, концентрация дисперсной фазы в суспензии была значительной и между частицами существовали электрические или другие силы взаимодействия. Влияние анизодиаметричности частиц. При палочкообразной, эллипсоидной или пластинчатой форме частиц суспензии вязкость системы всегда больше, чем должна быть согласно уравнению Эйнштейна. Причина этого заключается в том, что жидкость, попадающая в объем (эллипсоид вращения), образующийся вокруг нешарообразных частиц, находящихся в интенсивном броуновском движении, становится как бы связанной с частицей. В результате Этого возникает кажущееся увеличение объемной доли дириерсной фазы в системе, что и приводит к повышению вязкости. Экспериментально показано, что вязкость суспензии С малыми анизодиамет — рическими частицами, находящимися обычно в интенсивном броуновском движении, повышается пропорционально квадрату отношения большой и малой осей эллипсоида вращения, а вязкость суспензии с достаточно большими нешарообразными частицами, совершающими медленное броуновское движение, возрастает лишь прямо пропорционально отношению осей. Теоретические вычисления, проведенные Куном, Симха и другими исследователями с использованием в качестве моделей частиц самой разнообразной формы, весьма сложны и не всегда убедительны. Поэтому до сих пор еще иет общей теории зависимости вязкости коллоидных систем от формы частиц. Вязкость систем, содержащих анизодиаметрические частицы, как мы видели, зависит от скорости течения. Вытянуты^ частицы ориентируются в потоке, вращательное движение их затрудняется и в результате этого вязкость системы с увеличением скорости течения снижается. Подобное явление можно наблюдать, например, при измерении вязкости золя V2O5, частицы которого сильно ани- зодиаметричны. Влияние истинной концентрации дисперсной фазы и сольватации. Отличие вязкости концентрированной дисперсной системы от значений вязкости, вычисленной по уравнению Эйнштейна, объясняется тем, что в жидкости около частиц возникают взаимовозму — щающие микропотоки, затрудняющие движение системы. Дебройн считает, что при этом, помимо гидродинамических взаимодействий, необходимо учитывать также и механические (столкновения частиц, образование пар и т. д.). При очень малых концентрациях суспензии поток, возникающий вокруг одной частицы, очень мало влияет на потоки, возникающие около других частиц, и на скорость движения всего потока жидкости в целом. Однако с увеличением концентрации дисперсной фазы это влияние все увеличивается и приводит к отклонению от закона Эйнштейна. Другое объяснение отклрнения вязкости дисперсных систем от значений, найденных с помощью уравнения Эйнштейна, заключается в сольватации частиц. Явление сольватации может объяснить и часто наблюдающуюся зависимость вязкости от дисперсности системы при одинаковой объемной концентрации дисперсной фазы. Влияние сольватации можно представить следующим образом. Если к поверхности шарообразной частицы радиусом г прилип слой дисперсионной среды толщиной H, то влияющий на вязкость эффективный объем частицы (объем самой частицы вместе с объемом сольватного слоя) составляет 4/зя(г + /г)3. Для значений H, малых по сравнению с г, будем иметь 4/зЯ(г3 + 3/»2/г). Соответственно этому при вычислении эффективной объемной концентрации дисперсной фазы ф за объем дисперсной фазы следует принять не величину 4/3 nr3v, а 4/зя(г3+3r2ft)v (где v — численная концентрация). Если принять истинный объем дисперсной фазы ф0 = 4/злг, то для ф получаем: Следовательно, .величина ф окажется больше объема дисперсной фазы фо, и эта величина будет тем больше, чем меньше частицы. Иными словами, вязкость возрастает с уменьшением размера частиц зеля. Подобное возрастание иязкости при повышении степени дисперсности золя серы наблюдал Свен Оден. Фикенчер и Марк для учета влияния сольватации предложили модифицировать уравнение Эйнштейна, введя в него соответствующую поправку. Согласно этим авторам, в уравнении Эйнштейна, так же как и в уравнении Ван-дер-Ваальса, вместо общего объема системы следует ввести эффективный объем, т. е. объем системы за вычетом объема частиц. Так как частицы в системе находятся в сольватированном состоянии и, кроме того, совершают броуновское движение, описывая некие тела вращения, то объем дисперсионной среды, энергетически и стерически связанной с частицами, также следует причислить к объему дисперсной фазы. Тогда уравнение (X, 18) примет вид: Где о’ — объем частицы имеете с энергетически и стерически связанной с ней средой. Уравнение Фикенчера и Марка хорошо объясняет, почему в некоторых случаях вязкость возрастает с увеличением концентрации дисперсной фазы быстрее, чем это должно быть в соответствии с прямолинейной зависимостью. Действительно, с увеличением концентрации дисперсной фазы в растворе возрастает пропорциональная ей величина п в числителе и одновременно уменьшается величина (V — Nv‘) в знаменателе, что и приводит к более быстрому возрастанию вязкости, чем концентрации. Влияние взаимодействия между частицами. Причина неприменимости в некоторых случаях уравнения Эйнштейна к дисперсным системам может заключаться в проявлении сил притяжения между коллоидными частицами. При этом в системе образуются более или менее рыхлые структуры, которые включают значительные объемы дисперсионной среды. Подобная иммобилизация, т. е. уменьшение подвижности растворителя, приводит к тому, что вязкость системы оказывается гораздо больше той, которая может быть вычислена по уравнению Эйнштейна. Вязкость в таких системах сильно зависит от скорости течения, так как представляет собой структурную вязкость, обусловленную наличием в системе рыхлых пространственных сеток. . С другой стороны, непрйменимость уравнения Эйнштейна к коллоидным системам может быть связана и с проявлением сил отталкивания между частицами, несущими одноименный электрический заряд. Согласно Смолуховскому, вязкость золей с заряженными частицами выше вязкости золей с незаряженными частицами. Повышение вязкости в результате наличия на поверхности частиц двойного электрического слоя называется электровязкостным Эф* Фектом. Смолуховский вывел следующее уравнение, связывающее удельную вязкость золя с электрокинетическим ^-потенциалом двойного электрического слоя частиц: Где т]о — вязкость дисперсионной среды; у — удельная электропроводность; г — радиус частиц; е — диэлектрическая проницаемость Поправочный член в уравнении (X, 22) может иметь весьма большое значение. Подсчеты показывают, что для золей, радиус частиц которых равен 10_6 см, а электропроводность у = — Ю-4 Ом-1-см-1, поправочный член может быть в 10 раз больше основного. Согласно уравнению Смолуховского, вязкость коллоидных систем при введении электролитов должна уменьшаться как вследствие снижения ^-потенциала, так и в результате увеличения электропроводности межмицеллярной жидкости. В изоэлектрическом состоянии золя (при % = 0) уравнение Смолуховского переходит в уравнение Эйнштейна. Следует, однако, отметить, что при астабилизации коллоидной системы введением в нее электролита (вследствие уменьшения сил отталкивания между частицами в золе) возможны явления агрегации частиц, приводящие к образованию структур и появлению структурной вязкости, что не предусмотрено уравнением Смолуховского. В результате этого понижение ^-потенциала частиц золя в определенных условиях может не только не вызывать понижения вязкости золя, но и обусловить ее повышение. Буутс в 1948 г. вывел уравнение для электровязкостного эффекта, существенно отличающееся от уравнения Смолуховского. Согласно Буутсу, величина электровязкостного эффекта значительно меньше, чем об этом можно судить по уравнению Смолуховского, и независимо от значения ^-потенциала становится ничтожной, когда толіЦииа двойного электрического слоя очень мала по сравнению с радиусом частиц. источники: http://topuch.ru/ekzamenacionnij-bilet-1/index9.html http://kraska.biz/kurs-kolloidnoj-ximii/zavisimost-vyazkosti-kolloidnyx-sistem-ot-koncentracii-dispersnoj-fazy/ |



 идкообразные тела классифицируют на ньютоновские и неньютоновские жидкости. Ньютоновскими жидкостями называют системы, вязкость которых не зависит от напряжения сдвига и является постоянной величиной в соответствии с законом Ньютона: P = η
идкообразные тела классифицируют на ньютоновские и неньютоновские жидкости. Ньютоновскими жидкостями называют системы, вязкость которых не зависит от напряжения сдвига и является постоянной величиной в соответствии с законом Ньютона: P = η  Течение неньютоновских жидкостей не следует закону Ньютона, их вязкость зависит от напряжения сдвига. В свою очередь, они подразделяются на стационарные, реологические свойства которых не изменяются со временем, и нестационарные, для которых эти характеристики зависят от времени. Среди неньютоновских стационарных жидкостей различают псевдопластические и дилатантные. Типичные зависимости скорости деформации жидкообразных тел от напряжения (кривые течения, или реологические кривые) представлены на рисунке.
Течение неньютоновских жидкостей не следует закону Ньютона, их вязкость зависит от напряжения сдвига. В свою очередь, они подразделяются на стационарные, реологические свойства которых не изменяются со временем, и нестационарные, для которых эти характеристики зависят от времени. Среди неньютоновских стационарных жидкостей различают псевдопластические и дилатантные. Типичные зависимости скорости деформации жидкообразных тел от напряжения (кривые течения, или реологические кривые) представлены на рисунке.
 .
.




 или
или ри седиментационном анализе дисперсности полидисперсных систем определяют время осаждения частиц отдельных фракций, рассчитывают скорости их осаждения и соответствующие им размеры частиц. Для этого сначала измеряют зависимость массы осевшего осадка от времени, строят график этой зависимости, называемой кривой седиментации, по которому затем определяют все необходимые характеристики дисперсной системы.
ри седиментационном анализе дисперсности полидисперсных систем определяют время осаждения частиц отдельных фракций, рассчитывают скорости их осаждения и соответствующие им размеры частиц. Для этого сначала измеряют зависимость массы осевшего осадка от времени, строят график этой зависимости, называемой кривой седиментации, по которому затем определяют все необходимые характеристики дисперсной системы. езультаты седиментациоиного анализа дисперсности полиднсперсных систем представляют также в виде кривых распределения частиц по размерам, характеризующих степень полиднсперсности системы.
езультаты седиментациоиного анализа дисперсности полиднсперсных систем представляют также в виде кривых распределения частиц по размерам, характеризующих степень полиднсперсности системы.

 или
или 



 ассмотрим результат влияния кривизны поверхности раздела между двумя несмешивающимися жидкостями на внутреннее давление в фазах.
ассмотрим результат влияния кривизны поверхности раздела между двумя несмешивающимися жидкостями на внутреннее давление в фазах.

 и уравнение принимает вид
и уравнение принимает вид  .
. ассмотрим положение уровней жидкости в двух капиллярах, один из которых имеет лиофильную поверхность и поэтому стенки его смачиваются, у другого внутренняя поверхность лиофобизирована и не смачивается. В первом капилляре поверхность жидкости имеет отрицательную кривизну, поэтому дополнительное давление Лапласа стремится растянуть жидкость (давление направлено к центру кривизны) и поднимает ее в капилляре. Кривизна поверхности жидкости во втором капилляре положительна, дополнительное давление направлено внутрь жидкости, в результате жидкость в капилляре опускается (отрицательное капиллярное поднятие). При равновесии лапласовское давление равно гидростатическому давлению столба жидкости высотой h:
ассмотрим положение уровней жидкости в двух капиллярах, один из которых имеет лиофильную поверхность и поэтому стенки его смачиваются, у другого внутренняя поверхность лиофобизирована и не смачивается. В первом капилляре поверхность жидкости имеет отрицательную кривизну, поэтому дополнительное давление Лапласа стремится растянуть жидкость (давление направлено к центру кривизны) и поднимает ее в капилляре. Кривизна поверхности жидкости во втором капилляре положительна, дополнительное давление направлено внутрь жидкости, в результате жидкость в капилляре опускается (отрицательное капиллярное поднятие). При равновесии лапласовское давление равно гидростатическому давлению столба жидкости высотой h:


 ередко приходится наблюдать, как жидкость не может вытечь из капилляра под действием силы тяжести. Это объясняется проявлением действия капиллярного потенциала, направленного против силы тяжести, так как на нижнем конце капилляра жидкость образует мениск с положительной кривизной. Если часть капилляра, находящаяся над жидкостью, меньше высоты поднятия жидкости, жидкость из него не вытекает, так как кривизна мениска жидкости вверху капилляра становится положительной (положительный радиус кривизны), отвечающей гидростатическому давлению столба жидкости, равному размеру (высоте) капилляра, т. е. устанавливается равновесие.
ередко приходится наблюдать, как жидкость не может вытечь из капилляра под действием силы тяжести. Это объясняется проявлением действия капиллярного потенциала, направленного против силы тяжести, так как на нижнем конце капилляра жидкость образует мениск с положительной кривизной. Если часть капилляра, находящаяся над жидкостью, меньше высоты поднятия жидкости, жидкость из него не вытекает, так как кривизна мениска жидкости вверху капилляра становится положительной (положительный радиус кривизны), отвечающей гидростатическому давлению столба жидкости, равному размеру (высоте) капилляра, т. е. устанавливается равновесие. йнштейн и Смолуховский для количественного выражения броуновского движения частиц ввели представление о среднем сдвиге частицы. Если при наблюдении движения частицы золя под микроскопом через определенные равные промежутки времени отмечать ее местонахождение, то можно получить ее траекторию движения. Так как движение происходит в трехмерном пространстве, то квадрат среднего расстояния, проходимого частицей за любой промежуток времени, равен
йнштейн и Смолуховский для количественного выражения броуновского движения частиц ввели представление о среднем сдвиге частицы. Если при наблюдении движения частицы золя под микроскопом через определенные равные промежутки времени отмечать ее местонахождение, то можно получить ее траекторию движения. Так как движение происходит в трехмерном пространстве, то квадрат среднего расстояния, проходимого частицей за любой промежуток времени, равен  .
. .
. или
или  .
.
 ля установления связи между средним сдвигом (смещением) частицы и коэффициентом диффузии представим себе трубку с поперечным сечением S, наполненную золем, концентрация частиц которого уменьшается слева направо. В этом же направлении протекает и диффузия частиц золя (на рисуике отмечено стрелкой). Выделим по обе стороны от линии MN два малых участка 1 и 2, размеры которых в направлении диффузии равны Δ — среднему квадратичному сдвигу за время τ. Обозначим частичную концентрацию золя в объемах этих участков соответственно через ν1 и ν2 (ν1>ν2). Хаотичность теплового движения приводит к равной вероятности переноса дисперсной фазы из обоих объемов вправо и влево от линии MN: половина частиц переместится вправо, а другая половина — влево. Количество дисперсной фазы за время τ переместится из объема 1 вправо:
ля установления связи между средним сдвигом (смещением) частицы и коэффициентом диффузии представим себе трубку с поперечным сечением S, наполненную золем, концентрация частиц которого уменьшается слева направо. В этом же направлении протекает и диффузия частиц золя (на рисуике отмечено стрелкой). Выделим по обе стороны от линии MN два малых участка 1 и 2, размеры которых в направлении диффузии равны Δ — среднему квадратичному сдвигу за время τ. Обозначим частичную концентрацию золя в объемах этих участков соответственно через ν1 и ν2 (ν1>ν2). Хаотичность теплового движения приводит к равной вероятности переноса дисперсной фазы из обоих объемов вправо и влево от линии MN: половина частиц переместится вправо, а другая половина — влево. Количество дисперсной фазы за время τ переместится из объема 1 вправо:  , а из объема 2 влево (в обратном направлении):
, а из объема 2 влево (в обратном направлении): .
. .
.

 , окончательно имеем:
, окончательно имеем: