Вязкость коллоидных растворов
Вязкостью (η) называют внутреннее трение между слоями данного вещества, движущимися относительно друг друга (сопротивление жидкости или газа течению под действием внешних сил).
Вязкость является результатом межмолекулярного взаимодействия, и она тем выше, чем больше силы межмолекулярного притяжения. Вязкость жидкостей может сильно изменяться в присутствии растворенных или диспергированных веществ. Вязкость большинства гидрофобных золей и суспензий при малых концентрациях почти не отличается от вязкости чистого растворителя. По мере увеличения концентрации дисперсной фазы вязкость коллоидного раствора увеличивается. Это объясняется тем, что частицы ДФ взаимодействуют между собой и образуют пространственные сетки (структуры), а с молекулами дисперсионной среды – сольватные оболочки и тем самым преграждают путь слоям движущейся жидкости. В результате обтекания частиц, траектория течения жидкости искривляется, удлиняется и в единицу времени вытекает меньший объем жидкости. Этот эффект усиливается, если частицы имеют удлиненную форму, т.к. они могут вращаться вокруг своей поперечной оси (как пропеллер) под действием движущейся жидкости.
Эйнштейном установлена зависимость вязкости коллоидного раствора от концентрации взвешенных частиц. При этом были допущены, что:
─ частицы ДФ удалены друг от друга
─ частицы ДФ имеют одинаковый размер и форму
─ между частицами ДФ отсутствуют взаимодействия
─ размер частиц больше размера молекул растворителя.
η = ηо(1+ αj), где α – коэффициент, зависящий от формы частиц. Для частиц круглой формы α = 2,5; для удлиненных частиц α > 2,5. j — объемная доля дисперсной фазы. ηо – вязкость дисперсионной среды.
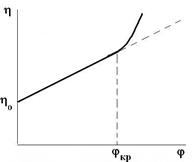 Рис. Рис. | Графически уравнение Эйнштейна должно выражаться прямой. Однако при повышении некоторой критической концентрации, вязкость не подчиняется уравнению Эйнштейна. Это объясняется 2-мя факторами: 1) частицы имеют больший размер и сольватную оболочку, т.е. большую поверхность поперечного сечения; 2) частицы взаимодействуют между собой образуя агрегаты, структуры, ограничивающие подвижность жидкости. |
Поэтому уравнение Эйнштейна применимо для золей и разбавленных
суспензий, у которых частицы ДФ не взаимодействуют с дисперсионной средой (т.е. для лиофобных систем).
4.1.2. Вязкость разбавленных дисперсных систем
Если в разбавленных дисперсных системах (при отсутствии взаимодействия между диспергированными частицами) размер частиц оказывается значительно большим, чем размер молекул жидкости, но намного меньшим, чем радиус капилляров, по которым такая жидкость течет, то макроскопическая вязкость, измеренная каким-либо методом, будет отличаться от вязкости чистой жидкости, хотя течение такой системы может быть описано законом Ньютона. Происходит это потому, что частица, по своим размерам намного превосходящая молекулы жидкости, искажает картину течения слоев жидкости.
Для сферических частиц расчет вязкого сопротивления потока жидкости, в котором находятся сферические частицы, был проведен Стоксом.
Для несжимаемых гладких сферических частиц, движущихся вдали от стенок капилляра так, что плоскость разрыва между частицей и жидкой фазой проходит в жидкости, сила, уравновешивающая силу потока на неподвижную частицу, составит
где r – радиус частиц, U0 – скорость движения частицы относительно жидкости, h – вязкость жидкости.
Сила трения и коэффициент вязкого сопротивления движению асимметричных частиц зависит от ориентации таких частиц в потоке жидкости. Существует ряд уравнений для расчета коэффициента трения В для частиц различной формы.
Влияние частиц дисперсной фазы на вязкое течение жидкостей будет состоять в том, что те слои, которые прилегают непосредственно к частицам, могут перемещаться только с той же скоростью, что и частицы. Этот эффект был рассчитан Эйнштейном (1906 г.) для сферических частиц. Принимая, что на достаточном удалении от поверхности частицы поток имеет постоянную скорость, а сама частица перемещается вместе с потоком, Эйнштейн получил уравнение для вязкости дисперсной системы
где h – вязкость дисперсной среды; j – объемная доля частиц дисперсной фазы; 2,5 – коэффициент формы сферических частиц; hотн= h/h0– относительная вязкость.
Симха распространил метод Эйнштейна на дисперсии с частицами, имеющими форму, отличающуюся от сферической при низких градиентах скорости течения, когда частицы ориентированы длинной осью параллельно течению, получил уравнение
гдеu – коэффициент формы частиц; для асимметричных частиц всегда больше 2,5.
При больших градиентах скорости течения частицы могут располагаться беспорядочно, в том числе и поперек течения, что приводит к образованию локальных турбулентных областей, для таких дисперсий характерно неньютоновское течение.
Уравнение (2.4.16), известное как уравнение Симха-Эйштейна, общее как для сферических, так и для несферических частиц, часто записывают в форме
где hуд– удельная вязкость – безразмерная величина, показывающая приращение вязкости относительно вязкости дисперсионной среды, приходящееся на дисперсную фазу.
Можно отметить, что удельная вязкость зависит только от общего объема, занятого дисперсной фазой и не зависит от размера частиц и их распределения по размерам.
Для разбавленных эмульсий, в которых сферические капли жидкости имеют вязкость h’, Тейлор получил уравнение
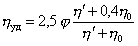
Для дисперсных систем, где возможно парное взаимодействие частиц, приводящее к образованию ориентированных вдоль потока временных агрегатов частиц, Симха предложил уравнение, описывающее вязкость систем со сферическими частицами, в котором взаимодействие между частицами и возможные их столкновения при течении дисперсии учитываются дополнительным членом:
hуд = 2,5j + 12,6j 2 . (2.4.19)
Более точным считается теоретическое уравнение Ванда, полученное для дисперсий, в которых образуются агрегаты из двух частиц. В нем не учитывается рассеивание энергии, возможное при столкновении частиц в потоке,
hуд = 2,5j + 7,34j 2 . (2.4.20)
Это уравнение нашло экспериментальное подтверждение при изучении поведения стеклянных сфер в водно-глицериновой среде с высокой вязкостью. В водной среде был найден коэффициент для второго члена уравнения (2.4.19), равный от 9 до 13, что согласуется как с уравнением Ванда, так и с уравнением Симха.
В общем виде можно записать уравнение зависимости вязкости дисперсии от объемной концентрации дисперсной фазы в виде
h/h0=1 + aj + bj 2 + cj 3 +.
hуд=aj + bj 2 + cj 3 +. (2.4.21)
Это уравнение позволяет учесть все виды взаимодействий, возникающих при течении дисперсных систем. Можно отметить, что при концентрации дисперсной фазы менее 1% при расчете второго члена уравнения (2.4.21) относительная вязкость даже при наибольшем значении постоянной b вносит поправку не более 0,1% от найденной относительной вязкости, что находится в пределах экспериментальной погрешности. Естественно, что при более высокой концентрации дисперсной фазы необходимо учитывать второй член уравнения, а при необходимости высокой точности определения вязкости дисперсий — и третий.
Уравнение (2.4.21) можно использовать и для расчета вязкости несферических частиц в зависимости от концентрации.
Для таких систем уравнение зависимости вязкости от концентрации принимает вид
где а – параметр, зависящий от формы частиц; K1, K2, K3. – безразмерные постоянные.
Постоянная а рассчитывается как отношение длинной оси несферических частиц к короткой.
Постоянные уравнений (2.4.21) и (2.4.22) зависят не только от формы частиц, но и от градиента скорости течения, так как при низких скоростях течения броуновское движение частиц создает большое сопротивление течению, особенно если асимметричные частицы ориентируются поперек потока. В этой связи экспериментально найденная вязкость дисперсных систем с постоянной концентрацией уменьшается при повышении скорости сдвига даже в том случае, если в дисперсии не образуется пространственная структура. Приведенные выше уравнения справедливы для дисперсных систем, в которых на поверхности частиц не образуется двойной электрический слой или в которых не развита его диффузионная часть.
Если же на поверхности частиц образуется двойной ионный слой диффузионной структуры, то в процессе течения диффузионная обкладка может отрываться от частиц, в результате чего частицы приобретают нескомпенсированный заряд и течение может тормозиться в результате электростатического взаимодействия. Этот эффект, называемый электровязкостным, учитывается добавочным членом в уравнении Эйнштейна (2.4.14)
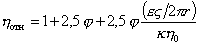
где e – диэлектрическая проницаемость среды; z – электрокинетический потенциал; r – радиус частиц; k – удельная электрическая проводимость среды; h0 – вязкость дисперсионной среды.
Уравнение (2.4.23) в 1916 г. предложил Смолуховский для жестких не набухающих частиц. При развитых диффузионных слоях для частиц с r» 10 -8 м при k» 10 -4 Ом -1 ×cм -1 поправочный член может быть на порядок больше основного.
При введении электролитов и следующим за этим сжатием двойного ионного слоя вязкость падает до некоторого предельного значения, не зависящего от вида добавленного электролита.
Экспериментальная проверка уравнения (2.4.23) показала, что найденные экспериментальные значения вязкости в 100 раз меньше рассчитанного по уравнению Смолуховского. В связи с этим были предложены другие уравнения, учитывающие электровязкостный эффект, в частности, известное уравнение Буфа:
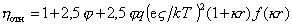
где q – постоянная, зависящая от температуры и природы электролита; е – элементарный заряд; k – параметр Дебая, характеризующий толщину двойного ионного слоя; f(kr) – параметр, зависящий от размера частиц и толщины двойного ионного слоя.
Уравнение Буфа более точно учитывает электровязкостный эффект и теоретически предсказывает порядок величины вязкости. Рассчитанные по этому уравнению и найденные экспериментально значения вязкости имеют один порядок, но различаются по величине в 2-3 раза.
Лекция №13.
План лекции:
ПРОЧНОСТЬ И ВЯЗКОСТЬ ДИСПЕРСНЫХ СИСТЕМ
Вязкие тела текут при любом напряжении сдвига t ( R t ) :
F — сила вязкого сопротивления, В — площадь, на которую распространяется действие этой силы.
Течение вязких тел определяется законом Ньютона:
Р t = h ( d g / d P t ) , F = h В( d g / d P t ) (13.2)
где h — коэффициент вязкости, d g / d P t -изменение деформации сдвига во времени (скорость деформации).
Если обозначить скорость деформации через g . , то вязкость системы:
Вязкость свободнодисперсных систем растет по мере увеличения концентрации дисперсной фазы. Присутствие частиц дисперсной фазы приводит к искажению потока жидкости вблизи этих частиц, что влияет на вязкость. Если концентрация незначительна и столкновения исключаются, то характер движения жидкости около одной частицы не влияет на характер движения жидкости около другой частицы. В этих условиях для определения вязкости свободнодисперсных систем можно воспользоваться уравнением Эйнштейна:
h , h 0 — вязкость свободнодисперсной системы и дисперсионной среды, u об — объемная концентрация дисперсной фазы, к — коэффициент, зависящий от формы частиц (для сферической формы к = 2,5).
Формула Эйнштейна справедлива при отсутствии деформации частиц, если концентрация дисперсной фазы не превышает 6%.
При увеличении объемной концентрации до 30% можно пользоваться формулой:
При сопоставлении формул 13.4 и 13.5 видно, что по мере увеличения концентрации частиц линейная зависимость между вязкостью и
концентрацией нарушается. Тем не менее, вязкость подобных систем при данной концентрации остается постоянной. Подобные системы называются ньютоновскими.
Течение и вязкость неньютоновских жидкостей, которые называют еще аномальными жидкостями, зависят от внешнего воздействия (напряжения сдвига). Вязкость является величиной переменной для данной концентрации и уже не определяется соотношениями 13.2 и 13.3.
Рассмотрим особенности движения структурированных систем (рис.13.1).
Рис.13.1.Зависимость скорости течения (а) и коэффициента вязкости (б) от внешнего усилия Р.
Р r — предел прочности, Рх1 — предел упругости, Рх2 -условный предел прочности, Р m — напряжение полного разрушения структуры, h макс — вязкость неразрушенной структуры, h мин — наименьшая вязкость предельно разрушенной структуры.
Кривые h = f (Р) — полные реологические кривые течения структурированных дисперсных систем. Каждое значение вязкости на этих кривых соответствует равновесному состоянию систем в стационарном ламинарном потоке.
Четыре состояния структурированных систем:
1. 0 P Р x1 (Р x1 — предел упругости). В этом состоянии течение отсутствует, и внешнее воздействие не может нарушить прочность системы.
2. Р > Р x 1 — система начинает течь. Скорость перемещения незначительна, связи между частицами после их разрушения успевают восстановиться. Структура не разрушается. Подобное перемещение называют ползучестью. Вязкость системы в данной зоне наибольшая. Скорость движения в данной зоне:
к — коэффициент, характеризующий структурные особенности дисперсной системы.
Необратимое разрушение системы начинается на границе зон 2 и 3, а на границе участков 3 и 4 оно заканчивается. В этом состоянии дисперсной системы связи между частицами не восстанавливаются, вязкость снижается, скорость движения системы увеличивается. Для этого случая скорость системы:
На участке 4 структура разрушается полностью, минимальная вязкость — полное разрушение системы. На рисунке приведены реологические кривые для твердообразных тел, для жидкообразных систем — пунктирная линия 1а.
Изменение вязкости структурированных жидкостей широко используется на практике.
ВИДЫ ДИСПЕРСНЫХ СИСТЕМ. ЗОЛИ И СУСПЕНЗИИ
Золи и суспензии, а также их производные — гели и пасты — разновидности одного и того же типа дисперсных систем — Т/Ж, различаются они размером частиц дисперсной фазы.
Золи — высокодисперсные системы, их называют еще коллоидными растворами. В зависимости от дисперсионной среды делятся на гидрозоли (вода) и органозоли (органическая среда).
Помимо твердых частиц, дисперсная фаза золей может формироваться из мицелл — электрически нейтральных агрегатов ионов дисперсной среды.
Суспензии — средне- и грубодисперсные системы.
Золи — седиментационно-устойчивые системы, суспензии — седиментационно-неустойчивы.
Особенно резко различаются оптические свойства золей и суспензий. Золи способны рассеиваться по закону Рэлея, а действие света на суспензии происходит по законам геометрической оптики.
Общие свойства золей и суспензий определяются границей раздела фаз Т/Ж, на которой происходят адсорбционные процессы и образуется ДЭС. Больший размер частиц у суспензий приводит к тому, что электроосмос, потенциал седиментации и течения у них выражен слабо, а электрофорез — отсутствует.
ПАСТЫ, ГЕЛИ И ОСАДКИ
При увеличении концентрации частиц дисперсной фазы системы из свободнодисперсных превращаются в связанодисперсные. Связнодисперсные системы, в которые переходят суспензии, называются пастами. Золи переходят в гели. Пасты и гели образуют структуры, для них характерны структурно-механические свойства.
Пасты — концентрированные суспензии или осадок, который образуется при потере суспензией седиментационной устойчивости. Кроме того, пасты могут быть приготовлены искусственно путем растирания твердых тел в жидкой среде.
Осадки золей могут переходить обратно в коллоидный раствор — пептизация (процесс, обратный коагуляции — распад агрегатов до первичных частиц).
Пептизация может протекать под действием электролитов, при этом восстанавливается ДЭС, повышается дзета-потенциал, а силы электростатического отталкивания преобладают над силами межмолекулярного взаимодействия. Пептизация может также происходить под действием растворов ПАВ, молекулы которых адсорбируются на границе раздела фаз и образуют адсорбционные слоя, которые противодействуют сближению частиц.
Пептизация протекает с определенной скоростью и зависит от концентрации электролита-пептизатора (рис.13.2)
SHAPE \* MERGEFORMAT
Рис.13.2.Изменение массы перешедшего в раствор осадка в зависимости от концентрации пептизатора.
В начале процесса при незначительной концентрации пептизатора перехода осадка в раствор не т (участок 1) — происходит адсорбция пептизатора на поверхности частиц. По мере увеличения концентрации пептизатора (участок 2) количество осадка, перешедшего в коллоидный раствор, возрастает. При дальнейшем увеличении концентрации пептизатора весь осадок переходит в коллоидный раствор (участок 3).
http://xumuk.ru/colloidchem/127.html
http://www.trotted.narod.ru/collchem/lec-13.htm

