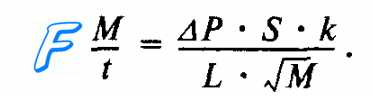Законы Фика | Основы диффузии
Итак, в основе любой теории диффузии (красителей в волокнистых материалах, компонентов в пластических массах, обмена ионов в ионообменных материалах, а также частиц в кристаллических веществах, включающих металлы, полупроводники, оксиды, керамику, стекла и т.д.), лежат законы Фика. Существуют два закона Фика – первый и второй.
Первый закон Фика
Первый закон Фика описывает квазистационарные процессы, когда проницаемая для обменивающихся местами частиц мембрана (пластинка) разделяет две среды (которые могут быть жидкими или газообразными) с существенно постоянными условиями на границах раздела. Эта мембрана может быть инертной по отношению в диффундирующим веществам (например, пористое стекло, разделяющее водные солевые растворы различной концентрации или солевого состава) или активной по отношению к одному или нескольким диффундирующим компонентам (например, палладиевая мембрана, пропускающая через себя водород при высокой температуре из-за специфических процессов сорбции на ее границе и практически не пропускающая другие газы).
Уравнение, описывающее первый закон Фика, имеет следующий вид:
где j – поток вещества через единицу поверхности, D – коэффициент диффузии (в общем случае – коэффициент взаимодиффузии), C — концентрации по толщине мембраны, равная разнице концентраций переносимого вещества по обе стороны мембраны, x — толщина мембраны.
Очевидно, что к обсуждаемым нами процессам образования цинкового покрытия это уравнение неприменимо, поскольку изучаемые нами процессы являются нестационарными.
Второй закон Фика описывает нестационарные процессы, и именно его необходимо применять для описания закономерностей, с которыми имеют дело как металлурги, так и работники других специальностей, соприкасающиеся с проблемами массопереноса в твердых телах.
Рассмотрим его действие на следующем примере. Возьмем два одинаковых образца, имеющих плоскую поверхность и состоящих из металла, который под воздействием нейтронного облучения способен создавать радиоактивные атомы той же природы. Облучим нейтронным потоком один из двух образцов с тем, чтобы создать в нем радиоактивность, соединим плотно по поверхностям облученный и необлученный образцы между собой и для убыстрения процесса будем выдерживать эту композицию при повышенной температуре. Вследствие теплового движения радиоактивные атомы из одной части образца будут диффундировать во вторую его часть, причем этот процесс будет продвинут тем более, чем более высока температура и чем больше время опыта. Затем образцы разъединим, и в каждом образце послойно измерим радиоактивность (технология этого типа эксперимента разработана очень хорошо). В результате эксперимента получаются кривые, изображенные на рис. 7.38, которые соответствующим образом обрабатываются для расчета эффективных коэффициентов диффузии. Концентрация радиоактивных ионов на межфазной границе будет равна половине той, что была в исходном левом образце, а сам процесс диффузии будет описываться уравнением:
Метод обработки таких кривых, как следует из литературы, был предложен физиком по фамилии Матано, и, как правило, называется методом Матано и иногда методом Матано- Больцмана (вероятно, из-за того, что метод возник как результат анализа решений уравнений диффузии, полученных одним из великих физиков теперь уже позапрошлого века Больцманом).
Если поверхность образца контактирует с какой-либо средой в жидкой форме, то на границе раздела концентрация данной среды, как правило, остается постоянной, но на форме фронта в железном образце эта особенность эксперимента при условии постоянства эффективного коэффициента диффузии сказывается достаточно мало (рис.7.39).
Для процесса цинкования необходимо смоделировать именно такую картинку. В этом случае концентрация диффундирующего вещества на границе двух сред является практически постоянной, и диффузия вещества в другую среду будет идти до тех пор, пока не достигнет стационара.
Рис. 7.38. Форма фронта диффузии при контакте двух твердых образцов, в одном из которых (в данном случае слева) методом нейтронного облучения созданы радиоактивные атомы, для двух значений времени эксперимента.
Рис. 7.39. Ожидаемая форма фронта в поглощающей среде при диффузии из среды с постоянной концентрацией на границе.
Второй закон Фика
Уравнение нестационарной диффузии описывается, как было уже сказано, вторым законом Фика, который для диффузии с постоянной концентрацией на границе двух фаз имеет следующий вид:
где n = 2, 1 или 0 – для шара, бесконечного цилиндра и бесконечной пластины.
Для бесконечной пластины уравнение имеет вид:
Ниже приведены соответствующие решения для степени завершения обмена как функции времени при постоянных коэффициентах диффузии:
для шара:
для пластины:
и для бесконечного цилиндра:
μ — корни функции Бесселя нулевого порядка, Bt = π 2 F0
N — степень завершения процесса обмена
F0 = D*t / l 2 — безразмерный параметр, где (D — коэффициент диффузии, t — время, l — линейный параметр)
Эти уравнения показывают, какая доля атомов (от максимально возможной) накапливается в поглощающей части образца.
Анализ показывает, что получаемые кривые, изображенные на рис. 7.39, никоим образом не напоминают типичный фронт сорбции цинка поверхностью железа, картинку которого можно видеть на рис. 7.40. Если верить кривой, полученной на рис. 7.39, наибольшей толщиной должны обладать ζ— и Г1-фазы, а δ-фаза должна иметь промежуточную толщину (о η-фазе мы поговорим несколько позже). Аналогичные результаты (то есть не совпадающие с фронтом, изображенным на рис. 7.39) были получены в значительном количестве исследований, и вот отсюда начинается игра ума.
Одни начинают искать причину в том, что поскольку изучаемое тело имеет кристаллическую структуру, то коэффициенты диффузии в различных направлениях являются различными. Действительно, на монокристаллах в ряде случаев это доказано. Но вот беда: сталь – это поликристаллическое тело, и для процесса цинкования этим вряд ли можно объяснить упомянутые выше экспериментальные закономерности.
Другие ищут причину отклонения от теоретической зависимости в методе Матано в том, что необходимо в уравнении второго закона Фика использовать не градиент концентрации, а градиент химического потенциала. В этом случае уравнение значительно усложняется, и неизвестно, какие результаты – отражающие или не отражающие действительность – будут получены.
Наконец, третьи пошли логически более правильным путем. На самом деле, при диффузии в металле с примесью (сплаве) диффундирует не один вид частиц, а, как минимум, два. Эти два вида частиц диффундируют навстречу друг другу, к тому же обладают различной подвижностью. Если отсчитывать скорость их передвижения от некоторой воображаемой плоскости (рис 7.41), то будет обнаружено, что через некоторое время эксперимента эта плоскость передвинется в сторону той части образца, которая содержит более быстрые частицы (эффект Киркендаля).
Рис. 7.40. Форма фронта, рассчитанная из содержания цинка в каждой из фаз внутри цинкового покрытия.
Рис. 7.41. Сущность эффекта Киркендаля. Пластина из латуни окружена слоем меди, нанесенной электролитически, причем на границе латунного образца предварительно закреплены метки из молибденовой проволоки. В результате выдерживания образца в течение нескольких сотен часов при повышенной температуре метки передвинулась внутрь образца.
Когда анализируют данные по кинетике образования цинк- железного покрытия на образце, исследуются дотошно любые факты, включая тип и структуру образующихся железо-цинковых сплавов, но ни в одной статье до настоящего времени не анализировалась форма фронта цинка в покрытии. Между тем, именно форма фронта говорит о многом, и именно выяснение причин ее образования может стать ключом к количественному описанию скорости образования железо-цинковых слоев.Обратим внимание на следующее. Почти во всех исследованиях в низкотемпературной области (достоверных сведений о форме фронта в высокотемпературной области нами не найдено) образуется форма обрывного фронта, близкая к изображенной на рис. 7.40. Эта форма не сильно зависит от температуры процесса, толщины образующегося покрытия и наличия или отсутствия в образце кремния (фосфора). Между тем имеется очень мало процессов, которые характеризуются такой формой фронта. Одним из таких процессов является процесс горения с быстрым отводом образующихся продуктов горения от поверхности. Для горящего шара, например, процесс горения описывается уравнением:
где R — радиус шара до начала горения, r — радиус координаты горения, D — коэффициент диффузии.
Очевидно, что если мы сделаем плоский образец с защитой боковых поверхностей, то процесс горения будет происходить только на одной из поверхностей без изменения ее реальной площади, то есть скорость уменьшения толщины образца будет пропорциональна времени. Пример такого процесса – «курение сигареты» автоматическим курильщиком с постоянной скоростью просасывания воздуха через образец.
Между тем, в огромном большинстве исследований наблюдается обратноквадратичная зависимость скорости образования слоя (скорости вымывания железа в расплав) от времени, то есть выполняется зависимость:
Однако необходимо тщательно проверить последнее утверждение, прежде чем принимать его за аксиому.
На рис. 7.42 и 7.43 приведены данные по зависимости скорости накопленияжелеза в расплаве от времени при различных температурах. В книге утверждается, что при построении этих данных в координатах получаются прямые линии для всех температур, кроме данных при 510°С, где наблюдается прямолинейная зависимость. Проверим это утверждение.
Рис. 7.42. Зависимость скорости накопления железа в расплаве с течением времени от температуры в высокотемпературной области.
Рис. 7.43. Зависимость скорости накопления железа в расплаве от времени в низкотемпературной области.
Таблица № 7.5. Определение формального порядка реакции методом сравнения с базисной зависимостью для данных по скорости вымывания железа из образца в течение процесса цинкования.
Уравнение фика для диффузии формула
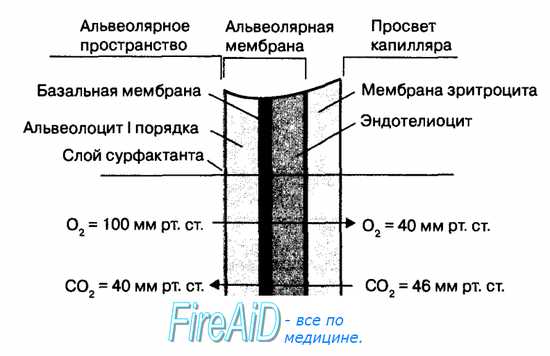
Диффузия газов через альвеолярную мембрану происходит между альвеолярным воздухом и венозной, а также артериальной кровью легочных капилляров. В табл. 10.2 приведены стандартные величины напряжения дыхательных газов в артериальной и венозной крови легочных капилляров.
Таблица 10.2. Напряжение дыхательных газов в артериальной и венозной крови легочных капилляров
Градиенты парциального давления кислорода и углекислого газа обусловливают процесс пассивной диффузии через альвеолярную мембрану кислорода из альвеол в венозную кровь (градиент 60 мм рт. ст.), а углекислого газа — из венозной крови в альвеолы (градиент 6 мм рт. ст.). Парциальное давление азота по обе стороны альвеолярной мембраны остается постоянным, поскольку этот газ не потребляется и не продуцируется тканями организма. При этом сумма парциального давления всех газов, растворенных в тканях организма, меньше, чем величина атмосферного давления, благодаря чему газы в тканях не находятся в газообразной форме. Если величина атмосферного давления будет меньше, чем парциальное давление газов в тканях и в крови, то газы начинают выделяться из крови в виде пузырьков, вызывая тяжелые нарушения в кровоснабжении тканей организма (кессонная болезнь).
Скорость диффузии 02 и С02 в легких
Скорость диффузии (M/t) кислорода и углекислого газа через альвеолярную мембрану количественно характеризуется законом диффузии Фика. Согласно этому закону газообмен (M/t) в легких прямо пропорционален градиенту (ДР) концентрации 02 и С02 по обе стороны от альвеолярной мембраны, площади ее поверхности (S), коэффициентам (к) растворимости 02 и С02 в биологических средах альвеолярной мембраны и обратно пропорционален толщине альвеолярной мембраны (L), а также молекулярной массе газов (М). Формула этой зависимости имеет следующий вид:
Структура легких образует максимальное по величине поле для диффузии газов через альвеолярную стенку, которая имеет минимальную толщину (рис. 10.16). Так, количество альвеол в одном легком человека приблизительно равно 300 млн. Суммарная площадь альвеолярной мембраны, через которую происходит обмен газов между альвеолярным воздухом и венозной кровью, имеет огромные размеры (порядка 100 м2), а толщина альвеолярной мембраны составляет лишь — 0,3—2,0 мкм.
В обычных условиях диффузия газов через альвеолярную мембрану происходит в течение очень короткого отрезка времени (не более 3/4 с), пока кровь проходит через капилляры легких. Даже при физической работе, когда эритроциты проходят капилляры легкого в среднем за 1/4 с, указанные выше структурные особенности альвеолярной мембраны создают оптимальные условия для формирования равновесия парциальных давлений 02 и С02 между альвеолярным воздухом и кровью капилляров легких (рис. 10.17). В уравнении Фика константы диффузии (к) пропорциональны растворимости газа в альвеолярной мембране. Углекислый газ имеет примерно в 20 раз большую растворимость в альвеолярной мембране, чем кислород. Поэтому, несмотря на существенное различие в градиентах парциальных давлений 02 и С02 по обе стороны от альвеолярной мембраны, диффузия этих газов совершается за очень короткий отрезок времени движения эритроцитов крови через легочные капилляры.
Газообмен через альвеолярную мембрану количественно оценивается диффузионной способностью легких, которая измеряется количеством газа (мл), проходящего через эту мембрану за 1 мин при разнице давления газа по обе стороны мембраны в 1 мм рт. ст.
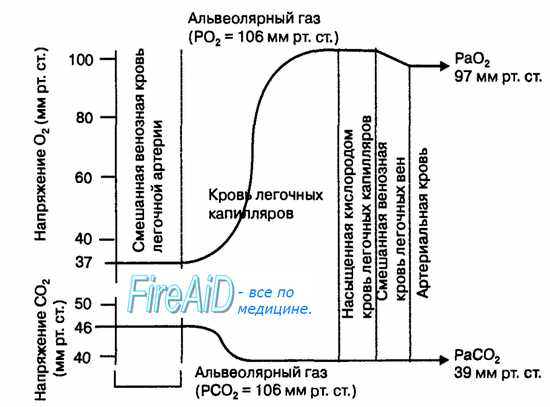
Наибольшее сопротивление диффузии 02 в легких создают альвеолярная мембрана и мембрана эритроцитов, в меньшей степени — плазма крови в капиллярах. У взрослого человека в покое диффузионная способность легких 02 равна 20—25 мл • мин-1 • мм рт. ст.-1. С02, как полярная молекула (0=С=0), диффундирует через указанные мембраны чрезвычайно быстро, благодаря высокой растворимости этого газа в альвеолярной мембране Диффузионная способность легких С02 равна 400—450 мл•мин-1• мм рт. ст.-1.
Скорость диффузии
Вы будете перенаправлены на Автор24
Скорость диффузии
Диффузия относится к наиболее простым явлениям, которые изучаются в рамках курса физики. Этот процесс можно представить на бытовом ежедневном уровне.
Диффузия представляет собой физический процесс взаимного проникновения атомов и молекул одного вещества между такими же структурными элементами другого вещества. Итогом этого процесса становится выравнивание уровня концентрации в проникающих соединениях. Диффузию или смешивание можно видеть каждое утро на собственной кухне, когда происходит приготовление чая, кофе или иных напитков, в состав которых входит несколько основных компонентов.
Подобный процесс первый раз смог научно описать Адольф Фик в середине 19 века. Он дал ему оригинальное название, которое переводится с латинского языка как взаимодействие или распространение.
Скорость диффузии зависит от нескольких факторов:
- температуры тела;
- агрегатного состояния исследуемого вещества.
В различных газах, где существуют очень большие расстояние между молекулами, скорость диффузии будет самой большой. В жидкостях, где расстояние между молекулами заметно меньше, скорость также уменьшает свои показатели. Самая маленькая скорость диффузии отмечается в твердых телах, поскольку в молекулярных связях наблюдается строгий порядок. Атомы и молекулы сами совершают незначительные колебательные движения на одном месте. Скорость протекания диффузии увеличивается при росте окружающей температуры.
Закон Фика
Скорость диффузии принято измерять количеством вещества, которое переносится за единицу времени. Все взаимодействия должны осуществляться через площадь поперечного сечения раствора.
Основной формулой скорости диффузии является:
- $D$ — это коэффициент пропорциональности,
- $S$ — площадь поверхности, а знак «-» обозначает, что диффузия идет из области большей концентрации в меньшую.
Готовые работы на аналогичную тему
Такую формулу представил в виде математического описания Фик.
Согласно ей, скорость диффузии прямо пропорциональна градиенту концентрации и площади, через которую осуществляется процесс диффузии. Коэффициент пропорциональности определяет диффузию вещества.
Известный физик Альберт Эйнштейн вывел уравнения для коэффициента диффузии:
$D=RT/NA \cdot 1/6\pi\etaŋr$, где:
- $R$- это универсальная газовая постоянная,
- $T$- абсолютная температура,
- $r$- радиус диффундирующих частиц,
- $D$- коэффициент диффузии,
- $ŋ$- вязкость среды.
Из этих уравнений следует, что скорость диффузии будет возрастать:
- при повышении температуры;
- при повышении градиента концентрации.
Скорость диффузии уменьшается:
- при увеличении вязкости растворителя;
- при увеличении размера диффундирующих частиц.
Если молярная масса увеличивается, тогда коэффициент диффузии уменьшается. В этом случае скорость диффузии также уменьшается.
Ускорение диффузии
Существуют различные условия, которые способствуют ускорению протекания диффузии. Быстрота диффузии зависит от агрегатного состояния исследуемого вещества. Большая плотность материала замедляет химическую реакцию. На скорость взаимодействия молекул влияет температурный режим. Количественной характеристикой скорости диффузии является коэффициент. В системе измерений СИ его обозначают в виде латинской большой буквы D. Он измеряется в квадратных сантиметрах или метрах на секунду времени.
Коэффициент диффузии равняется количеству вещества, которое распределяется среди другого вещества через определенную единицу поверхности. Взаимодействие должно осуществляться на протяжении единицы времени. Для эффектного решения задачи необходимо добиться условия, когда разность плотностей на обеих поверхностях будет равна единице.
Также на скорость диффузии в твердых телах, жидкости в газах влияет давление и излучение. Излучение может быть разных видов, в том числе индукционное, а также высокочастотное. Диффузия начинается при воздействии определенного вещества-катализатора. Они часто выступают в роли пускового механизма для возникновения стабильного процесса рассеивания частиц.
При помощи уравнения Аррениуса описывают зависимость коэффициента от температуры. Оно выглядит следующим образом:
$D = D0exp(-E/TR)$, где:
- $Т$ – абсолютная температура, которая измеряется в Кельвинах,
- $E$ – минимально необходимая для диффузии энергия.
Формула позволяет больше понять о характерных чертах всего процесса диффузии и определяет скорость реакции.
Специальные методы диффузии
Сегодня практически нельзя применить обычные методы для определения молекулярного веса белков. Они обычно основаны на измерении:
- упругости пара;
- повышения температуры кипения;
- понижения температуры замерзания растворов.
Для эффективного решения задачи применяются специальные методы, которые разработаны для исследования веществ с высокой молекулярной структурой. Они предполагают определение скорости диффузии или вязкости растворов.
Метод определения ориентации и формы пор по скорости диффузии основан на исследовании скоростей диализа. В мембране должна происходить в этот момент свободная диффузия.
Также для определения скорости диффузии натрия могут применяться различные радиоизотопы. Такой специальный метод применяется для решения поставленных задач в сфере минералогии и геологии.
Активно применяется метод диффузии, который основан на определении диффузии макромолекул в растворе. Он был разработан для полимерных материалов. Согласно методу, идет определение коэффициента диффузии, а затем по этим данным узнают среднемассовую молекулярную массу.
В настоящее время отсутствуют прямые методы определения скорости диффузии водорода в катализаторе. Для этого используется так называемый второй путь активации.
Для определения скорости принято использовать специальные приборы. Они отличаются по виду от поставленных практических и научных задач.
http://meduniver.com/Medical/Physiology/430.html
http://spravochnick.ru/fizika/skorost_diffuzii/