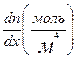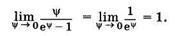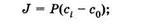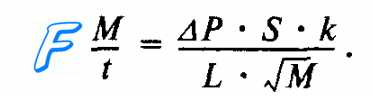Перенос молекул (атомов) через мембраны.Уравнение Фика
Важным элементом функционирования мембран является их способность пропускать или не пропускать молекулы (атомы) и ионы. Существенно, что вероятность такого проникновения частиц зависит как от направления их перемещения, например в клетку или из клетки, так и от разновидности молекул и ионов.
Эти вопросы рассматриваются в разделе физики, относящемся — к явлениям переноса. Таким термином называют необратимые F, процессы, в результате которых в физической системе происходит пространственное перемещение (перенос) массы, импульса, энергии, заряда или какой-либо другой физической величины.
К явлениям переноса относят диффузию (перенос массы вещества), вязкость (перенос импульса), теплопроводность (перенос энергии), электропроводность (перенос электрического заряда). Здесь и в следующих параграфах рассматриваются наиболее существенные для биологических мембран явления: перенос вещества и перенос заряда. Как синоним переноса частиц в биофизике широкое распространение получил также термин транспорт частиц.
Выведем основное уравнение диффузии (уравнение Фика), рассматривая процесс переноса в жидкостях.
Пусть через некоторую площадку S (рис. 11.10) во всех направлениях перемещаются молекулы жидкости. Учитывая теорию : молекулярного строения жидкости (см. § 7.6), можно сказать, что молекулы пересекают площадку, перескакивая из одного положения равновесия в другое.

 |
Время Δt «пролета» этими молекулами площадки S может быть найдено следующим образом. Предположим, что все молекулы из выделенных объемов движутся с одинаковыми средними скоростями . Тогда молекулы в объеме 1 или 2, дошедшие до площадки S, пересекают ее в течение промежутка времени
Подставляя в (11.1)выражение для средней скорости ύ из (7.20), получаем
 |
где т — среднее время «оседлой жизни» молекулы, оно может рассматриваться как среднее время перескока. «Баланс» переноса молекул через площадку S за промежуток времени Δt равен
 |
Умножая (11.3)на массу тотдельной молекулы и деля на Δt, находим массовый поток сквозь площадку S:
 |
т. е. масса вещества, которая за 1 с переносится через площадку S. Изменение концентрации п2 — п1 молекул можно представить как произведение dn/dxна расстояние 2δ между выделенными объемами:
 |
В уравнении (11.4) заменим Δt согласно (11.2)и (п2 — п1) согласно (11.5):
Отношение потока к площади S, через которую он переноситься, называется плотностью потока:
 |
 |
Произведение массы молекулы на их концентрацию есть плотность вещества (парциальная плотность):
Это есть уравнение диффузии (уравнение Фика), которое обычно записывают в виде:
 |
Знак «-» показывает, что суммарная плотность потока вещества при диффузии направлена в сторону уменьшения плотности (в сторону, противоположную градиенту плотности), D — коэффициент диффузии, применительно к рассмотренному примеру диффузии в жидкости он равен
Как видно из (11.10),единица измерения коэффициента диффузии [м 2 /с].
Уравнение диффузии можно записать не только для плотности
массового потока кг/(м 2 *с), но и для плотности потока частиц 1/(м 2 *с) и плотности потока вещества моль/(м 2 *с), при этом в уравнении (11.9) вместо градиента плотности следует использовать соответственно градиент концентрации 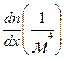
 |
А. Эйнштейн показал, что коэффициент диффузии пропорционален температуре:
 |
И поэтому вместо (11.11) имеем
 |
В формуле (11.12) и далее ит — подвижность диффундирующих молекул (частиц), выраженная для моля. Вообще говоря, подвижностью диффундирующей частицы (молекулы, атома, иона, электрона) и называют коэффициент пропорциональности между скоростью v частицы и силой f, двигающей частицу, в том случае, когда на частицу не действуют другие силы (например, трение или соударение с другими частицами) и она перемещается равномерно:
 |
Как видно из (11.14), единица подвижности 1 м/(с • Н). Величины um и u связаны через постоянную Авогадро:
 |
Преобразуем уравнение (11.9) применительно к биологической мембране. Будем считать, что концентрация частиц, диффундирующих через мембрану, изменяется в мембране по линейному закону (рис. 11.11). Молярные концентрации частиц внутри и вне клетки соответственно равны ci и с0. Молярная концентрация этих же частиц в мембране изменяется от внутренней к наружной ее части соответственно от сmi до см0. Учитывая линейное изменение концентрации молекул, запишем
 |
где I — толщина мембраны, тогда вместо (11.11) имеем
 |
Практически доступнее определить молярные концентрации частиц не внутри мембраны (cMi и см0), а вне мембраны: в клетке (сi) и снаружи клетки (с0). Считают, что отношение граничных значенийконцентраций в мембране равно отношению концентраций в прилегающих к мембране слоях: см0/сMi = co/ci, откуда
 |
где k — коэффициент распределения вещества (частиц) между мембраной и окружающей средой (обычно водная фаза). Из (11.18) следует
Подставляя (11.19) в (11.17), имеем
 |  |
Пусть
 |
где Р — коэффициент проницаемости. В результате получаем уравнение для плотности потока вещества при диффузии через биологическую мембрану:
 |
Уравнение Нернста—Планка. Перенос ионов через мембраны
Как известно, на мембране существует разность потенциалов, следовательно, в мембране имеется электрическое поле. Оно оказывает влияние на диффузию заряженных частиц (ионов и электронов). Между напряженностью поля Е и градиентом потенциала dφ/dx существует известное соотношение (см. § 12.1):
 |
Заряд иона равен Ze. На один ион действует сила f=Ze(dφ/dx); сила, действующая на 1 моль ионов, равна
где F — постоянная Фарадея, F = eNA.
 |

Чтобы найти поток вещества (ионов), выделим объем электролита (рис. 11.12) в виде прямоугольного параллелепипеда с ребром, численно равным скорости ионов. Все ионы, находящиеся в параллелепипеде, за 1 с пройдут через площадку S. Это и будет поток Ф. Число молей этих ионов
 |
можно найти, умножая объем параллелепипеда (vS) на молярную концентрацию ионов с:
 |
Плотность потока вещества найдем, используя формулы (11.24) и (11.25):
 |
В общем случае перенос ионов определяется двумя факторами: неравномерностью их распределения, т. е. градиентом концентрации [см. (11.11)], и воздействием электрического поля [см. (11.26)]:
Это уравнение Нернста—Планка. Используя выражение для подвижности (11.12), преобразуем уравнение (11.27) к виду
 |
Это другая форма записи уравнения Нернста—Планка
Используем уравнение Нернста—Планка для установления зависимости плотности диффузионного потока от концентрации ионов и от напряженности электрического поля. Предположим, система находится в стационарном состоянии, т. е. плотность потока Jпостоянна. Электрическое поле в мембране примем за однородное, следовательно, напряженность поля одинакова, а потенциал линейно изменяется с расстоянием. Это позволит считать, что 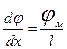
Упростим запись слагаемого в уравнении (11.28):
 |  |
где
— — —
 |
вспомогательная величина (безразмерный потенциал). С учетом (11.29) получим уравнение Нернста—Планка в виде
 |
Разделим переменные и проинтегрируем уравнение:
 |
Потенцируя (11.31), получаем
 |
откуда
 |
Преобразуем формулу (11.32), учитывая выражения (11.19) и (11.20):
 |
Вообще говоря, формула (11.33) справедлива как для положительных (Z > 0, у > 0), так и для отрицательных При использовании этой формулы необходимо помнить, что отрицательные значения Z и ψ уже учтены в самой формуле, т. е. ψ— положительная величина. Уравнения (11.33) и (11.34) устанавливают связь плотности стационарного потока ионов с тремя величинами: 1) проницаемостью мембран для данного иона, которая характеризует взаимодействие мембранных структур с ионом; 2) электрическим полем; 3) молярной концентрацией ионов в водном растворе, окружающем мембрану <сi и с0). Проанализируем частные случаи уравнения (11.33): а) ψ = 0, что означает либо Z = 0 (нейтральные частицы), либо отсутствие электрического поля в мембране (φм = 0), либо и то, и другое: Найдем пределы отдельных сомножителей. 1. 2.Отсюда получаем, как и следовало ожидать, уравнение (11.21): б) одинаковая молярная концентрация ионов по разные стороны от мембраны (ci = с0 = с) при наличии электрического поля: Это соответствует электропроводимости в электролите (см. § 12.9). Для нейтральных частиц (Z = 0 и ψ=0) J = 0; в) если мембрана непроницаема для частиц (Р = 0), то, естественно, плотность потока равна нулю. Дата добавления: 2015-06-22 ; просмотров: 1120 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ Диффузия газов через альвеолярную мембрану происходит между альвеолярным воздухом и венозной, а также артериальной кровью легочных капилляров. В табл. 10.2 приведены стандартные величины напряжения дыхательных газов в артериальной и венозной крови легочных капилляров. Таблица 10.2. Напряжение дыхательных газов в артериальной и венозной крови легочных капилляров Градиенты парциального давления кислорода и углекислого газа обусловливают процесс пассивной диффузии через альвеолярную мембрану кислорода из альвеол в венозную кровь (градиент 60 мм рт. ст.), а углекислого газа — из венозной крови в альвеолы (градиент 6 мм рт. ст.). Парциальное давление азота по обе стороны альвеолярной мембраны остается постоянным, поскольку этот газ не потребляется и не продуцируется тканями организма. При этом сумма парциального давления всех газов, растворенных в тканях организма, меньше, чем величина атмосферного давления, благодаря чему газы в тканях не находятся в газообразной форме. Если величина атмосферного давления будет меньше, чем парциальное давление газов в тканях и в крови, то газы начинают выделяться из крови в виде пузырьков, вызывая тяжелые нарушения в кровоснабжении тканей организма (кессонная болезнь). Скорость диффузии (M/t) кислорода и углекислого газа через альвеолярную мембрану количественно характеризуется законом диффузии Фика. Согласно этому закону газообмен (M/t) в легких прямо пропорционален градиенту (ДР) концентрации 02 и С02 по обе стороны от альвеолярной мембраны, площади ее поверхности (S), коэффициентам (к) растворимости 02 и С02 в биологических средах альвеолярной мембраны и обратно пропорционален толщине альвеолярной мембраны (L), а также молекулярной массе газов (М). Формула этой зависимости имеет следующий вид: Структура легких образует максимальное по величине поле для диффузии газов через альвеолярную стенку, которая имеет минимальную толщину (рис. 10.16). Так, количество альвеол в одном легком человека приблизительно равно 300 млн. Суммарная площадь альвеолярной мембраны, через которую происходит обмен газов между альвеолярным воздухом и венозной кровью, имеет огромные размеры (порядка 100 м2), а толщина альвеолярной мембраны составляет лишь — 0,3—2,0 мкм. В обычных условиях диффузия газов через альвеолярную мембрану происходит в течение очень короткого отрезка времени (не более 3/4 с), пока кровь проходит через капилляры легких. Даже при физической работе, когда эритроциты проходят капилляры легкого в среднем за 1/4 с, указанные выше структурные особенности альвеолярной мембраны создают оптимальные условия для формирования равновесия парциальных давлений 02 и С02 между альвеолярным воздухом и кровью капилляров легких (рис. 10.17). В уравнении Фика константы диффузии (к) пропорциональны растворимости газа в альвеолярной мембране. Углекислый газ имеет примерно в 20 раз большую растворимость в альвеолярной мембране, чем кислород. Поэтому, несмотря на существенное различие в градиентах парциальных давлений 02 и С02 по обе стороны от альвеолярной мембраны, диффузия этих газов совершается за очень короткий отрезок времени движения эритроцитов крови через легочные капилляры. Газообмен через альвеолярную мембрану количественно оценивается диффузионной способностью легких, которая измеряется количеством газа (мл), проходящего через эту мембрану за 1 мин при разнице давления газа по обе стороны мембраны в 1 мм рт. ст. Наибольшее сопротивление диффузии 02 в легких создают альвеолярная мембрана и мембрана эритроцитов, в меньшей степени — плазма крови в капиллярах. У взрослого человека в покое диффузионная способность легких 02 равна 20—25 мл • мин-1 • мм рт. ст.-1. С02, как полярная молекула (0=С=0), диффундирует через указанные мембраны чрезвычайно быстро, благодаря высокой растворимости этого газа в альвеолярной мембране Диффузионная способность легких С02 равна 400—450 мл•мин-1• мм рт. ст.-1. Одна из основных функций биологической мембраны – селективный транспорт веществ. Принято различать · пассивный транспорт – происходящий в направлении действия электрохимического градиента (концентрационного, электрического и т.д.); · активный транспорт – процессы переноса веществ против существующих градиентов и требующие затрат энергии. Пассивный транспорт объединяет ряд механизмов переноса веществ. Диффузия – самопроизвольное перемещение вещества из области большей концентрации в область меньшей концентрации вследствие хаотического теплового движения молекул. Уравнение диффузии (уравнение Фика) имеет вид: где J – плотность потока – количество вещества переносимое через единицу площади за единицу времени [моль/м 2 ×с]; где R – универсальная газовая постоянная (8,31 Дж×моль –1 ×К –1 ); Т – абсолютная температура (К); NA – постоянная Авогадро (6,02×10 23 моль –1 ); r – радиус диффундирующих частиц (м); h — вязкость среды (Н×с/м 2 ). Таким образом, скорость диффузии будет зависеть от температуры, вязкости растворителя и размера частиц. Для расчета диффузии через биологическую мембрану часто используют формулу: где Р – коэффициент проницаемости; сi и с0 – молярная концентрация частиц в клетке и снаружи. Коэффициент проницаемости прямо пропорционален коэффициенту диффузии (D), коэффициенту распределения вещества между водным раствором и липидной фазой мембраны (k) и обратно пропорционален толщине мембраны (l): Коэффициент распределения тем выше, чем легче вещество растворяется в липидной фазе. Следовательно, переход гидрофильных соединений непосредственно через липидный бислой будет крайне затруднен (так, молекулы пропиленгликоля диффундируют через мембрану примерно в 20 раз быстрее, чем молекулы мочевины). Если происходит перенос заряженных частиц (ионов), то помимо концентрационного градиента необходимо учитывать величину разности потенциалов биологической мембраны. Уравнение диффузии для таких частиц называется уравнением Нернста-Планка и имеет вид: где um – подвижность диффундирующих частиц выраженная для моля (u = um×NA); Z – заряд иона; F – постоянная Фарадея; с – молярная концентрация ионов; Кроме диффузии через липидный бислой мембраны транспорт веществ может происходить через липидные поры и белковые каналы (рис. 4). Мембранный канал представляет собой интегральный белок (белковый комплекс, гликопротеид), пронизывающий липидныйкаркас мембраны и обеспечивающий перенос веществ через мембрану в сторону более низкого электрохимического потенциала. Вторичная структура белкового комплекса имеет b-складчатый характер с цилиндрической полостью внутри, заполненной водой. Коэффициент проницаемости ионных каналов для гидрофильных веществ составляет 10 –8 -10 –9 м/с, что на 5-6 порядков меньше скорости переноса ионов в водной среде, но значительно превышает скорость их диффузии через липидную фазу. Ионный канал содержит два основных компонента: селективный фильтр и воротный механизм. Первый имеет жесткую структуру, т.е. в этой части белковый комплекс не может изменять размеры поры и регулировать проницаемость мембраны. Функция селективного фильтра – пропускать через канал определенное вещество или группу сходных с ним веществ, т.е. избирательная проницаемость. Регулирование мембранной проницаемости обеспечивается воротными процессами. Они осуществляются «воротами канала», которые представляют собой части белкового комплекса, способные «раскручиваться» и «скручиваться» в ходе их механохимических реакций и благодаря этому создавать просвет внутри белкового комплекса или перекрывать его (сжимать или восстанавливать пору). Проницаемость мембраны для данного вещества определяется только числом открытых в данный момент каналов. Поэтому мембранную проницаемость (Р) при переносе веществ по каналам рассчитывают по формуле: где n – число открытых каналов на единице поверхности; r – радиус канала; D – коэффициент диффузии; l – длина канала (примерно соответствует толщине мембраны). Переход канала из закрытого состояния в открытое и обратно осуществляется под действием определенных стимулов (сдвиг мембранного потенциала, химические, механические, световые модальности). Облегченная диффузия происходит с участием специальных переносчиков. Например, антибиотик валиномицин осуществляет перенос ионов калия через мембрану. Его структура напоминает браслет (рис. 5) образованный изнутри полярными группами (обеспечивают связывание калия), а снаружи – неполярными (обуславливают гидрофобность молекулы). Ион калия встраивается в центральную область антибиотика на наружной поверхности мембраны, заряженный комплекс под действием электрического поля диффундирует через мембрану и на ее внутренней стороне распадается. Калий поступает в цитоплазму, а свободная молекула валиномицина возвращается обратно. По современным представлениям, аналогично происходит перенос аминокислот, сахаров и ряда других веществ. Примером фиксированного переносчика является антибиотик грамицидин. Две его молекулы встраиваются в мембрану и формируют полый цилиндр, в котором полярные группы расположены внутри. Скорость переноса ионов может составлять 10 10 с –1 , что примерно в 10 5 раз превышает производительность подвижных переносчиков. Характерные черты облегченной диффузии: · для ее реализации обязательно должен существовать концентрационный градиент переносимого вещества; · при увеличении градиента концентрации скорость облегченной диффузии повышается до определенного предела («насыщение» определяется концентрацией переносчика); · скорость облегченной диффузии значительно превышает скорость простой, поскольку переносчик приводит к значительному повышению мембранной проницаемости для данного вещества; · возможна конкуренция близких по структуре веществ за связывание с молекулой переносчика. Осмос – движение растворителя через полупроницаемую мембрану (непроницаемую для растворенного вещества) в сторону более концентрированного раствора. По своей сути осмос – это простая диффузия молекул воды. Осмотическое давление 
Уравнение фика для мембран формула
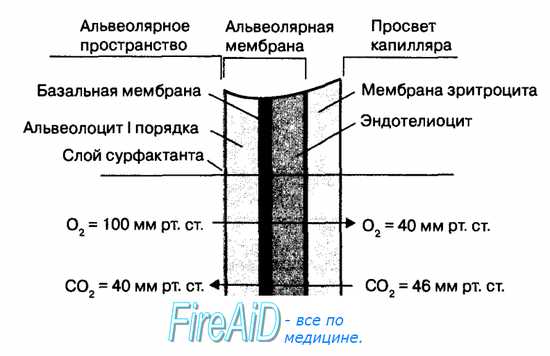
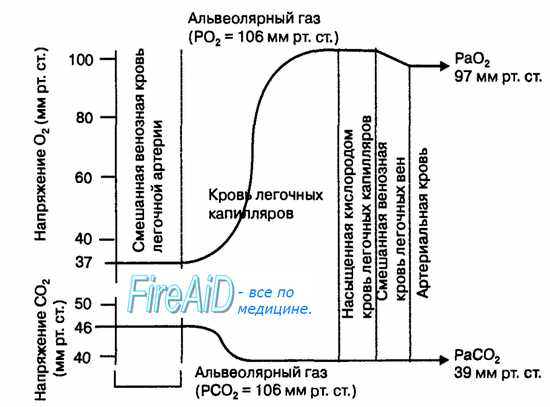
Скорость диффузии 02 и С02 в легких
Транспорт веществ через мембрану.
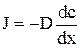





а) диффузия через липидный бислой; б) диффузия через липидную пору; в) диффузия через белковый канал. Рис. 4. Диффузионный транспорт через мембрану. 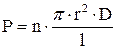
а) транспорт ионов К + через мембрану с помощью валиномицина (V – свободная молекула валиномицина; KV + – комплекс валиномицина с калием); б) структура комплекса К + ‑валиномицин а) б) Рис. 5. Механизм действия валиномицина.
где R – универсальная газовая постоянная, 8,31×10 3 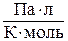
Явление осмоса играет ключевую роль в жизнедеятельности организма, обеспечивая поступление воды через мембраны и тургор или упругость клеток (формообразование, эластические свойства тканей).
По сравнению с осмотическим давлением клеток, внешние растворы могут быть:
· Изотоническими – имеют ту же величину осмотического давления, не вызывают изменения клеточных структур (0,9% водный раствор NaCl называют физиологическим раствором). Для инъекций лекарственных препаратов используются преимущественно изотонические растворы.
· Гипертоническими – растворы с большим осмотическим давлением, приводят к плазмолизу клеток («сморщиванию») вследствие выхода из них воды.
· Гипотоническими – растворы с меньшим осмотическим давлением приводят к разбуханию и разрыву клеточной оболочки – лизису, поскольку вода начинает поступать внутрь клетки. Повязки с гипертоническим раствором (10% NaCl) применяют в медицине при лечении гнойных ран (за счет осмоса происходит ток жидкости из раны и она очищается от микроорганизмов, продуктов распада). Горькую соль (MgSO4×7H2O) и глауберову соль (Na2SO4×10H2O) используют как слабительные средства. Они плохо всасываются в желудочно-кишечном тракте, и при применении гипертонических растворов этих солей в просвет кишечника переходит значительное количество воды из слизистой оболочки.
Фильтрация – движение раствора через поры в мембране под действием градиента давления. В общем виде, скорость переноса при фильтрации подчиняется закону Пуазейля:
Фильтрация играет огромную роль в капиллярном транспорте, поскольку обеспечивает перенос воды и растворенных в ней веществ из плазмы крови в тканевую жидкость. Направление и скорость движения воды определяется по формуле:
где Q – объемная скорость движения воды через капиллярную стенку; f – коэффициент фильтрации (определяется вязкостью раствора, количеством пор и т.д.); Ргк – гидростатическое давление в капилляре; Ргт – гидростатическое давление в тканевой жидкости; Рок – онкотическое давление крови; Рот – онкотическое давление тканевой жидкости. Онкотическое давление – часть осмотического, создаваемое за счет белковых макромолекул (более мелкие молекулы свободно проходят через капиллярную стенку и не участвуют в формировании осмотического давления). Под действием Ргк и Рот жидкость стремится выйти из капилляра в ткань (фильтрация), а под действием Ргт и Рок – возвратиться обратно в капилляр (реабсорбция). Градиент гидростатического давления в капиллярном русле приводит к тому, что в артериальной части артериол происходит фильтрация, а в венозной части – реабсорбция, причем между объемами отфильтрованной и реабсорбированной жидкости в норме существует динамическое равновесие (≈ 10% объема жидкости возвращается из интерстициального пространства в кровяное русло с помощью лимфатической системы).
Активный транспорт идет против существующих электрохимических градиентов и сопровождается ростом энергии Гиббса. Следовательно, он всегда происходит с затратой энергии запасенной в макроэргических связях АТФ. Впервые существование активного транспорта было показано в опытах Уссинга (1949 г).
Камера Уссинга (рис. 6) заполнена раствором Рингера и разделена на две половины кожей лягушки. Наблюдались потоки ионов Na + , при этом внутренняя сторона кожи приобретала положительный заряд по отношению к наружной. С помощью блока компенсации напряжения разность потенциала кожи приводили нулю и поддерживали одинаковую концентрацию ионов по обе стороны мембраны. Если бы транспорт ионов осуществлялся только пассивными механизмами, то потоки ионов через мембрану в обе стороны были бы равны, а ток в цепи отсутствовал. Однако электрический ток продолжал протекать через мембрану, следовательно, происходит однонаправленный перенос заряженных частиц. Метод радиоактивных изотопов показал, что поток ионов Na + внутрь клетки превышает поток из клетки. Дальнейшие опыты показали, что истощение запасов АТФ в коже лягушки приводит к остановке однонаправленного потока ионов Na + .
 | А – амперметр, V – вольтметр, Б — батарейка, П – потенциометр. |
| Рис. 6. Схема опыта Уссинга. |
В биологические мембраны встроены сложные белковые комплексы фермента АТФ-азы (ионные насосы), работающие за счет свободной энергии гидролиза АТФ. У человека примерно 30-40% всей энергии, образующейся при метаболических процессах, расходуется на активный транспорт. Активный транспорт обеспечивает формирование в живой системе градиентов концентраций, электрических потенциалов, давления и т.д., то есть поддерживает организм в неравновесном состоянии, что лежит в основе существования жизни. В настоящее время известны три типа электрогенных ионных насосов:
 |  |  |
| Натрий-калиевый насос | Кальциевый насос | Протонный насос |
Транспорт ряда веществ через мембрану не связан непосредственно с процессами гидролиза АТФ, но обусловлен наличием на мембране электрохимических градиентов. Такие механизмы получили название вторичного активного транспорта. Так, перенос сахаров, аминокислот из полости кишечника происходит за счет электрохимического градиента ионов Na + , который, в свою очередь создается работой Na + -K + -АТФ-азы.
http://meduniver.com/Medical/Physiology/430.html
http://poisk-ru.ru/s9629t3.html