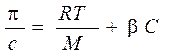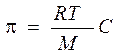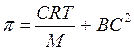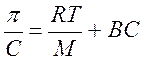Осмос в растворах биополимеров.
Осмотическое давление растворов биополимеров.
Уравнение Галлера
Для растворов полимеров, как и для растворов низкомолекулярных веществ, характерны коллигативные свойства: осмос, диффузия. Отличительной особенностью растворов полимеров является то, что экспериментально определенное осмотическое давление для раствора ВМС заданной концентрации значительно превышает вычисленное по закону Вант-Гоффа. Это связано с тем, что макромолекула благодаря большим размерам и гибкости цепи ведет себя в растворе как несколько более коротких молекул. Поэтому роль кинетического элемента играет не вся макромолекула, а отдельные ее сегменты, обладающие относительной подвижностью. Число подвижных сегментов взрастает с увеличением гибкости цепи макромолекулы и с ростом концентрации ВМС в растворе. Для расчета осмотического давления растворов ВМС используют уравнение Галлера:
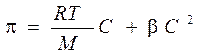
где С – массовая концентрация ВМС в растворе, г/л; М – средная молярная масса ВМС, г/моль; β – коэффициент, учитывающий гибкость и форму макромолекулы.
При небольших концентрациях полимера ( 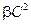
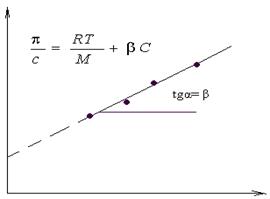
Экспериментальное изучение влияние концентрации ВМС в растворе на его осмотическое давление позволяет с помощью графической зависимости величины π/C от С определить значение средней молекулярной массы полимера М и коэффициента β, который численно равен тангенсу угла наклона прямой в координатах π/C=f(С).
В сложных биологических системах, содержащих неэлектролиты, электролиты и белки, каждый из этих компонентов вносит свой вклад в суммарное осмотическое давление. Вклад, обусловленный наличием белков, называется онкотическим давлением.
|
|
Рис 2 Определение средней молекулярной массы полимера.
Вопрос 6. Устойчивость растворов биополимеров: высаливание, застудневание, коацервация и их роль в
застудневание. В результате ограниченного набухания ВМС или частичного испарения растворителя из раствора ВМС образуются студни. Студень можно рассматривать или как ограниченно набухший полимер или концентрированный раствор полимера. В достаточно концентрированных растворах за счет сцепления макромолекул между собой могут образовываться постоянные пространственные сетки, благодаря чему раствор превращается в студень. На процесс застудневания влияют:
1. концентрация растворов (с увеличением концентрации раствора застудневание ускоряется);
2. форма частиц или молекул (линейные молекулы застудневают легче, чем клубкообразные);
3. температура (с понижением температуры застудневание облегчается).
4. действие электролитов и ПАВ (небольшие концентрации электролитов способствуют ускорению застудневания);
5. время (от нескольких минут до недель);
При старении студней происходит самопроизвольное выделение жидкости, сопровождающееся уплотнением пространственной сетки и возникновением и упрочнением новых контактов между макромолекулами. Такой процесс называется синерезисом. Пример синерезиса – отделение сыворотки при свертывании крови.
Студни, в отличие от гелей, не обладают тиксотропией – способностью восстанавливать свою структуру во времени после ее разрушения. Это означает, что образование геля из золя обратим (золь↔гель), тогда как получение раствора ВМС из студня невозможен.
В студнях, как и в растворах, могут протекать химические реакции. Скорость диффузии ионов и молекул в студнях зависит от концентрации студня. В 1886 г. Р. Лизеганг наблюдал образование осадка Ag2Cr2O7 в студне желатина, пропитанного раствором К2Cr2O7. Если в центр пластины желатина ввести раствор AgNO3, то реакция между бихромат-ионами и ионами серебра будет протекать не только в месте введения раствора, а по всей пластине. При этом наблюдается чередование полос: красноватые кольца бихромата серебра и неокрашенные кольца геля. По мере удаления от места введения реагента растет ширина неокрашенных колец, а интенсивность окраски уменьшается. Наблюдается периодическая реакция.
Для образования осадка серебра бихромата необходимо достижение насыщения раствора этим веществом. При выпадении осадка ближайшее пространство обедняется ионами серебра больше, чем бихромат-ионами согласно стехиометрии ионной реакции. Поэтому ионы Cr2O7 2– продолжают диффундировать по студню, не находя достаточного количества Ag + , и осадок не образуется. Таким образом, за окрашенным кольцом следует неокрашенное.
Периодические (колебательные) реакции лежат в основе ряда биологических процессов: генерации нервных импульсов, мышечного сокращения, генерации биоритмов, образовании почечных и других камней.
Высаливание.Под высаливанием ВМС понимают выделение полимера из раствора при введении электролитов и неэлектролитов. Снижение устойчивости раствора ВМС происходит при уменьшении лиофильности полимера, что может быть достигнуто при введении не только добавлением хорошо гидратируемых ионов (рассмотрено выше), но и растворителя-неэлектролита, в котором полимер растворим хуже, чем в воде. Например, желатин, растворенный в воде, будет высаливаться при добавлении этанола.
В случае разбавленных растворов молекулы полимеров не связаны друг с другом. В концентрированных растворах макромолекулы могут взаимодействовать за счет возникновения водородных связей, электростатических сил и образовывать рои или ассоциаты. С увеличением концентрации и понижением температуры размеры и длительность существования ассоциатов макромолекул увеличивается. При определенных условиях ассоциаты становятся настолько большими и прочными, что их можно рассматривать как новую фазу, в результате чего раствор расслаивается, что может проявиться в коацервации – выделении новообразовавшейся фазы в виде мельчайших капель, обогащенных полимером. В результате одна из фаз системы – раствор ВМС в растворителе, а другая – раствор растворителя в ВМС. Если растворителем является полярная жидкость, например вода, то мельчайшие капельки могут приобретать электрический заряд (это доказывается их способностью к электрофорезу), что придает этим термодинамически неравновесным системам некоторую устойчивость. Такие системы, называемые коацерватами, близки по свойствам к типичным эмульсиям и играют важную роль в живых организмах. Согласно одной из теорий происхождения жизни на земле (А.И. Опарин) коацерваты являются зародышами древних форм жизни. Обычно при длительном стоянии системы, в которой произошла коацервация, образуются два гомогенных жидких слоя, состоящих из фаз с различным содержанием ВМС. Коацервацию используют при микрокапсулировании лекарств. Для этого лекарственное вещество диспергируют в растворе полимера, а затем, изменяя температуру или рН среды, испаряя часть растворителя или вводя высаливатель, выделяют из раствора фазу, обогащенную полимером. Мелкие капли этой фазы отлагаются на поверхности капсулированных частиц, образуя сплошную оболочку. Микрокапсулирование лекарств обеспечивает устойчивость, пролонгирует действие, маскирует неприятный вкус лекарств. В научных исследованиях микрокапсулы могут использоваться как модели живой клетки.
Дата добавления: 2016-11-04 ; просмотров: 6154 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Осмотическое давление растворов ВМС. Уравнение Галлера
Экспериментально определенное осмотическое давление для растворов многих ВМС данной концентрации значительно превышает вычисленное по уравнению Вант-Гоффа: p = СRT, причина в высокой подвижности фрагментов ВМС, одна макромолекула по влиянию на осмотическое давление ведет себя как несколько молекул меньшего размера. Для расчета осмотического давления растворов ВМС применяют уравнение Галлера:
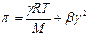 , где , где | γ – массовая концентрация раствора ВМС, г/л; М – молярная масса ВМС, г/моль; b – коэффициент, учитывающий гибкость и форму макромолекул в растворе. |
Осмометрический метод применяется при определении молярной массы полимеров.
14. Онкотическое давление плазмы крови. Онкотическое давление крови – часть осмотического давления, создаваемая растворенными в ней белками (альбумины, глобулины). Доля онкотического давления составляет 0,5% от суммарного осмотического давления. В артериальной части капилляров гидростатическое давление больше онкотического, в венозной меньше (рис. 7 ).
Рис. 4. Осмотическое равновесие
В артериальной части тканевых капилляров гидростатическое давление крови способствует, а онкотическое давление крови препятствует выходу воды из крови. В венозной части капилляров происходит осмос воды из ткани в кровь. Онкотическое давление способствует, а гидростатическое давление препятствует вхождению воды в кровь.
15. Изоэлектрическая точка и методы ее определения ИЭТ или pI.
Полиэлектролиты. Полиамфолиты. Изоэлектрическое состояние.
| R ¾ NH3 + ï СООН | -Н ® +Н | R ¾ NH3 + ï СОО — | -Н ® +Н | R ¾ NH2 ï СОО — |
| рН ИЭТ | ||||
| макрокатион | макромолекула | макроанион |
Рис.5. Полиамфолиты в разных средах.
Методы определения ИЭТ:
Прямые методы – электрокинетические методы, например электрофорез. При этом определяют рН раствора белка, при котором электрофоретическая подвижность частиц минимальна. Изоэлектрическая точка большинства белков меньше 7: для желатина ИЭТ равна 4,7, для казеина — 4,6, для глобулина — 5,4, для пепсина – 1, что говорит о преобладании кислых аминокислот.
 |  | ||||||||||||
| рН > ИЭТ макроанион | рН
равновесие Доннана описывается уравнением:
17. Высаливание биополимеров из раствора.Лиотропные ряды: Li > Na K > Rb > Cs > Mg 2+ > Ca 2+ > Sr 2+ > Ba 2+ Вязкость растворов ВМС. Осмотическое давление растворов ВМС. Уравнение Штаудингера и Галлера.
|