Электрокинетический потенциал
Направленное перемещение частиц дисперсной фазы под действием электрического поля может наблюдаться в седиментационно-устойчивых дисперсных системах. При этом происходит разрыв ДЭС по плоскости скольжения, в результате частица приобретает определенный заряд и движется к соответствующему электроду.

Рис. 18. Схема движения коллоидных частиц в электрическом поле.
Линейная скорость (U) – движение частиц относительно мембраны при электроосмосе и движение частиц при электрофорезе:
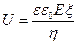
где 
При движении частиц дисперсной фазы они вынуждены взаимодействовать с противоионами дисперсионной среды, что вызывает электрофоретическое торможение, что уменьшает линейную скорость при электрофорезе.
Электрофоретическое торможение 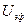
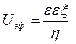
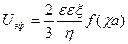
где f — параметр Дебая, α – диаметр частицы. Единицы измерения электрофоретического торможения 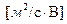
Характеристикой электрофореза является также электрофоретическая подвижность, которая характеризует электрофоретические свойства системы без учета влияния внешнего электрического поля и служит для сравнения способности к электрофорезу различных коллоидных систем.
При исследовании явления электроосмоса для практического применения при расчете электрокинетического потенциала удобнее использовать уравнение, в которое входят величины, измеряемые экспериментально. Выразим линейную скорость через объёмную:
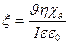
где r – радиус капилляра, l – длина капилляра, I – сила тока, ρ – удельное сопротивление, χv – удельная электрическая проницаемость жидкости, R – сопротивление.
Пи расчете электрокинетического потенциала и при выборе оптимального режима ряда технологических процессов (проведение электродиализа, определении пористости грунтов т.д.) необходимо учитывать поверхностную проводимость χs – это явление сводится к тому, что находящиеся около межфазной границы ионы изменяют состав среды, они являются причиной передвижения жидкости или частиц. Изменение состава среды ведёт к изменению электропроводности раствора у межфазной границы.
Поверхностная проводимость χs учитывается путём введения коэффициента эффективности диафрагмы α:
Путём электроосмоса удаляют влагу из капиллярнопористых систем и понижают уровень грунтовых вод при возведении гидротехнических сооружений.
Метод электрофореза применяют для формирования изделий из тонких взвей последующим спеканием для разделения, выделения и исследования биоколлоидов, особенно белков.
Возникновение электрических полей при течении грунтовых вод помогает в геологической разведке полезных ископаемых и водных источников.
Коллоидная химия (стр. 7 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 |
5.3. Строение мицеллы лиофобных золей
Частицы дисперсной фазы, существующие в дисперсных системах, имеют гораздо более сложное строение, нежели просто небольшие кусочки или капельки вещества.
На поверхности мельчайших дисперсий адсорбируются присутствующие в дисперсионной среде вещества, в том числе ионизированные стабилизаторы. При этом, как уже говорилось выше, на поверхности дисперсий возникает двойной электрический слой. Рассмотрим в качестве наиболее простого случая частичку дисперсии, имеющую кристаллическое строение (аморфные дисперсии будут отличаться, главным образом, большей нерегулярностью в строении адсорбционного слоя).
Так, например, при химической конденсации в результате взаимодействия растворов серной кислоты и хлорида бария возникают мельчайшие, коллоидных размеров, кристаллики сульфата бария. Один из исходных электролитов — серная кислота или хлорид бария — всегда будет присутствовать в некотором избытке (это может получиться случайно или может быть сделано произвольно, по выбору экспериментатора). Предположим, что в избытке взят хлорид бария. Тогда в дисперсионной среде, окружающей кристаллики BaSO4 будут иметься ионы Ва2+, Cl — и Н+. В соответствии с правилом Панета — Фаяиса на поверхности кристалликов ВаSО4, будут адсорбироваться ионы Ва2+, как способные достроить их кристаллическую решетку. Придавая поверхности кристаллика электрический заряд, и будучи достаточно прочно связанными с поверхностью, ионы Ва2+ в данном случае будут выступать в качестве потенциалопределяющих ионов (ПОИ). Для нейтрализации положительного заряда поверхности к ней подойдёт эквивалентное число отрицательно заряженных противоионов, в данном случае ионов Cl-. В соответствии с теорией Штерна часть их, довольно близко подошедшая к поверхности и связанная с ней, кроме электростатических, ещё и адсорбционными силами, образует адсорбционный слой.
 |
Рис. 5.4. Схема строения мицеллы золя сульфата бария,
стабилизированного хлоридом бария
Другая часть противоионов, находящихся на большем расстоянии и связанная с поверхностью только электростатическими силами, образует диффузный слой. Противоионы диффузного слоя при броуновском движении коллоидной частицы или в результате собственного теплового движения могут отрываться от неё. Но для соблюдения электронейтральности на место ушедших ионов становятся другие ионы той же природы или, по крайней мере, того же знака. При помещении коллоидного раствора в постоянное электрическое поле противоионы движутся в сторону одного электрода (в рассматриваемом примере – в сторону анода), а твёрдая частица вместе с потенциалопределяющими ионами и противоионами адсорбционного слоя – в сторону другого (в данном примере в сторону катода). Разрыв происходит по границе между адсорбционным и диффузным слоями противоионов, называемой поверхностью скольжения.
Твёрдая основа частицы («агрегат») вместе с двойным электрическим слоем из ионов адсорбированного на её поверхности электролита образует электронейтральную субъединицу дисперсной фазы – мицеллу (не следует путать с мицеллами ПАВ!). Часть мицеллы, находящаяся внутри поверхности скольжения, и движущаяся в электрическом поле, как единое целое, носит название собственно коллоидной частицы или гранулы. Так как в гранулу не входят противоионы диффузного слоя, часть зарядов находящихся в ней остаётся нескомпенсированной. Поэтому гранула несёт на себе электрический заряд, по знаку совпадающий со знаком потенциалопределяющих ионов и численно равный суммарному заряду противоионов диффузного слоя. Внутри гранулы можно выделить ещё одну относительно самостоятельную часть мицеллы – ядро. Ядро образовано агрегатом и потенциалопределяющими ионами и, следовательно, тоже несёт электрический заряд.
5.4. Формула мицеллы
Записывая взаимное расположение составляющих мицеллы, начиная от её центра по направлению к периферии, мы получим формулу мицеллы. В данном примере она носит название «формула мицеллы золя сульфата бария, полученного в избытке хлорида бария» (или «стабилизированного хлоридом бария»):

агрегат ПОИ противоионы противоионы
В формуле мицеллы в квадратные скобки принято заключать химическую формулу агрегата. Коэффициент m показывает, что в агрегат входит какое-то достаточно большое число (сотни или тысячи) молекул вещества. Точно определить это число сложно и для практических целей оно несущественно. Достаточно знать, что m намного больше единицы.
Встречается и другое написание формулы агрегата: m [BaSO4]. Но нам представляется, что в этом случае коэффициент m скорее указывает на множественность агрегатов, чего не может быть в одной мицелле, а не на сложность строения самого агрегата.
В фигурные скобки заключается гранула. Иными словами, фигурные скобки соответствуют поверхности скольжения.
Перед формулой потенциалопределяющего иона ставится коэффициент n. Его буквенное обозначение также говорит о неопределённо большом числе этих ионов. Следует помнить, что m ¹ n, причём, как правило, m >> n.
Суммарный заряд противоионов по закону электронейтральности должен быть равен заряду потенциалопределяющих ионов. Поэтому в данном примере в формуле мицеллы должно присутствовать 2n ионов Cl-. Число противоионов диффузного слоя в общем случае принято обозначать коэффициентом х. Тогда для числа противоионов в адсорбционном слое следует написать (n – x). В нашем примере записывается соответственно 2х и 2(n – x) из-за того, что ион бария имеет заряд вдвое больший, чем хлорид-ион, и на каждый ион Ba2+ приходится два иона Cl-. Над закрывающей фигурной скобкой записывается заряд гранулы, который равен, но противоположен по знаку суммарному заряду противоионов диффузного слоя. В рассматриваемом примере заряд гранулы равен 2х+.
Так как потенциалопределяющие ионы, ядро и гранула рассматриваемого коллоидного раствора заряжены положительно, его можно назвать «положительным золем сульфата бария».
Если же при получении коллоидного раствора в избытке будет серная кислота, двойной электрический слой будет иметь другое строение. Из ионов, имеющихся в растворе, на поверхности агрегатов (мельчайших частиц твёрдого сульфата бария) в соответствии с правилом Панета – Фаянса в первую очередь будут адсорбироваться ионы SO42-, которые станут потенциалопределяющими ионами. Ядро мицеллы, таким образом, будет заряжено отрицательно. Для нейтрализации отрицательного заряда ядра из раствора подойдут в эквивалентном количестве противоионы, которыми в данном случае будут являться ионы Н+. Формула мицеллы золя сульфата бария, полученного в избытке серной кислоты, будет выглядеть так:

агрегат ПОИ противоионы противоионы
По заряду потенциалопределяющих ионов, ядра и гранулы этот золь называется отрицательным золем сульфата бария.
В некоторых случаях, отвечающих сжатию ДЭС мицеллы до «гельмгольцевского» слоя, мицелла переходит в изоэлектрическое состояние. Оно соответствует сжатию мицеллы до размеров гранулы, что может быть выражено следующей формулой:
< [m BaSO4] n Ba2+ 2n Cl - >0 (для первоначально положительного золя)
или < [m BaSO4] n SO42- 2n H+ >0 (для первоначально отрицательного золя)
В изоэлектрическом состоянии, когда их z-потенциал равен нудю, золи обладают наименьшей агрегативной устойчивостью.
На приведённых примерах можно убедиться, что ДЭС мицеллы бывает образован ионами того электролита, который при получении золя присутствовал в реакционной смеси в некотором избытке. Этот электролит называется стабилизатором, т. к. из дальнейшего изложения будет видно, что именно ДЭС является главным фактором, обусловливающим агрегативную устойчивость коллоидных растворов. Поэтому можно предложить ещё одно название рассмотренных золей: «коллоидный раствор (золь) сульфата бария, стабилизированный хлоридом бария» и, соответственно, «коллоидный раствор (золь) сульфата бария, стабилизированный серной кислотой». Из этого также должно стать понятным, что пептизатор, вызывающий переход рыхлого осадка в коллоидный раствор, по сути дела является стабилизатором, восстанавливающим двойной электрический слой частиц, разрушенный при образовании осадка.
Во многих случаях ДЭС на поверхности мицелл может возникать из ионов, образующихся при поверхностных реакциях вещества твёрдой фазы с веществами, присутствующими в дисперсионной среде, как, например, при получении золей методами физической конденсации или диссолюционной пептизации.
5.5. Электрокинетические явления
Существование на поверхности частиц дисперсных систем двойного электрического слоя является причиной особых электрокинетических явлений. Впервые эти явления были обнаружены в 1807 – 09 гг. Исследуя закономерности электролиза, Рейсс, чтобы предотвратить взаимодействие его продуктов, разделил катодное и анодное пространства в U-образной трубке диафрагмой из толчёного песка. При пропускании электрического тока через эту систему он обнаружил перенос жидкости из анодного в катодное пространство. Такое явление получило название электроосмоса. Электроосмос приводит к изменению уровней жидкости в сообщающихся сосудах — анодной и катодной частях U-образной трубки.
Ещё одно электрокинетическое явление — электрофорез, — было обнаружено Рейссом в аналогичном эксперименте, с тем, однако, отличием, что здесь роль диафрагмы играл не песок, а высокодисперсная глина. (Сам Рейсс назвал это явление катафорезом). Погрузив во влажный комок глины две заполненные водой стеклянные трубки с электродами. Рейсс обнаружил, что после приложения к электродам разности потенциалов наряду с подъёмом жидкости (у катода) в анодном пространстве появляется взвесь частиц глины. Перемещение высокодисперсных частиц (в данном случае мельчайших частиц глины) глины под действием электрического тока и является электрофорезом.
Электрофорез и электроосмос наблюдаются в дисперсных системах с жидкой полярной, чаще всего водной средой. Их причиной является движение разноимённо заряженных частей двойного электрического слоя относительно друг друга, которое вызывается прохождением через систему электрического тока. Разрыв ДЭС происходит по поверхности скольжения, проходящей между адсорбционным и диффузным слоями противоионов.
Электрофорез наблюдается в ультрамикрогетерогенных (коллоидных) системах. При нём противоионы диффузного слоя движутся в сторону электрода с соответствующим зарядом – катионы в сторону катода, анионы – в сторону анода. Эти ионы в своём движении увлекают за собой какую-то часть дисперсионной среды. Однако при отсутствии мембраны, разделяющей катодное и анодное пространство, это перемещение жидкости незаметно. Гранулы коллоидных мицелл, имеющие заряд, противоположный заряду противоионов, движутся к другому электроду. Движение гранул происходит намного медленнее, чем ионов, что обусловлено несколькими причинами – большими размерами, большим электрическим зарядом и сопротивлением движущейся им навстречу жидкости, увлекаемой противоионами. Огромные по сравнению с ионами объём и масса гранул создают значительное гидродинамическое сопротивление. А большой заряд является причиной того, что при разряде на одном электроде огромного числа противоионов требуется разряд на другом электроде всего одной гранулы.
Электроосмос наблюдается в грубодисперсных системах, частицы которых из-за больших размеров неподвижны или, как в связнодисперсных системах, образуют достаточно прочную единую объёмную структуру. При этом в движении под действием электрического тока участвуют только противоионы диффузного слоя, увлекающие за собой жидкую дисперсионную среду. Так как совокупность неподвижных частиц дисперсной фазы играет роль полупроницаемой мембраны, перемещение жидкой фазы становится заметным.
Электроосмос и электрофорез используются на практике, но их применение, в особенности электроосмоса, ограничено в связи с большим расходом электроэнергии. Так, электроосмос может быть использован для предварительного обезвоживания пористых материалов, например, древесины или пористых сорбентов, для облегчения резания глины в кирпичном производстве и т. п. Электрофорез применяется для нанесения на металлические детали плотных и прочных резиновых и других полимерных покрытий, для очистки каолина в фарфоровом производстве, но особенно велика его роль в биохимии и в медицине. В частности, он применяется для электрофоретического анализа крови с целью диагностики, для разделения белков на фракции, а также в качестве широко известной физиотерапевтической процедуры.
Впоследствии были обнаружены электрокинетические явления, противоположные электроосмосу и электрофорезу, и заключающиеся в появлении электрического поля в результате перемещения относительно друг друга дисперсной фазы и дисперсионной среды. Явление, обратное электроосмосу (эффект Квинке) — возникновение электрического тока при протекании жидкости через пористую диафрагму — наблюдал в 1859 г. Г. Квинке. Эффект Квинке может быть продемонстрирован на таком несложном опыте. В стеклянную трубку помещается кварцевый песок, полностью перекрывающий её просвет. Вместо песка может быт использована любая пористая диафрагма, например, стеклянная пористая пластинка фильтра Шотта. С двух сторон песка или другой диафрагмы в трубку вводятся электроды, изготовленные, например, из медной сетки или из перфорированных пластинок. Затем через трубку насосом или под действием собственной тяжести прокачивается вода. Гальванометр, присоединённый к электродам, зарегистрирует появление разности потенциалов – т. н. «потенциала протекания».
Обратное электрофорезу явление возникновения электрического тока и разности потенциалов при движении частиц (эффект Дорна) — было обнаружено в 1878 г.
. Этот эффект тоже может быть показан на несложном опыте. В высокий стеклянный цилиндр с водой помещаются два кольцеобразных металлических электрода, один несколько выше дна, а другой – немного ниже поверхности воды. Если сверху в цилиндр сыпать тонкой струёй кварцевый песок, между электродами возникнет разность потенциалов – «потенциал оседания (седиментации)».
Оба эти эффекта обусловлены разрывом двойного электрического слоя по поверхности скольжения при относительном перемещении частиц дисперсной фазы и дисперсионной среды, которая увлекает за собой противоионы диффузного слоя.
5.6. Экспериментальное определение электрокинетического
Электрокинетические явления, в особенности электроосмос и электрофорез, могут быть использованы для экспериментального определения одной из важнейших характеристик коллоидных систем — электрокинетического потенциала.
При этом используется уравнение Гельмгольца — Смолуховского для скорости электроосмоса или электрофореза:

где v — линейная скорость электроосмоса (электрофореза), м/с; e — диэлектрическая проницаемость дисперсионной среды; e0 — электрическая постоянная (диэлектрическая проницаемость вакуума, 8,85´10-12 Ф/м); H — напряжённость внешнего электрического поля (H = E / l; E — напряжение на электродах, В; l — расстояние между ними, м); z — электрокинетический потенциал, В.
Уравнение выводится в предположении, что двойной электрический слой на поверхности коллоидных частиц можно рассматривать как плоский конденсатор и что разность потенциалов между его обкладками соответствует электрокинетическому потенциалу z.
В соответствии с теорией плоского конденсатора плотность заряда на его обкладках s определяется соотношением

где d — расстояние между обкладками, т. е. толщина плотного слоя ДЭС.
Внешнее электрическое поле, параллельное ДЭС, создаёт напряжение сдвига Fe, — пару сил, действующих на единицу площади ДЭС вдоль его поверхности:
Скорость v взаимного смещения фаз под действием этого напряжения сдвига связана с силой вязкого сопротивления среды Fh уравнением Ньютона

где h — вязкость дисперсионной среды; dv/dd — градиент скорости смещения дисперсионной среды относительно поверхности твёрдой фазы. Считая величину dv/dd постоянной во всём зазоре между обкладками конденсатора (ДЭС), можно принять, что

где v – наблюдаемая скорость взаимного смещения фаз.
При установившемся равномерном движении

откуда получаем окончательное уравнение Гельмгольца – Смолуховского:

Иногда это уравнение записывают в виде

где v0 = v/H – электрофоретическая подвижность, служащая для сравнения способности к электрофорезу различных коллоидных систем и не зависящая от приложенного напряжения и расстояния между электродами.
Уравнение Гельмгольца – Смолуховского можно преобразовать для вычисления z-потенциала частиц дисперсной фазы при известной скорости электрофореза или электроосмоса:

Измеряется скорость перемещения частиц при электрофорезе или жидкой среды при электроосмосе с помощью специальных приборов. Конструкции этих приборов, а также методики измерений приводятся в практикумах или в специальных руководствах.
Экспериментально определённые значения z-потенциала в большинстве золей достигают значений до 100 мВ, что обычно несколько меньше действительного. Это расхождение обусловлено двумя эффектами, которые не были учтены при выводе уравнения Гельмгольца — Смолуховского: релаксационным эффектом (в результате нарушения симметрии диффузного слоя вокруг частицы при движении фаз в противоположные стороны) и электрофоретическим торможением (сопротивление движению частицы обратным потоком противоионов). Эти тормозящие эффекты зависят от размера частиц и толщины двойного электрического слоя. Э Хюккелем на основе теории растворов сильных электролитов было показано, что в уравнение Гельмгольца – Смолуховского следует ввести в качестве поправки множитель 2/3. Однако эта поправка необходима только тогда, когда толщина диффузного слоя значительно превышает размер гранулы, что имеет место в очень разбавленных золях.
УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ ДИСПЕРСНЫХ СИСТЕМ
Устойчивость дисперсной системы характеризуется неизменностью во времени её основных параметров — степени дисперсности и равномерного распределения частиц дисперсной фазы в среде.
Проблема устойчивости — одна из самых важных и сложных в коллоидной химии. Она имеет большое значение во многих процессах, как протекающих в природе, так и используемых в народном хозяйстве, в том числе в фармации, в особенности в технологии лекарств. Так, обеспечение устойчивости свободнодисперсных систем необходимо при получении из них лекарственных эмульсий, суспензий, пен, аэрозольных препаратов и др. С другой стороны, во многих случаях требуется нарушить устойчивость образовавшихся коллоидных растворов, тонких взвесей или эмульсий для того, чтобы вызвать структурообразование в материалах, чтобы при гравиметрическом анализе получить осадки, не пептизирующиеся при отмывании, чтобы более эффективно проводить очистку сточных вод и т. д.
6.1. Виды устойчивости
По предложению (1920) устойчивость дисперсных систем подразделяют на два вида:
1. седиментационная устойчивость (устойчивость к осаждению дисперсной фазы);
2. агрегативная устойчивость (устойчивость к объединению частиц).
Первый вид устойчивости, который характеризует способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объёму дисперсионной среды, связан с размерами частиц. Частицы с поперечником более (10-5 см) не могут поддерживаться во взвешенном состоянии броуновским движением и будут седиментировать, т. е. оседать, если их плотность больше плотности дисперсионной среды, или всплывать, если их плотность меньше. Седиментация будет подробнее рассмотрена в главе 7.
В данном разделе мы главное внимание уделим явлениям, связанным с агрегативной устойчивостью.
Агрегативная устойчивость определяется способностью систем противодействовать процессам, ведущим к уменьшению свободной поверхности энергии.
Такими процессами являются изотермическая перегонка вещества от малых частиц к более крупным, коалесценция и агрегация частиц при их столкновениях. На практике наиболее часто приходится встречаться с процессами коалесценции (слиянием капель в эмульсиях, туманах или пузырьков в пенах) и агрегации (объединении твёрдых частиц коллоидных растворов в более или менее прочные агрегаты, которые в принципе могут быть разделены на первоначальные частицы пептизации). Агрегация может происходить в виде коагуляции или в виде флокуляции. Иногда понятия флокуляции и коагуляции из-за схожести механизма и внешних проявлений отождествляются, но всё-таки различия между ними имеются. Флокуляция происходит, как правило, с участием посторонних веществ – флокулянтов, в качестве которых могут выступать различные полимерные природные и синтетические вещества – крахмал, пектины, полиакриламид и др., а также кремниевая кислота. Она заключается в образовании рыхлых хлопьевидных агрегатов и может происходить не только в коллоидных растворах, но и в суспензиях и эмульсиях. Коагуляция (от coagulation – створаживание) – это слипание частиц дисперсной фазы, происходящее при их столкновениях в результате броуновского движения, перемешивания и т. п. Коагуляция может происходить и под влиянием только физических факторов, без введения в систему посторонних веществ.
Следует отметить, что все три упомянутые процесса укрупнения частиц приводят рано или поздно к потере системой седиментационной устойчивости, то есть к выпадению возникающих крупных частиц или хлопьев (флокул) в осадок. С другой стороны, седиментация частиц в грубодисперсных системах приводит к тому, что в образующемся осадке они тесно соприкасаются друг с другом и при определённых условиях могут потерять агрегативную устойчивость, т. е. соединятся в агрегаты.
Различные дисперсные системы могут обладать или очень высокой агрегативной устойчивостью, при которой они могут храниться в неизменном состоянии очень долгое время (даже годами), или, наоборот, очень низкой, когда их разрушение происходит вскоре после образования (например, через несколько секунд).
6.2. Факторы агрегативной устойчивости
Различают термодинамические и кинетические факторы устойчивости,
К термодинамическим факторам относятся электростатический, адсорбционно-сольватный и энтропийный факторы.
Электростатический фактор обусловлен существованием на поверхности частиц дисперсной фазы двойного электрического слоя. Главные составляющие электростатического фактора — это одноимённый заряд гранул всех коллоидных частиц, значение электрокинетического потенциала, а также уменьшение межфазного поверхностного натяжения вследствие адсорбции электролитов (особенно в тех случаях, когда электролитами являются ионогенные ПАВ).
Одноимённый электрический заряд гранул приводит к взаимному отталкиванию сближающихся коллоидных частиц. Причём на расстояниях, превышающих диаметр мицелл, электростатическое отталкивание обусловлено, главным образом зарядом противоионов диффузного слоя. Если же быстро движущиеся частицы сталкиваются друг с другом, то противоионы диффузного слоя, будучи относительно слабо связанными с частицами, могут сместиться, и в результате соприкоснутся гранулы. При этом главную роль в силах отталкивания играет электрокинетический потенциал. А именно, если его значение превышает 70 – 80 мВ, то налетающие друг на друга в результате броуновского движения частицы не смогут преодолеть электростатический барьер и, столкнувшись, разойдутся и агрегации не произойдёт. О роли поверхностного натяжения, как термодинамического фактора устойчивости, говорилось в главе 1.
Адсорбционно-сольватный фактор связан с гидратацией (сольватацией) как самих частиц дисперсной фазы, так и адсорбированных на их поверхности ионов или незаряженных молекул ПАВ. Гидратные оболочки и адсорбционные слои связаны с поверхностью частиц силами адгезии. Поэтому для непосредственного соприкосновения агрегатов сталкивающиеся частицы должны обладать энергией, необходимой не только для преодоления электростатического барьера, но и превышающей работу адгезии.
Энтропийный фактор заключается в стремлении дисперсной фазы к равномерному распределению частиц дисперсной фазы по объёму системы в результате диффузии. Этот фактор проявляется, главным образом, в ультрамикрогетерогенных системах, частицы которых участвуют в интенсивном броуновском движении.
К кинетическим факторам устойчивости относятся структурно-механический и гидродинамический факторы.
Структурно-механический фактор связан с тем, что существующие на поверхности частиц гидратные (сольватные) оболочки обладают повышенной вязкостью и упругостью. Это создаёт дополнительное отталкивающее усилие при столкновении частиц – так называемое расклинивающее давление. В расклинивающее давление вносит вклад также и упругость самих адсорбционных слоёв. Учение о расклинивающем давлении было разработано (1935).
Гидродинамический фактор связан с вязкостью дисперсионной среды. Он снижает скорость разрушения системы благодаря замедлению движения частиц в среде с большой вязкостью. Наименее выражен этот фактор в системах с газовой средой, а наибольшее его проявление наблюдается в системах с твёрдой средой, где частицы дисперсной фазы вообще лишены подвижности.
В реальных условиях устойчивость дисперсных систем обычно обеспечивается несколькими факторами одновременно. Наиболее высокая устойчивость наблюдается при совместном действии и термодинамических, и кинетических факторов.
Каждому фактору устойчивости соответствует специфический метод его нейтрализации. Например, действие структурно-механического фактора можно снять с помощью веществ, разжижающих и растворяющих упругие структурированные слои на поверхности частиц. Сольватация может быть уменьшена или вовсе исключена лиофобизацией частиц дисперсной фазы при адсорбции соответствующих веществ. Действие электростатического фактора значительно снижается при введении в систему электролитов, сжимающих ДЭС. Этот последний случай наиболее важен как при стабилизации, так и при разрушении дисперсных систем.
Как уже говорилось выше, в основе коагуляции лежит нарушение агрегативной устойчивости системы, приводящее к слипанию частиц дисперсной фазы при их столкновениях. Внешне коагуляция коллоидных растворов проявляется в виде помутнения, иногда сопровождающегося изменением цвета, с последующим выпадением осадка.
В образующихся при коагуляции агрегатах первичные частицы связаны друг с другом или через прослойку дисперсионной среды, или непосредственно. В зависимости от этого агрегаты могут быть или рыхлыми, легко подающимися пептизации, или достаточно прочными, часто необратимыми, которые пептизируются с трудом или вообще не пептизируются. В системах с жидкой дисперсионной средой, особенно при большой концентрации частиц дисперсной фазы, выпадение образующихся агрегатов в осадок часто сопровождается структурообразованием – образованием коагеля или геля, охватывающего весь объём системы.
Первой стадией коагуляции золя при нарушении его устойчивости является скрытая коагуляция, которая заключается в объединении лишь незначительного числа частиц. Скрытая коагуляция обычно не фиксируется невооружённым глазом и может быть отмечена лишь при специальном исследовании, например, с помощью ультрамикроскопа. Вслед за скрытой коагуляцией наступает явная, когда объединяется уже настолько значительное количество частиц, что это приводит к хорошо заметным изменению цвета, помутнению золя и выпадению из него рыхлого осадка (коагулята). Возникающие в результате потери агрегативной устойчивости коагуляты представляют собой оседающие (или всплывающие) образования различной структуры — плотные, творожистые, хлопьевидные, волокнистые, кристаллоподобные. Структура и прочность коагулятов в значительной степени определяется степенью сольватации (гидратации) и присутствием на частицах адсорбированных веществ различной природы, в том числе ПАВ.
было подробно изучено поведение золей при коагуляции с не полностью снятыми защитными факторами и показано, что в таких случаях наблюдается коагуляционное структурообразование, приводящие к появлению гелеобразных систем (строение которых будет рассмотрено в главе 11).
Процесс, обратный коагуляции, называется пептизацией (см. п. 4.2.3). В ультрамикрогетерогенных системах, в которых энергия броуновского движения соизмерима с энергией связи частиц в агрегатах (флокулах), между коагуляцией и пептизацией может устанавливаться динамическое равновесие. Оно должно отвечать условию
где z – координационное число частицы в пространственной структуре коагулята (иначе, — число контактов одной частицы в образующемся агрегате с другими частицами, входящими в него), E – энергия связи между частицами, находящимися в контакте, k – константа Больцмана, T – абсолютная температура, Vз – объём, приходящийся на одну частицу в коллоидном растворе, после образования коагулята (если концентрация частиц при этом равна n частиц/м3, то Vз = 1/n,), Vк – эффективный объём, приходящийся на одну частицу внутри коагуляционной структуры (или объём, в котором она колеблется относительно положения равновесия).
В лиофобных дисперсных системах после коагуляции концентрация частиц в равновесном золе обычно пренебрежимо мала по сравнению с их концентрацией. Поэтому в соответствии с вышеприведённым уравнением коагуляция является, как правило, необратимой. В лиофильных системах значения энергии связи между частицами невелики и поэтому
Курсовая работа: Электрокинетические явления в дисперсных системах
| Название: Электрокинетические явления в дисперсных системах Раздел: Рефераты по химии Тип: курсовая работа Добавлен 12:41:35 03 марта 2008 Похожие работы Просмотров: 1830 Комментариев: 21 Оценило: 3 человек Средний балл: 5 Оценка: неизвестно Скачать |
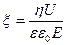
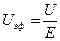
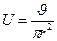
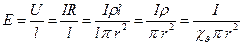
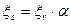
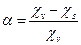




 будет определяться известной из физики формулой:
будет определяться известной из физики формулой: (I.1)
(I.1) ), который
), который , соответственно обозначить через С+ и С— , то для расстояния x=
, соответственно обозначить через С+ и С— , то для расстояния x= :
:
 Например, разрыв двойного слоя может произойти вследствие седиментации или броуновского движения частиц дисперсной фазы. Плоскость скольжения обычно проходит по диффузному слою, и часть его ионов остаётся в дисперсной среде. В результате дисперсионная среда и дисперсная фаза оказываются противоположно заряженными. Потенциал, возникающий на плоскости скольжения при отрыве части диффузного слоя, называется электрокинетическим потенциалом или
Например, разрыв двойного слоя может произойти вследствие седиментации или броуновского движения частиц дисперсной фазы. Плоскость скольжения обычно проходит по диффузному слою, и часть его ионов остаётся в дисперсной среде. В результате дисперсионная среда и дисперсная фаза оказываются противоположно заряженными. Потенциал, возникающий на плоскости скольжения при отрыве части диффузного слоя, называется электрокинетическим потенциалом или 


 . Из данного соотношения следует, что понижение температуры, введение в систему индифферентного электролита (специфически не взаимодействующего с поверхностью) и увеличение заряда его ионов ведут к уменьшению электрокинетического потенциала. Этот потенциал будет снижаться и с уменьшением диэлектрической проницаемости среды, например, при добавлении в водный раствор спиртов, эфиров и других органических веществ.
. Из данного соотношения следует, что понижение температуры, введение в систему индифферентного электролита (специфически не взаимодействующего с поверхностью) и увеличение заряда его ионов ведут к уменьшению электрокинетического потенциала. Этот потенциал будет снижаться и с уменьшением диэлектрической проницаемости среды, например, при добавлении в водный раствор спиртов, эфиров и других органических веществ. (III.1)
(III.1) и
и  (III.2)
(III.2)
 =
=  (III.3)
(III.3) =0, а
=0, а  и
и 
 (III.4)
(III.4) (III.5)
(III.5) (III.6)
(III.6) (III.7)
(III.7) -удельная электропроводность.
-удельная электропроводность. (III.8)
(III.8) будет разная. Ионы адсорбируются на стенках капилляра. Электропроводность будет больше в капилляре.
будет разная. Ионы адсорбируются на стенках капилляра. Электропроводность будет больше в капилляре. (III.9)
(III.9) -поверхностная проводимость (избыток электропроводности, связанный с наличием на стенках капилляра двойных электрических слоёв).
-поверхностная проводимость (избыток электропроводности, связанный с наличием на стенках капилляра двойных электрических слоёв). длина окружности капилляра.
длина окружности капилляра. (III.10)
(III.10) (III.11)
(III.11) и расчетное значение
и расчетное значение  р.
р. (IV.1)
(IV.1)
 (IV.2)
(IV.2) (IV.3)
(IV.3) (IV.4)
(IV.4)