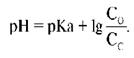Буферные системы, их классификация и механизм действия. Буферные растворы. Уравнение Гендерсона-Гассельбаха.
Буферными системами (буферами) называют растворы, обладающие свойством достаточно, стойко, сохранять постоянство — концентрации водородных ионов как при добавлении кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) из слабой кислоты и ее соли, образованной сильным основанием;
б) из слабого основания и его соли, образованной сильной кислотой.
На практике часто применяют следующие буферные смеси: ацетатный буфер CH3COOH + CH3COONa, бикарбонатный буфер H2CO3+NaHCO3, аммиачный буфер NH4OH +NH4Cl, белковый буфер белок кислота + белок соль, фосфатный буфер NaH2PO4 + Na2 HPO4
Фосфатная буферная смесь состоит из двух солей, одна из которых является однометаллической, а вторая — двухметаллической солью фосфорной кислоты.
Рассмотрим механизм буферного действия. При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СНзСООН); Из уравнения (а), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае НСl заменяется СН3СООН). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н + в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера, (СН3СООН) по реакции нейтрализации. В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей — степени влияющей на реакцию среды. Анионы СНзСОО
, образующиеся при диссоциации этой соли, будут оказывать некоторое Угнетающее действие на диссоциацию уксусной кислоты.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
Примером кислотного буфера может служить ацетатный буферный раствор, содержащий смесь уксусной кислоты и ацетата натрия (СНзСООН + СНзСООNа). При добавлении к такому раствору кислоты она взаимодействует с солью и вытесняет эквивалентное количество слабой кислоты: СНзСООNа + НСl ó СН3СООН + NaСl. В растворе вместо сильной кислоты образуется слабая, и поэтому величина рН уменьшается незначительно. Если к этому буферному раствору добавить щелочь, она нейтрализуется слабой кислотой, и в растворе образуется эквивалентное количество соли: СНзСООН + NaОН ó СНзСООNа + Н2О. В результате рН почти не увеличивается. Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга. Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты: СНзСООNа -> Na + + СН3СОО
СНзСОО — + НОН ó СНзСООН + ОН — . Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени: СНзСООН ó СН3СОО+H — Слабая диссоциация СНзСООН еще более подавляется в при-сутствии СНзСООNа, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:[СНзСООН] = сr. C другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты: [СНзСОО] = сс. Это уравнение называют уравнением буферного раствора (уравнением Гендерсона Гассельбаха). Его анализ для буферного раствора, образованного слабой кислотой и ее солью, показывает, что концентрация водородных ионов в буферном растворе определяется константой диссоциации слабой кислоты и соотношением концентраций кислоты и соли. Уравнение Гендерсона-Хассельбаха для буферных систем основного типа:
31.Емкость буферных растворов и факторы, определяющие её. Буферные системы крови. Водородкарбонатный буфер. Фосфатный буфер.
Буферной емкостью (В) называется количество сильной кислоты или сильного основания, которое нужно прибавить к одному литру буферного раствора, чтобы изменить его рН на единицу. Она выражается в моль/л или чаще в ммоль/л и определяется по формуле: В = (c V) / д pH Vб , где В — буферная емкость; с — концентрация сильной кислоты или основания (моль/л); V — объем добавленного сильного электролита (л); Vб — объем буферного раствора (л); д рН — изменение рН.
Способность растворов поддерживать постоянное значение pH небезгранична. Буферные смеси можно различить по силе оказываемого ими сопротивления по отношению к действию кислот и оснований, вводимых в буферный раствор.
Количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора, чтобы значение его pH изменилось на единицу, называют буферной емкостью.
Таким образом, буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добав-
ляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
Уравнение гендерсона для буферного раствора
а) Уравнение Гендерсона-Хассельбаха. Как уже обсуждалось ранее, концентрацию ионов Н+ принято выражать не в абсолютных величинах, а в единицах рН. Напомним, что значение рН представляет собой значение -lg ионов Н+.
Аналогичным способом может быть выражена константа диссоциации: рК = -log К.
Следовательно, концентрацию ионов Н+ в уравнении 4 можно выразить в единицах pH через отрицательный логарифм:
Чтобы не производить вычисления с отрицательным логарифмом, можно изменить его знак, поменяв местами числитель и знаменатель дроби согласно правилам логарифмирования. В результате получим:
Для бикарбонатной буферной системы рК равно 6,1, и уравнение выше может быть преобразовано следующим образом:
Последнее уравнение называют уравнением Гендерсона-Хасселъбаха. С его помощью можно рассчитать рН раствора при условии, если известны значения молярной концентрации HCO3 — и PCO2. Из этого уравнения становится очевидным, что увеличение содержания HCO3 — вызывает повышение рН, приводя к алкалозу.
Увеличение PCO2 снижает рН, смещая кислотно-щелочное равновесие в сторону ацидоза. Уравнение Гендерсона-Хассельбаха, дополнительно определяющее признаки нормального состояния рН и кислотно-щелочного равновесия во внеклеточной жидкости, позволяет понять механизмы физиологической регуляции содержания кислот и оснований во внеклеточной жидкости.
Как будет рассмотрено далее, концентрация бикарбонатов регулируется главным образом почками, тогда как PCO2 во внеклеточной жидкости зависит от вентиляции легких. Усиление легочной вентиляции способствует выведению CO2 из плазмы, при снижении показателей вентиляции легких значение PCO2 возрастает. Гомеостаз кислотно-щелочного состояния поддерживается согласованными действиями обеих систем: выделительной и дыхательной. Повреждение одного или обоих регулирующих механизмов приводит к нарушениям, вследствие которых содержание бикарбонатов или PCO2 во внеклеточной жидкости изменяется.
Нарушения, смещающие кислотно-щелочное равновесие путем изменения содержания бикарбонатов во внеклеточной жидкости, называют метаболическими, поэтому ацидоз, вызванный таким изменением, носит название метаболического ацидоза, а алкалоз, первичной причиной которого является увеличение концентрации ионов бикарбоната, называют метаболическим алкалозом. При увеличении PCO2 возникает дыхательный ацидоз, а при снижении — дыхательный алкалоз.
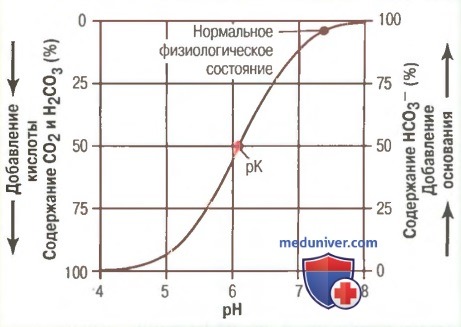
б) Кривая титрования бикарбонатной буферной системы. На рисунке выше показаны сдвиги рН во внеклеточной жидкости в ответ на изменения содержания HCO3 — и CO2 во внеклеточной жидкости. Когда концентрации двух этих компонентов равны, правая часть уравнения Гендерсона-Хасселъбаха становится логарифмом 1, который равен нулю, поэтому величина рН раствора такая же, как и рК (6,1) бикарбонатной буферной системы. При добавлении к ней основания часть растворенного CO2 преобразуется в HCO3 — , увеличивая значение соотношения HCO3 — к CO2 и, соответственно, рН, что становится очевидным из уравнения Гендерсона-Хассельбаха. Добавленная в раствор кислота связывается HCO3 — , который затем преобразуется в растворенный CO2, что уменьшает соотношение между HCO3 — к CO2 и рН внеклеточной жидкости.
в) Буферная емкость раствора определяется суммарной и относительной концентрацией компонентов буферной системы. Особенность расположения ряда точек, изображенных на кривой титрования рисунке, является вполне объяснимой. Во-первых, при условии, когда доля каждого компонента буферного раствора (HCO3 — и CO2) составляет по 50%, рН и рК равны. Во-вторых, буферная система наиболее эффективно действует в центральной части кривой, где рН приближен к рК системы. Это означает, что изменения рН, возникающие в результате добавления к раствору кислот или оснований, в этом диапазоне значений наименьшие. Деятельность буферной системы остается эффективной при отклонениях значений рН в любую сторону в пределах 1, что расширяет границы деятельности буфера от 5,1 до 7,1 единиц. Вне указанных границ буферная емкость быстро снижается. Когда весь CO2 преобразуется в HCO3 — или, наоборот, когда весь HCO3 — преобразуется в CO2, система полностью теряет емкость.
Абсолютная концентрация компонентов буферной системы также является важным показателем, определяющим буферную емкость. При низкой концентрации компонентов буферной системы добавленные даже в небольшом количестве кислоты и щелочи приводят к значительным изменениям рН.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Уравнение Хендерсона-Хассельбаха: объяснение, примеры, упражнения
Уравнение Хендерсона-Хассельбаха: объяснение, примеры, упражнения — Наука
Содержание:
В Уравнение Хендерсона-Хассельбаха представляет собой математическое выражение, позволяющее рассчитать pH буферного раствора или буферного раствора. Он основан на pKa кислоты и соотношении концентраций основания или соли конъюгата и кислоты, присутствующей в буферном растворе.
Уравнение было первоначально разработано Лоуренсом Джозефом Хендерсоном (1878-1942) в 1907 году. Этот химик установил компоненты своего уравнения на основе угольной кислоты в качестве буфера или буфера.
Позже Карл Альберт Хассельбах (1874-1962) ввел в 1917 году использование логарифмов для дополнения уравнения Хендерсона. Датский химик изучал реакции крови с кислородом и влияние на ее pH.
Буферный раствор может минимизировать изменения pH, которым подвергается раствор, путем добавления определенного объема сильной кислоты или сильного основания. Он состоит из слабой кислоты и ее сильного сопряженного основания, которое быстро диссоциирует.
Объяснение
Математическое развитие
Слабая кислота в водном растворе диссоциирует по закону действия масс по следующей схеме:
HA — слабая кислота, а A – его сопряженное основание.
Эта реакция обратима и имеет константу равновесия (Ka):
Ka = [H + ] · [TO – ] / [У НЕГО ЕСТЬ]
журнал Ka = журнал [H + ] + журнал [A – ] — журнал [HA]
Если каждый член уравнения умножить на (-1), он выражается в следующей форме:
— журнал Ka = — журнал [H + ] — журнал [A] + журнал [HA]
— log Ka определяется как pKa, а — log [H + ] определяется как pH. После правильной замены математическое выражение сводится к следующему:
pKa = pH — log [A – ] + журнал [HA]
Решив для pH и перегруппировав члены, уравнение выражается следующим образом:
pH = pKa + log [A – ] / [У НЕГО ЕСТЬ]
Это уравнение Хендерсона-Хассельбаха для слабокислотного буфера.
Уравнение для слабого основания
Точно так же слабое основание может образовывать буферный раствор, и уравнение Хендерсона-Хассельбаха для него выглядит следующим образом:
pOH = pKb + log [HB] / [B – ]
Однако большинство буферов, даже имеющих физиологическое значение, образуются в результате диссоциации слабой кислоты. Поэтому наиболее часто используемым выражением для уравнения Хендерсона-Хассельбаха является:
pH = pKa + log [A – ] / [У НЕГО ЕСТЬ]
Как работает буфер?
Демпфирующее действие
Уравнение Хендерсона-Хассельбаха показывает, что этот раствор состоит из слабой кислоты и сильного сопряженного основания, выраженного в виде соли. Эта композиция позволяет буферу сохранять стабильный pH даже при добавлении сильных кислот или оснований.
Когда в буфер добавляется сильная кислота, она реагирует с основанием конъюгата с образованием соли и воды. Это нейтрализует кислоту и позволяет минимизировать изменение pH.
Теперь, если к буферу добавлено сильное основание, оно вступает в реакцию со слабой кислотой и образует воду и соль, нейтрализуя действие добавленного основания на pH. Таким образом, изменение pH минимально.
PH буферного раствора зависит от соотношения концентраций основания конъюгата и слабой кислоты, а не от абсолютного значения концентраций этих компонентов. Буферный раствор можно разбавить водой, и pH практически не изменится.
Емкость буфера
Буферная способность также зависит от pKa слабой кислоты, а также от концентраций слабой кислоты и конъюгированного основания. Чем ближе к pKa кислоты pH буфера, тем больше его буферная способность.
Также чем выше концентрация компонентов буферного раствора, тем больше его буферная емкость.
Примеры уравнений Хендерсона
Амортизатор из ацетата
pH = pKa + log [CH3COO – ] / [CH3COOH]
Поглотитель угольной кислоты
Однако общий процесс, который приводит к образованию иона бикарбоната в живом организме, выглядит следующим образом:
Быть CO2 газ, его концентрация в растворе выражается как функция его парциального давления.
pH = pka + log [HCO3 – ] / α pCO2
α = 0,03 (ммоль / л) / мм рт.
pCO2 парциальное давление CO2
И тогда уравнение будет выглядеть так:
pH = pKa + log [HCO3 – ] / 0,03 pCO2
Лактатный буфер
pH = pKa + log [лактат-ион] / [молочная кислота]
Фосфатный буфер
pH = pKa + log [двухосновный фосфат] / [одноосновный фосфат]
Оксигемоглобин
Дезоксигемоглобин
pH = pKa + log [Hb – ] / HbH
Решенные упражнения
Упражнение 1
Фосфатный буфер важен для регулирования pH в организме, поскольку его pKa (6,8) близок к существующему pH в организме (7,4). Каким будет значение отношения [Na2HPO4 2- ] / [Неа2PO4 – ] уравнения Хендерсона-Хассельбаха для значения pH = 7,35 и pKa = 6,8?
Реакция диссоциации NaH2PO4 – это:
Решая соотношение [конъюгат основание / кислота] для фосфатного буфера, мы имеем:
10 0,535 = 10 log [Na2HPO4] / [NaH2PO4]
Упражнение 2.
Ацетатный буфер имеет концентрацию уксусной кислоты 0,0135 М и концентрацию ацетата натрия 0,0260 М. Рассчитайте pH буфера, зная, что pKa для ацетатного буфера составляет 4,75.
Равновесие диссоциации для уксусной кислоты:
pH = pKa + log [CH3COO – ] / [CH3COOH]
Подставляя значения, мы имеем:
[CH3COO – ] / [CH3COOH] = 0,0260 М / 0,0135 М
журнал 1.884 = 0.275
Упражнение 3.
Ацетатный буфер содержит 0,1 М уксусную кислоту и 0,1 М ацетат натрия. Рассчитайте pH буфера после добавления 5 мл 0,05 М соляной кислоты к 10 мл предыдущего раствора.
Первый шаг — вычислить конечную концентрацию HCl при смешивании с буфером:
= 5 мл · (0,05 М / 15 мл)
Соляная кислота реагирует с ацетатом натрия с образованием уксусной кислоты. Следовательно, концентрация ацетата натрия уменьшается на 0,017 М, а концентрация уксусной кислоты увеличивается на такую же величину:
pH = pKa + log (0,1 M — 0,017 M) / (0,1 M + 0,017 M)
pH = pKa + log 0,083 / 0,017
Ссылки
- Уиттен, Дэвис, Пек и Стэнли. (2008). Химия. (8-е изд.). CENGAGE Обучение.
- Хименес Варгас и Х. Мо Макарулла. (1984). Физиологическая физико-химия. 6-е издание. От редакции Interamericana.
- Википедия. (2020). Уравнение Хендерсона-Хассельбаха. Получено с: en.wikipedia.org
- Гуриндер Хайра и Александр Кот. (05 июня 2019 г.). Приближение Хендерсона-Хассельбаха. Химия LibreTexts. Получено с: chem.libretexts.org
- Хельменстин, Энн Мари, доктор философии (29 января 2020 г.). Определение уравнения Хендерсона Хассельбаха. Получено с: thinkco.com
- Редакторы Энциклопедии Британника. (6 февраля 2020 г.). Лоуренс Джозеф Хендерсон. Encyclopdia Britannica. Получено с: britannica.com
Глобозиды: строение, биосинтез, функции и патологии
Homo erectus: кем он был и чем отличался от нас?
http://meduniver.com/Medical/Physiology/764.html
http://ru1.warbletoncouncil.org/ecuacion-de-henderson-hasselbalch-10636