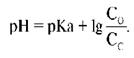Буферные системы, их классификация и механизм действия. Буферные растворы. Уравнение Гендерсона-Гассельбаха.
Буферными системами (буферами) называют растворы, обладающие свойством достаточно, стойко, сохранять постоянство — концентрации водородных ионов как при добавлении кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) из слабой кислоты и ее соли, образованной сильным основанием;
б) из слабого основания и его соли, образованной сильной кислотой.
На практике часто применяют следующие буферные смеси: ацетатный буфер CH3COOH + CH3COONa, бикарбонатный буфер H2CO3+NaHCO3, аммиачный буфер NH4OH +NH4Cl, белковый буфер белок кислота + белок соль, фосфатный буфер NaH2PO4 + Na2 HPO4
Фосфатная буферная смесь состоит из двух солей, одна из которых является однометаллической, а вторая — двухметаллической солью фосфорной кислоты.
Рассмотрим механизм буферного действия. При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СНзСООН); Из уравнения (а), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае НСl заменяется СН3СООН). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н + в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера, (СН3СООН) по реакции нейтрализации. В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей — степени влияющей на реакцию среды. Анионы СНзСОО
, образующиеся при диссоциации этой соли, будут оказывать некоторое Угнетающее действие на диссоциацию уксусной кислоты.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
Примером кислотного буфера может служить ацетатный буферный раствор, содержащий смесь уксусной кислоты и ацетата натрия (СНзСООН + СНзСООNа). При добавлении к такому раствору кислоты она взаимодействует с солью и вытесняет эквивалентное количество слабой кислоты: СНзСООNа + НСl ó СН3СООН + NaСl. В растворе вместо сильной кислоты образуется слабая, и поэтому величина рН уменьшается незначительно. Если к этому буферному раствору добавить щелочь, она нейтрализуется слабой кислотой, и в растворе образуется эквивалентное количество соли: СНзСООН + NaОН ó СНзСООNа + Н2О. В результате рН почти не увеличивается. Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга. Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты: СНзСООNа -> Na + + СН3СОО
СНзСОО — + НОН ó СНзСООН + ОН — . Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени: СНзСООН ó СН3СОО+H — Слабая диссоциация СНзСООН еще более подавляется в при-сутствии СНзСООNа, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:[СНзСООН] = сr. C другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты: [СНзСОО] = сс. Это уравнение называют уравнением буферного раствора (уравнением Гендерсона Гассельбаха). Его анализ для буферного раствора, образованного слабой кислотой и ее солью, показывает, что концентрация водородных ионов в буферном растворе определяется константой диссоциации слабой кислоты и соотношением концентраций кислоты и соли. Уравнение Гендерсона-Хассельбаха для буферных систем основного типа:
31.Емкость буферных растворов и факторы, определяющие её. Буферные системы крови. Водородкарбонатный буфер. Фосфатный буфер.
Буферной емкостью (В) называется количество сильной кислоты или сильного основания, которое нужно прибавить к одному литру буферного раствора, чтобы изменить его рН на единицу. Она выражается в моль/л или чаще в ммоль/л и определяется по формуле: В = (c V) / д pH Vб , где В — буферная емкость; с — концентрация сильной кислоты или основания (моль/л); V — объем добавленного сильного электролита (л); Vб — объем буферного раствора (л); д рН — изменение рН.
Способность растворов поддерживать постоянное значение pH небезгранична. Буферные смеси можно различить по силе оказываемого ими сопротивления по отношению к действию кислот и оснований, вводимых в буферный раствор.
Количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора, чтобы значение его pH изменилось на единицу, называют буферной емкостью.
Таким образом, буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добав-
ляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
Механизм действия фосфатного буфера.Уравнение Гендерсона-Гассельбаха
Буферные системы
буферные системы образованы буферными растворами
буферные – растворы, рН которых почти не меняется
при разбавлении или добавлении небольших количеств к-ты или основания
ПР: ацетатный СН3СООН + СН3СООNa
согласно протонной теории буферные системы — сопряженные кислотно-основные пары B/BH + и НА/А —

основание сопряженная к-та к-та сопряженное основание
в живых организмах буферные системы поддерживают кислотно-основный гомеостаз
кислотно-основный гомеостаз — кислотно-основное равновесие внутренней среды организма
рН внутренней среды организма должен быть оптимальным для биохимических реакций
для человека физиологическое значение pH=7,4
кислотно-основное равновесие поддерживают буферные свойства крови и механизмы коррекции
62)Классификация буферных систем.
буферные системы различают по компонентам:
— слабая кислота и ее соль, образованная сильным основанием – буферная система кислотного типа
ПР: ацетатный буфер СН3СООН + СН3СООNa
по теории Берстреда буферная система кислотного типа — сопряженная кислотно-основная пара НА/А —
ПР: ацетатный буфер СН3СООН/СН3СОО —
— слабое основание и его соль, образованная сильной кислотой – буферная система основного типа
ПР: аммиачный буфер NН4ОН + NH4Cl
по теории Берстреда буферная система основного типа — сопряженная кислотно-основная пара B/BH +
— соли слабых многоосновных кислот – буферная система кислотного типа
по теории Берстреда буферная система кислотного типа — сопряженная кислотно-основная пара НА/А —
ПР: фосфатный буфер H2PO — /HPO4 2-
— амфолиты – буферная система кислотного типа
ПР: аминокислотный буфер
63)Механизм действия ацетатного буфера.
ацетатный буфер состоит из уксусной кислоты СН3СООН и ацетата натрия СН3СООNa
— уксусная кислота – слабый электролит
 | |
 |  |
где Ка=1,85×10 -5 — коэффициент диссоциации уксусной кислоты
— ацетат натрия – сильный электролит
ацетат натрия увеличивает концентрацию аниона СН3СОО —
равновесие реакции СН3СООН Û СН3СОО — + Н + смещается влево
диссоциация уксусной кислоты тормозится
практически, анион СН3СОО — образуется только путем диссоциации ацетата натрия СН3СООNa
молярная концентрация аниона СН3СОО — равна молярной концентрации соли [СН3СОО — ]=[СН3СООNa]

 |
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности уксусной кислоты
— при разбавлении ацетатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН ацетатного буфера сохранится
— при добавлении кислоты идет реакция кислоты и ацетата натрия
СН3СОО — + Na + + H + + Cl — ® СН3СООH + Na + + Cl —
катионы водорода H + связываются анионами уксусной кислоты СН3СОО — + H + ® СН3СООH
рН ацетатного буфера изменится за счет увеличения концентрации уксусной кислоты и уменьшения соли
механизм изменения рН:
*хотя образуется избыток уксусной кислоты СН3СООH и равновесие реакции СН3СООН Û СН3СОО — + Н + смещается вправо,
но по закону Освальда повышение концентрации СН3СООH снижает степень ее диссоциации,
и концентрация катионов водорода H + увеличивается незначительно,
поэтому при добавлении кислоты рН ацетатного буфера, практически, не изменится
— при добавлении основания идет реакция основания и уксусной кислоты
СН3СООH + Na + + ОН — ® СН3СОО — + Na + + Н2О
гидроксид-ионы ОH — связываются катионами водорода уксусной кислоты ОН — + H + ® Н2О
рН ацетатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
механизм изменения рН:
*хотя образуется избыток аниона уксусной кислоты СН3СОО — и
равновесие реакции СН3СООН Û СН3СОО — + Н + смещается влево,
но по закону Освальда снижение концентрации СН3СООH повышает степень ее диссоциации,
и концентрация катионов водорода H + уменьшается незначительно,
*хотя уксусная кислота расходуется,
но диссоциируют на катионы водорода H + только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН ацетатного буфера, практически, не изменится
— при добавлении небольших количеств кислот-щелочей изменение рН ацетатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН ацетатного буфера значительно
Механизм действия фосфатного буфера.Уравнение Гендерсона-Гассельбаха.
фосфатный буфер состоит из солей ортофосфорной кислоты: однозамещенной NaH2PO4 и двузамещенной Na2HPO4
— соли ортофосфорной кислоты – сильные электролиты
Na2HPO4® NaHPO4 — + Na + NaHPO4 — ® HPO4 2- + Na + HPO4 2- Û PO4 3- + Н + (эта стадия практически, не идет)
важно, что H2PO4 — — слабая кислота и слабый электролит, NaHPO4 — — сильный электролит


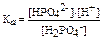
где Ка — коэффициент диссоциации кислоты H2PO4 —
— NaHPO4 — — сильный электролит
NaHPO4 — увеличивает концентрацию аниона HPO4 2-
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается влево
диссоциация H2PO4 — тормозится
практически, анион HPO4 2- образуется только путем диссоциации NaHPO4 —
молярная концентрация аниона HPO4 2- равна молярной концентрации соли [HPO4 2- ]=[NaHPO4 — ]
— рН фосфатного буфера определяет Ка и соотношение концентрации H2PO4 — и NaHPO4 —
 |
 |
 |
 |
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности кислоты H2PO4 —
— при разбавлении фосфатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН фосфатного буфера сохранится
— при добавлении кислоты идет реакция кислоты и NaHPO4 —
HPO4 2- + Na + + H + + Cl — ® H2PO4 — + Na + + Cl —
катионы водорода H + связываются анионами HPO4 2- + H + ® H2PO4 —
рН фосфатного буфера изменится за счет увеличения концентрации H2PO4 — и уменьшения HPO4 2-
механизм изменения рН:
*хотя образуется избыток H2PO4 — и
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается вправо,
но по закону Освальда повышение концентрации H2PO4 — снижает степень ее диссоциации,
и концентрация катионов водорода H + увеличивается незначительно,
поэтому при добавлении кислоты рН фосфатного буфера, практически, не изменится
— при добавлении основания идет реакция основания и H2PO4 —
гидроксид-ионы ОH — связываются катионами водорода ОН — + H + ® Н2О
рН фосфатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
механизм изменения рН:
*хотя образуется избыток аниона HPO4 2- и
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается влево,
но по закону Освальда снижение концентрации HPO4 2- повышает степень ее диссоциации,
и концентрация катионов водорода H + уменьшается незначительно,
*хотя HPO4 2- расходуется,
но диссоциируют на катионы водорода H + только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН фосфатного буфера, практически, не изменится
— при добавлении небольших количеств кислот-щелочей изменение рН фосфатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН фосфатного буфера значительно
Уравнение Хендерсона-Хассельбаха: объяснение, примеры, упражнения
Уравнение Хендерсона-Хассельбаха: объяснение, примеры, упражнения — Наука
Содержание:
В Уравнение Хендерсона-Хассельбаха представляет собой математическое выражение, позволяющее рассчитать pH буферного раствора или буферного раствора. Он основан на pKa кислоты и соотношении концентраций основания или соли конъюгата и кислоты, присутствующей в буферном растворе.
Уравнение было первоначально разработано Лоуренсом Джозефом Хендерсоном (1878-1942) в 1907 году. Этот химик установил компоненты своего уравнения на основе угольной кислоты в качестве буфера или буфера.
Позже Карл Альберт Хассельбах (1874-1962) ввел в 1917 году использование логарифмов для дополнения уравнения Хендерсона. Датский химик изучал реакции крови с кислородом и влияние на ее pH.
Буферный раствор может минимизировать изменения pH, которым подвергается раствор, путем добавления определенного объема сильной кислоты или сильного основания. Он состоит из слабой кислоты и ее сильного сопряженного основания, которое быстро диссоциирует.
Объяснение
Математическое развитие
Слабая кислота в водном растворе диссоциирует по закону действия масс по следующей схеме:
HA — слабая кислота, а A – его сопряженное основание.
Эта реакция обратима и имеет константу равновесия (Ka):
Ka = [H + ] · [TO – ] / [У НЕГО ЕСТЬ]
журнал Ka = журнал [H + ] + журнал [A – ] — журнал [HA]
Если каждый член уравнения умножить на (-1), он выражается в следующей форме:
— журнал Ka = — журнал [H + ] — журнал [A] + журнал [HA]
— log Ka определяется как pKa, а — log [H + ] определяется как pH. После правильной замены математическое выражение сводится к следующему:
pKa = pH — log [A – ] + журнал [HA]
Решив для pH и перегруппировав члены, уравнение выражается следующим образом:
pH = pKa + log [A – ] / [У НЕГО ЕСТЬ]
Это уравнение Хендерсона-Хассельбаха для слабокислотного буфера.
Уравнение для слабого основания
Точно так же слабое основание может образовывать буферный раствор, и уравнение Хендерсона-Хассельбаха для него выглядит следующим образом:
pOH = pKb + log [HB] / [B – ]
Однако большинство буферов, даже имеющих физиологическое значение, образуются в результате диссоциации слабой кислоты. Поэтому наиболее часто используемым выражением для уравнения Хендерсона-Хассельбаха является:
pH = pKa + log [A – ] / [У НЕГО ЕСТЬ]
Как работает буфер?
Демпфирующее действие
Уравнение Хендерсона-Хассельбаха показывает, что этот раствор состоит из слабой кислоты и сильного сопряженного основания, выраженного в виде соли. Эта композиция позволяет буферу сохранять стабильный pH даже при добавлении сильных кислот или оснований.
Когда в буфер добавляется сильная кислота, она реагирует с основанием конъюгата с образованием соли и воды. Это нейтрализует кислоту и позволяет минимизировать изменение pH.
Теперь, если к буферу добавлено сильное основание, оно вступает в реакцию со слабой кислотой и образует воду и соль, нейтрализуя действие добавленного основания на pH. Таким образом, изменение pH минимально.
PH буферного раствора зависит от соотношения концентраций основания конъюгата и слабой кислоты, а не от абсолютного значения концентраций этих компонентов. Буферный раствор можно разбавить водой, и pH практически не изменится.
Емкость буфера
Буферная способность также зависит от pKa слабой кислоты, а также от концентраций слабой кислоты и конъюгированного основания. Чем ближе к pKa кислоты pH буфера, тем больше его буферная способность.
Также чем выше концентрация компонентов буферного раствора, тем больше его буферная емкость.
Примеры уравнений Хендерсона
Амортизатор из ацетата
pH = pKa + log [CH3COO – ] / [CH3COOH]
Поглотитель угольной кислоты
Однако общий процесс, который приводит к образованию иона бикарбоната в живом организме, выглядит следующим образом:
Быть CO2 газ, его концентрация в растворе выражается как функция его парциального давления.
pH = pka + log [HCO3 – ] / α pCO2
α = 0,03 (ммоль / л) / мм рт.
pCO2 парциальное давление CO2
И тогда уравнение будет выглядеть так:
pH = pKa + log [HCO3 – ] / 0,03 pCO2
Лактатный буфер
pH = pKa + log [лактат-ион] / [молочная кислота]
Фосфатный буфер
pH = pKa + log [двухосновный фосфат] / [одноосновный фосфат]
Оксигемоглобин
Дезоксигемоглобин
pH = pKa + log [Hb – ] / HbH
Решенные упражнения
Упражнение 1
Фосфатный буфер важен для регулирования pH в организме, поскольку его pKa (6,8) близок к существующему pH в организме (7,4). Каким будет значение отношения [Na2HPO4 2- ] / [Неа2PO4 – ] уравнения Хендерсона-Хассельбаха для значения pH = 7,35 и pKa = 6,8?
Реакция диссоциации NaH2PO4 – это:
Решая соотношение [конъюгат основание / кислота] для фосфатного буфера, мы имеем:
10 0,535 = 10 log [Na2HPO4] / [NaH2PO4]
Упражнение 2.
Ацетатный буфер имеет концентрацию уксусной кислоты 0,0135 М и концентрацию ацетата натрия 0,0260 М. Рассчитайте pH буфера, зная, что pKa для ацетатного буфера составляет 4,75.
Равновесие диссоциации для уксусной кислоты:
pH = pKa + log [CH3COO – ] / [CH3COOH]
Подставляя значения, мы имеем:
[CH3COO – ] / [CH3COOH] = 0,0260 М / 0,0135 М
журнал 1.884 = 0.275
Упражнение 3.
Ацетатный буфер содержит 0,1 М уксусную кислоту и 0,1 М ацетат натрия. Рассчитайте pH буфера после добавления 5 мл 0,05 М соляной кислоты к 10 мл предыдущего раствора.
Первый шаг — вычислить конечную концентрацию HCl при смешивании с буфером:
= 5 мл · (0,05 М / 15 мл)
Соляная кислота реагирует с ацетатом натрия с образованием уксусной кислоты. Следовательно, концентрация ацетата натрия уменьшается на 0,017 М, а концентрация уксусной кислоты увеличивается на такую же величину:
pH = pKa + log (0,1 M — 0,017 M) / (0,1 M + 0,017 M)
pH = pKa + log 0,083 / 0,017
Ссылки
- Уиттен, Дэвис, Пек и Стэнли. (2008). Химия. (8-е изд.). CENGAGE Обучение.
- Хименес Варгас и Х. Мо Макарулла. (1984). Физиологическая физико-химия. 6-е издание. От редакции Interamericana.
- Википедия. (2020). Уравнение Хендерсона-Хассельбаха. Получено с: en.wikipedia.org
- Гуриндер Хайра и Александр Кот. (05 июня 2019 г.). Приближение Хендерсона-Хассельбаха. Химия LibreTexts. Получено с: chem.libretexts.org
- Хельменстин, Энн Мари, доктор философии (29 января 2020 г.). Определение уравнения Хендерсона Хассельбаха. Получено с: thinkco.com
- Редакторы Энциклопедии Британника. (6 февраля 2020 г.). Лоуренс Джозеф Хендерсон. Encyclopdia Britannica. Получено с: britannica.com
Как мотивировать команду на работе: 8 советов
Псилоцибе: характеристика, размножение, питание, примеры
http://megaobuchalka.ru/1/4818.html
http://ru1.warbletoncouncil.org/ecuacion-de-henderson-hasselbalch-10636