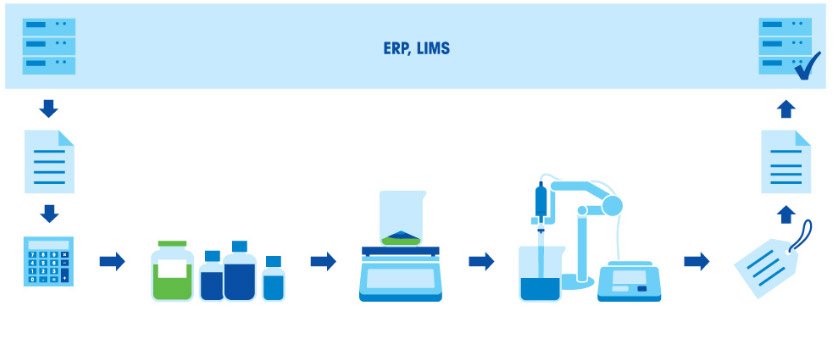
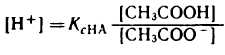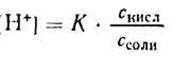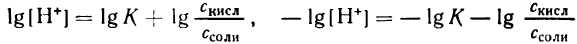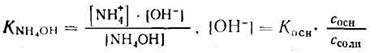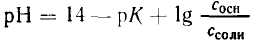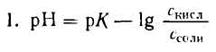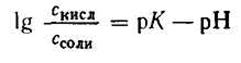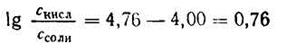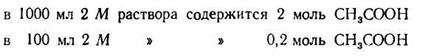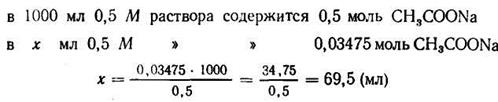Приготовление буферных растворов
Почему точность взвешивания так важна для качества буферного раствора?
Приготовление буферных растворов — распространенная процедура в химических и биохимических лабораториях. Буферный раствор — это смесь слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты. Буферные растворы позволяют поддерживать стабильный уровень pH другого раствора, смешанного с буферным. Если в раствор попадает небольшое количество другой кислоты или щелочи или они образуются в ходе химической реакции, буферный раствор не допустит изменения значения pH всего раствора. Поэтому буферы очень полезны в разных задачах, где требуется поддержание стабильного уровня pH. Другие названия буферных растворов — также pH-буферы, водород-ионные буферы или просто буферы.
Например, в крови человека содержатся естественные буферы для поддержания рН в диапазоне от 7,35 до 7,45 — именно при таком уровне могут нормально действовать энзимы. Поскольку активность энзимов зависит от pH, при проведении биохимических анализов необходимо поддержание этого параметра на постоянном уровне. Буферные растворы применяются в шампунях для предотвращения раздражения кожи, в детских лосьонах для противодействия росту бактерий, а также в растворах для контактных линз, чтобы уровень pH жидкости оставался совместимым с уровнем рН глаз.
Приготовление буферного раствора состоит из нескольких этапов: взвешивание компонентов, растворение компонентов, корректировка pH и дополнение до заданного объема. Поскольку итоговое значение pH в буфере зависит от соотношения кислоты и основания, чрезвычайно важно взвешивать компоненты с высокой точностью. Все используемое оборудование (весы, пипетки и рН-метр) должно быть правильно откалибровано и иметь достаточную точность.
Buffer Preparation
Видео: приготовление буферного раствора — простота, удобство и точность
Для приготовления буферного раствора нужны время и особая тщательность, иначе раствор не будет действовать так, как требуется. Если качество продукции или биохимических анализов зависит от качества буферных растворов, ошибки при приготовлении буферов недопустимы.
Посмотрите видео и узнайте, как можно сэкономить время и силы, если готовить буферные растворы с помощью технических весов и рН-метров МЕТТЛЕР ТОЛЕДО.
Перейдите в один из следующих разделов, чтобы узнать больше:
Как готовить буферные растворы? Стандартная процедура
Приготовление буферного раствора состоит из нескольких этапов: расчет концентрации и количества компонентов в соответствии с назначением и нужным объемом раствора; взвешивание компонентов; растворение компонентов; корректировка pH; дополнение до заданного объема; маркировка и документирование; использование раствора или его сохранение для применения в будущем.
- Выберите рецептуру из базы данных.
- Рассчитайте количество компонентов, указанных в рецептуре, в соответствии с требуемым объемом буферного раствора.
- Взвесьте компоненты и поместите их в сосуд.
- Растворите компоненты в подходящем растворителе (обычно в воде).
- С помощью рН-метра проверьте и скорректируйте значение pH.
- Долейте раствор до необходимого объема.
- Переместите раствор в бутыль для хранения и нанесите на нее соответствующую маркировку.
- Задокументируйте результаты.
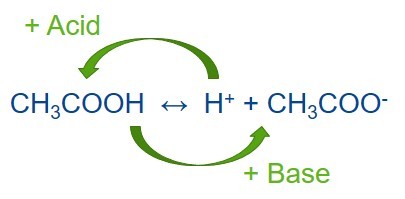
Буферный раствор — это раствор, сохраняющий свой показатель pH при добавлении небольшого количества кислоты или основания. Буферный раствор состоит из слабой кислоты и сопряженного с ней основания. Постоянный уровень pH в буферном растворе поддерживается благодаря поглощению протонов, которые высвобождаются в ходе реакции, или высвобождению протонов, если в ходе реакции они поглощаются. К созданию буферных растворов привело открытие того, что частично нейтрализованные растворы слабых кислот или оснований не меняют pH при добавлении к ним небольшого количества сильной кислоты или основания.
Сопряженное основание — это кислота, потерявшая протон.
HA ↔ H + + A —
Кислота ↔ протон + сопряженное основание
Сопряженная кислота — это основание, которое приобрело протон.
A + H + ↔ H + A
Основание + протон ↔ сопряженная кислота
Так устанавливается равновесие между диссоциированной и недиссоциированной формами.
Например, слабая уксусная кислота частично диссоциирует в воде, образуя ацетат-ион:
CH3COOH ↔ H + + CH3COO -.
Недиссоциированная уксусная кислота, ионы водорода и диссоциированный ион находятся в растворе в равновесии.
Ацетат натрия также диссоциирует в воде с образованием такого же ацетат-иона:
CH3COONa ↔ Na + + CH3COO -.
Недиссоциированный ацетат натрия, а также ионы натрия и ацетата находятся в растворе в равновесии.
Водный раствор смеси уксусной кислоты и ацетата натрия поэтому может поглощать ионы H + , добавляемые с кислотой, присоединяя ионы водорода к ацетатному основанию и образуя уксусную кислоту. Когда же в раствор попадают ионы OH — из-за добавления щелочи, они соединяются с молекулами кислоты (H + ) и образуют воду. Таким образом система пытается восстановить равновесие, и pH раствора остается на одном уровне. Так проявляется буферное действие раствора.
Что происходит после добавления кислоты в буферный раствор?
Когда к равновесной смеси слабой кислоты и ее сопряженного основания добавляется сильная кислота (с большим количеством H+), точка равновесия смещается влево в соответствии с принципом Ле Шателье.
Что происходит после добавления основания в буферный раствор?
Аналогичным образом, если в смесь добавляется сильное основание, то концентрация ионов водорода снижается меньше, чем ожидалось с учетом количества добавляемого основания. Это происходит потому, что точка равновесия смещается вправо, чтобы компенсировать потерю H + в реакции с основанием.
Разновидности буферных растворов
Буферные растворы, состоящие из слабой кислоты и ее сопряженного основания, считаются кислыми и имеют рН 7. Примером щелочного буфера может служить водный раствор гидроксида аммония (слабое основание) и хлорида аммония (сопряженная кислота), имеющий рН 9,25.
На что следует обращать внимание при приготовлении буферного раствора
Буферы работают наиболее эффективно, если их pH примерно равен pH исследуемой системы или раствора. При изучении энзимов в биологии человека необходима система, соответствующая pH крови (7,35–7,45), в противном случае энзимы будут функционировать неправильно. Если у буферной системы pH выходит за пределы требуемого диапазона, это также отрицательно повлияет на анализ.
Поэтому необходимо знать, как приготовить буферные растворы с заданным pH. Это можно сделать несколькими способами:
- Корректировка pH
Сначала кристаллическая кислота или основание растворяется в объеме воды, равном примерно 60–70 % от требуемого конечного объема буферного раствора. Показатель pH проверяется, а затем корректируется. Если используется кристаллическая кислота, то для коррекции pH применяют основание, не выделяющее ионы, способные нарушить параметры исследуемой системы. Если используется кристаллическое основание, то рН корректируется с помощью подходящей кислоты. После достижения требуемого pH в буферный раствор можно долить воду, чтобы получить нужный объем.
Смешивание с раствором кислоты или основания
В этом методе раствор кислоты или основания смешивается с раствором соответствующей соли. Концентрация исходных растворов должна быть такой же, как и у целевого буфера. Соотношения смешиваемых растворов можно менять, чтобы получить различные значения pH итогового буфера. Можно также следить за изменением рН при добавлении одного раствора к другому.
Уравнение Гендерсона — Гассельбаха.
Оценить pH буферного раствора можно по уравнению Гендерсона — Гассельбаха с помощью константы диссоциации pKa. Если слабая кислота (HA), находящаяся в растворе, диссоциирует на ионы водорода (H + ) и достигает равновесия с сопряженным основанием (A — ), константа диссоциации покажет силу кислоты в этой точке равновесия. Уравнение Гендерсона — Гассельбаха выглядит следующим образом:
где pKa — константа диссоциации слабой кислоты;
[A-] — концентрация сопряженного основания в точке равновесия;
[HA] — концентрация кислоты в точке равновесия.
Если в точке равновесия концентрации сопряженного основания и кислоты одинаковы, то pH равно константе диссоциации. В этой точке буферный раствор обладает максимальной буферной емкостью.
Уравнение Гендерсона — Гассельбаха также используется для определения константы диссоциации слабых кислот посредством прямых измерений pH.
Преимущества универсальных буферных растворов
Универсальные буферные растворы состоят из нескольких комбинаций кислотно-основных пар. Это позволяет использовать универсальные буферные растворы для поддержания уровня pH раствора в более широком диапазоне и, следовательно, в более широком круге задач.
Дополнительные советы по приготовлению и использованию буферных растворов
- Разработайте стандартную операционную процедуру.
Полезно задокументировать процедуру приготовления буферного раствора и следить за ее соблюдением всеми сотрудниками. Это обеспечит стабильность и воспроизводимость. В СОП должны быть указаны подробные данные об используемых материалах и точно описаны действия по добавлению компонентов и измерению pH. В СОП можно также включить многие из приведенных далее рекомендаций.
- Используйте средства индивидуальной защиты.
Необходимо использовать соответствующие средства индивидуальной защиты (СИЗ), например защитные очки и одежду, особенно при работе с сильными кислотами или основаниями.
- Проверяйте наличие микробиологических загрязнений (особенно при работе с биологическими препаратами).
Перед использованием буферного раствора проверьте емкость на предмет микробиологических загрязнений. Микробиологические загрязнения особенно часто появляются в буферных растворах с рН, близким к нейтральному. Видимые признаки — некоторое помутнение раствора или осадок на дне.
- Правильно работайте с pH-метром.
Чтобы измерения pH были точными, pH-метры нужно регулярно калибровать и поддерживать в рабочем состоянии. Перед использованием электрод должен быть надлежащим образом подготовлен и заправлен достаточным количеством буферного раствора, чтобы диафрагма электрода была полностью в него погружена. Прежде чем снимать показания, обязательно дождитесь стабилизации значения pH, а после измерения промойте электрод дистиллированной водой. Проводите измерения рН-метром только при комнатной температуре или используйте электрод со встроенным датчиком температуры.
- Учитывайте температуру.
Диссоциация может зависеть от температуры. Буферный раствор необходимо готовить при той же температуре, при которой будет проходить анализ. Убедитесь также, что электрод был откалиброван при той же температуре, при которой проводятся измерения.
- Следите за концентрацией.
Буферные растворы часто разбавляют до концентрации, которая требуется для выполнения анализа. Однако изменение концентрации может повлиять на уровень диссоциации. Поскольку pH отражает концентрацию ионов водорода (H + ), изменение уровня диссоциации может привести к изменению pH. После разбавления уровень рН буферного раствора следует проверить еще раз.
Уравнение гендерсона гассельбаха для аммиачного буфера
а) Уравнение Гендерсона-Хассельбаха. Как уже обсуждалось ранее, концентрацию ионов Н+ принято выражать не в абсолютных величинах, а в единицах рН. Напомним, что значение рН представляет собой значение -lg ионов Н+.
Аналогичным способом может быть выражена константа диссоциации: рК = -log К.
Следовательно, концентрацию ионов Н+ в уравнении 4 можно выразить в единицах pH через отрицательный логарифм:
Чтобы не производить вычисления с отрицательным логарифмом, можно изменить его знак, поменяв местами числитель и знаменатель дроби согласно правилам логарифмирования. В результате получим:
Для бикарбонатной буферной системы рК равно 6,1, и уравнение выше может быть преобразовано следующим образом:
Последнее уравнение называют уравнением Гендерсона-Хасселъбаха. С его помощью можно рассчитать рН раствора при условии, если известны значения молярной концентрации HCO3 — и PCO2. Из этого уравнения становится очевидным, что увеличение содержания HCO3 — вызывает повышение рН, приводя к алкалозу.
Увеличение PCO2 снижает рН, смещая кислотно-щелочное равновесие в сторону ацидоза. Уравнение Гендерсона-Хассельбаха, дополнительно определяющее признаки нормального состояния рН и кислотно-щелочного равновесия во внеклеточной жидкости, позволяет понять механизмы физиологической регуляции содержания кислот и оснований во внеклеточной жидкости.
Как будет рассмотрено далее, концентрация бикарбонатов регулируется главным образом почками, тогда как PCO2 во внеклеточной жидкости зависит от вентиляции легких. Усиление легочной вентиляции способствует выведению CO2 из плазмы, при снижении показателей вентиляции легких значение PCO2 возрастает. Гомеостаз кислотно-щелочного состояния поддерживается согласованными действиями обеих систем: выделительной и дыхательной. Повреждение одного или обоих регулирующих механизмов приводит к нарушениям, вследствие которых содержание бикарбонатов или PCO2 во внеклеточной жидкости изменяется.
Нарушения, смещающие кислотно-щелочное равновесие путем изменения содержания бикарбонатов во внеклеточной жидкости, называют метаболическими, поэтому ацидоз, вызванный таким изменением, носит название метаболического ацидоза, а алкалоз, первичной причиной которого является увеличение концентрации ионов бикарбоната, называют метаболическим алкалозом. При увеличении PCO2 возникает дыхательный ацидоз, а при снижении — дыхательный алкалоз.
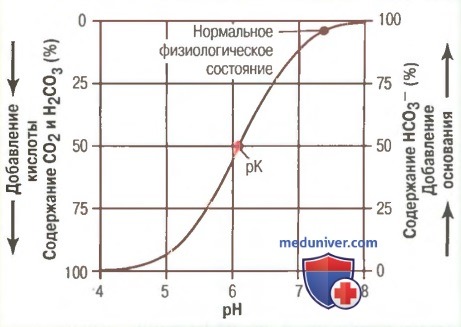
б) Кривая титрования бикарбонатной буферной системы. На рисунке выше показаны сдвиги рН во внеклеточной жидкости в ответ на изменения содержания HCO3 — и CO2 во внеклеточной жидкости. Когда концентрации двух этих компонентов равны, правая часть уравнения Гендерсона-Хасселъбаха становится логарифмом 1, который равен нулю, поэтому величина рН раствора такая же, как и рК (6,1) бикарбонатной буферной системы. При добавлении к ней основания часть растворенного CO2 преобразуется в HCO3 — , увеличивая значение соотношения HCO3 — к CO2 и, соответственно, рН, что становится очевидным из уравнения Гендерсона-Хассельбаха. Добавленная в раствор кислота связывается HCO3 — , который затем преобразуется в растворенный CO2, что уменьшает соотношение между HCO3 — к CO2 и рН внеклеточной жидкости.
в) Буферная емкость раствора определяется суммарной и относительной концентрацией компонентов буферной системы. Особенность расположения ряда точек, изображенных на кривой титрования рисунке, является вполне объяснимой. Во-первых, при условии, когда доля каждого компонента буферного раствора (HCO3 — и CO2) составляет по 50%, рН и рК равны. Во-вторых, буферная система наиболее эффективно действует в центральной части кривой, где рН приближен к рК системы. Это означает, что изменения рН, возникающие в результате добавления к раствору кислот или оснований, в этом диапазоне значений наименьшие. Деятельность буферной системы остается эффективной при отклонениях значений рН в любую сторону в пределах 1, что расширяет границы деятельности буфера от 5,1 до 7,1 единиц. Вне указанных границ буферная емкость быстро снижается. Когда весь CO2 преобразуется в HCO3 — или, наоборот, когда весь HCO3 — преобразуется в CO2, система полностью теряет емкость.
Абсолютная концентрация компонентов буферной системы также является важным показателем, определяющим буферную емкость. При низкой концентрации компонентов буферной системы добавленные даже в небольшом количестве кислоты и щелочи приводят к значительным изменениям рН.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Вычисление рН буферных растворов Уравнение Гендерсона -Хассельбаха
1) Аналитическое выражение для расчета рН буферного раствора, например, ацетатного буфера можно получить из уравнения для константы диссоциации (к реакциям диссоциации применим закон действующих масс).
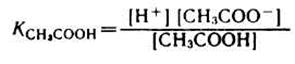
разрешив его относительно концентрации ионов водорода [H + ] можно написать:
Уксусная кислотаприсутствует в растворе в смеси с CH3COONa в виде неионизированных молекул. Поэтому концентрацию молекул можно принять равной общей молярной концентрации кислоты в растворе, т. е. [СН3СООН] = Скисл. Концентрацию анионов уксусной кислоты можно принять равной концентрации соли, т. е. [СН3СОО — ] = Ссоли, так как CH3COONa— сильный электролит, диссоциирующий в растворе на 100%. Приняв эти упрощения, получим:
2. Логарифмируя полученное уравнение и заменяя знаки логарифмов на обратные, получаем:
но – Ig [Н + ] есть рН, а – Ig К есть рК — силовой показатель кислоты.
С учетом этого получим:
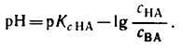
Если при приготовлении буферной системы взять одинаковые концентрации кислоты и соли, то концентрация ионов водорода в таком растворе будет равна константе ионизации кислоты, так как отношение Скис/Ссоли = 1 и [Н + ]=К1, т.е. [Н + ]=К, поэтому рН=рК.
Аналогично для систем NH4OH + NH4C1получают выражения:
1. Запишем уравнение константы ионизации NH4OH и найдем [ОН — ]:
2. Отсюда находим:
Зная, что рН + рОН = 14, получим:
Задача 1. Сколько 0,5 М раствора CH3COONa нужно прибавить к 100 мл 2М раствора СН3СООН, чтобы получить буферный раствор с рН=4?
Откуда
Подставляем числовые данные и получаем:
Число Ig 0,76 = 5,754. Следовательно, отношение концентрации кислоты к концентрации соли должно быть равно 5,754 : 1.
2. Находим концентрацию кислоты в буферной системе:
3. Зная концентрацию кислоты, находим концентрацию солив буферной системе; она должна быть равна 0,2:5,754= 0,03475 (моль).
4. Находим количество 0,5 М раствора ацетата натрия, содержащего 0,03475 моль:
Задача 2.Вычислить рН аммиачной буферной системы, содержащей по 0,5 М NH4ОН и NH4C1. Как изменится рН при добавлении к 1 л этой смеси 0,1 М НС1 и при добавлении к 1 л этой смеси 0,1 М NaOH и при разбавлении раствора водой в 10 раз, если рК (NH4ОН) =4,75?
Дата добавления: 2015-08-08 ; просмотров: 10286 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://meduniver.com/Medical/Physiology/764.html
http://helpiks.org/4-60678.html