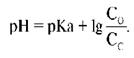Мои таблетки
Бикарбонатная буферная система – это гомеостатический кислотно-щелочной механизм, буферная система, представляющая собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты (H2CO3) в качестве донора протонов (H + ) и бикарбонат (гидрокарбонат) – аниона (HCO3 W22, ) в качестве их акцептора.
Бикарбонатная буферная система – наиболее управляемая система внеклеточной жидкости и крови, играющая важную роль в поддержании постоянства pH [1] жидкостей организма животных, являющаяся важнейшей буферной системой крови [2] , тканевой жидкости и лимфы [3] . Бикарбонатная буферная система также необходима для буферирования внутриклеточной жидкости [4] .
Механизм действия
Бикарбонатная буферная система несколько сложнее других буферных систем, состоящих из пары слабая кислота / сопряженное основание, поскольку один из ее компонентов – угольная кислота – образуется в обратимой реакции с выделением углекислого газа, растворенного в плазме крови [5] . Концентрация последнего, в свою очередь, зависит от парциального давления CO2 в газовой фазе, с которой кровь взаимодействует (в альвеолярном воздухе [6] ). Таким образом, pH бикарбонатной буферной системы зависит от трех равноважных процессов.
Уравнение 1. Диссоциации угольной кислоты.
Уравнение 2. Образование угольной кислоты из воды и растворенного углекислого газа CO2 (d).
Уравнение 3. Растворение углекислого газа из газовой фазы CO2 (g) в плазме крови.
Если концентрация ионов H + в крови увеличивается (например, вследствие выделения лактата [7] мышцами), равновесие уравнения 1 смещается в сторону образования угольной кислоты, что, в свою очередь, приводит к повышению содержания растворенного углекислого газа (уравнение 2) и, наконец, к увеличению парциального давления CO2 в легких (уравнение 3). Лишний оксид углерода при этом выдыхается. Если pH крови повышается (например, вследствие образования NH3 во время катаболизма белков [8] ), происходит обратный процесс: больше угольной кислоты распадается до бикарбоната, и, соответственно, больше углекислого газа растворяется в плазме крови.
Частота и глубина дыхания регулируется центром в стволе головного мозга, который получает информацию о концентрации углекислого газа в крови и ее кислотность. Снижение pH и увеличение парциального давления p (CO2) стимулирует ускорение газообмена в легких.
Вычисление pH буферной системы
Зона буферирования для пары слабая кислота / сопряженное основание (то есть диапазон pH, в котором такая буферная система может эффективно работать), рассчитывается как pKa±1 [9] .
Отрицательный логарифм константы кислотной диссоциации для угольной кислоты Ka = 3,57 при 37 ° C. При физиологических условиях, концентрация H2CO3 (приблизительно 1 мМ [10] ) существенно ниже, чем концентрация HCO–3 (24-25 мМ), поэтому такая система должна быть очень эффективной в предотвращении снижению pH, но при выделении в кровь щелочных веществ, ее буферная емкость должна быстро исчерпываться. Однако, поскольку кровь постоянно взаимодействует с большой резервной емкостью углекислого газа в воздухе легких, бикарбонатная система может эффективно противостоять и увеличению pH. Реальное наблюдаемое значение pKa в физиологических условиях для нее составляет 6,1.
В клинической медицине для вычисления pH плазмы крови, исходя из концентрации растворенного углекислого газа, используется следующая R03,R03,модификация уравнения Гендерсона-Гассельбаха [11] .

Бикарбонатная буферная система в культуральных средах
Бикарбонатная буферная система широко используется для культивирования эукариотических клеток [12] , например DMEM и RPMI-1640. В отличие от органических буферных агентов, таких как MOPS и HEPES, бикарбонат не является токсичным, большинство клеток нуждаются в нем для роста, независимо от его роли в поддержании устойчивого pH.
Кроме самого бикарбоната, который добавляется в среды в виде натриевой соли, для эффективного функционирования бикарбонатная буферная система требует достаточной концентрации углекислого газа (хотя он и выделяется живыми клетками, этого количества недостаточно для поддержания необходимого значения pH, поэтому клетки культивируют в CO2-инкубаторах с концентрацией углекислого газа 5-10%). Если среда, в которой используется бикарбонатная буферная система, длительное время взаимодействует с обычным воздухом (концентрация CO2 0,04%) его pH постепенно увеличивается.
Примечания
Примечания и пояснения к статье «Буферная система бикарбонатная».
- [1]pH, водородный показатель, кислотность – мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Значение pH принято измерять в значениях от 0 до 14, где pH = 7,0 считается нейтральной кислотностью (нормальная физиологическая кислотность у человека также равна 7, однако критические границы находятся в диапазоне от 5 до 9 pH). Наиболее простой и доступный способ проверить pH организма – pH анализ мочи, для проведения которого используются визуальные pH тесты.
- [2] На долю бикарбонатного буфера приходится
10% всей буферной емкости крови.
При написании статьи о бикарбонатной буферной системе в качестве источников использовались материалы информационных и справочных интернет-порталов, сайтов новостей HarperCollege.edu, Chemistry.WUSTL.edu, Boundless.com, ScienceDaily.com, Bio.MSU.ru, NIIB.SFedU.ru, Википедия, а также следующие печатные издания:
- Кассиль Г. Н. «Внутренняя среда организма». Издательство «Наука», 1978 год, Москва,
- Кристофер Вазей «Кислотно-щелочной баланс организма. Самодиагностика, методы лечения и восстановления организма. Академия здоровья». Издательство «Столица-Принт», 2007 год, Москва,
- В. Дж. Маршалл «Клиническая биохимия». Издательство «Бином. Лаборатория знаний», 2011 год, Москва,
- Шипов А. А. «Липидный обмен и реологические свойства крови при отеке легких». Издательство «LAP Lambert Academic Publishing», 2011 год, Саарбрюккен, Германия.
Уравнение гендерсона гассельбаха для бикарбонатного буфера крови
а) Уравнение Гендерсона-Хассельбаха. Как уже обсуждалось ранее, концентрацию ионов Н+ принято выражать не в абсолютных величинах, а в единицах рН. Напомним, что значение рН представляет собой значение -lg ионов Н+.
Аналогичным способом может быть выражена константа диссоциации: рК = -log К.
Следовательно, концентрацию ионов Н+ в уравнении 4 можно выразить в единицах pH через отрицательный логарифм:
Чтобы не производить вычисления с отрицательным логарифмом, можно изменить его знак, поменяв местами числитель и знаменатель дроби согласно правилам логарифмирования. В результате получим:
Для бикарбонатной буферной системы рК равно 6,1, и уравнение выше может быть преобразовано следующим образом:
Последнее уравнение называют уравнением Гендерсона-Хасселъбаха. С его помощью можно рассчитать рН раствора при условии, если известны значения молярной концентрации HCO3 — и PCO2. Из этого уравнения становится очевидным, что увеличение содержания HCO3 — вызывает повышение рН, приводя к алкалозу.
Увеличение PCO2 снижает рН, смещая кислотно-щелочное равновесие в сторону ацидоза. Уравнение Гендерсона-Хассельбаха, дополнительно определяющее признаки нормального состояния рН и кислотно-щелочного равновесия во внеклеточной жидкости, позволяет понять механизмы физиологической регуляции содержания кислот и оснований во внеклеточной жидкости.
Как будет рассмотрено далее, концентрация бикарбонатов регулируется главным образом почками, тогда как PCO2 во внеклеточной жидкости зависит от вентиляции легких. Усиление легочной вентиляции способствует выведению CO2 из плазмы, при снижении показателей вентиляции легких значение PCO2 возрастает. Гомеостаз кислотно-щелочного состояния поддерживается согласованными действиями обеих систем: выделительной и дыхательной. Повреждение одного или обоих регулирующих механизмов приводит к нарушениям, вследствие которых содержание бикарбонатов или PCO2 во внеклеточной жидкости изменяется.
Нарушения, смещающие кислотно-щелочное равновесие путем изменения содержания бикарбонатов во внеклеточной жидкости, называют метаболическими, поэтому ацидоз, вызванный таким изменением, носит название метаболического ацидоза, а алкалоз, первичной причиной которого является увеличение концентрации ионов бикарбоната, называют метаболическим алкалозом. При увеличении PCO2 возникает дыхательный ацидоз, а при снижении — дыхательный алкалоз.
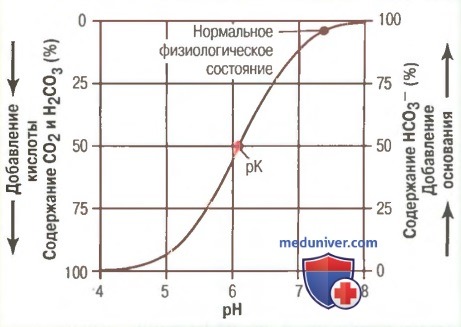
б) Кривая титрования бикарбонатной буферной системы. На рисунке выше показаны сдвиги рН во внеклеточной жидкости в ответ на изменения содержания HCO3 — и CO2 во внеклеточной жидкости. Когда концентрации двух этих компонентов равны, правая часть уравнения Гендерсона-Хасселъбаха становится логарифмом 1, который равен нулю, поэтому величина рН раствора такая же, как и рК (6,1) бикарбонатной буферной системы. При добавлении к ней основания часть растворенного CO2 преобразуется в HCO3 — , увеличивая значение соотношения HCO3 — к CO2 и, соответственно, рН, что становится очевидным из уравнения Гендерсона-Хассельбаха. Добавленная в раствор кислота связывается HCO3 — , который затем преобразуется в растворенный CO2, что уменьшает соотношение между HCO3 — к CO2 и рН внеклеточной жидкости.
в) Буферная емкость раствора определяется суммарной и относительной концентрацией компонентов буферной системы. Особенность расположения ряда точек, изображенных на кривой титрования рисунке, является вполне объяснимой. Во-первых, при условии, когда доля каждого компонента буферного раствора (HCO3 — и CO2) составляет по 50%, рН и рК равны. Во-вторых, буферная система наиболее эффективно действует в центральной части кривой, где рН приближен к рК системы. Это означает, что изменения рН, возникающие в результате добавления к раствору кислот или оснований, в этом диапазоне значений наименьшие. Деятельность буферной системы остается эффективной при отклонениях значений рН в любую сторону в пределах 1, что расширяет границы деятельности буфера от 5,1 до 7,1 единиц. Вне указанных границ буферная емкость быстро снижается. Когда весь CO2 преобразуется в HCO3 — или, наоборот, когда весь HCO3 — преобразуется в CO2, система полностью теряет емкость.
Абсолютная концентрация компонентов буферной системы также является важным показателем, определяющим буферную емкость. При низкой концентрации компонентов буферной системы добавленные даже в небольшом количестве кислоты и щелочи приводят к значительным изменениям рН.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Буферные системы, их классификация и механизм действия. Буферные растворы. Уравнение Гендерсона-Гассельбаха.
Буферными системами (буферами) называют растворы, обладающие свойством достаточно, стойко, сохранять постоянство — концентрации водородных ионов как при добавлении кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) из слабой кислоты и ее соли, образованной сильным основанием;
б) из слабого основания и его соли, образованной сильной кислотой.
На практике часто применяют следующие буферные смеси: ацетатный буфер CH3COOH + CH3COONa, бикарбонатный буфер H2CO3+NaHCO3, аммиачный буфер NH4OH +NH4Cl, белковый буфер белок кислота + белок соль, фосфатный буфер NaH2PO4 + Na2 HPO4
Фосфатная буферная смесь состоит из двух солей, одна из которых является однометаллической, а вторая — двухметаллической солью фосфорной кислоты.
Рассмотрим механизм буферного действия. При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СНзСООН); Из уравнения (а), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае НСl заменяется СН3СООН). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н + в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера, (СН3СООН) по реакции нейтрализации. В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей — степени влияющей на реакцию среды. Анионы СНзСОО
, образующиеся при диссоциации этой соли, будут оказывать некоторое Угнетающее действие на диссоциацию уксусной кислоты.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
Примером кислотного буфера может служить ацетатный буферный раствор, содержащий смесь уксусной кислоты и ацетата натрия (СНзСООН + СНзСООNа). При добавлении к такому раствору кислоты она взаимодействует с солью и вытесняет эквивалентное количество слабой кислоты: СНзСООNа + НСl ó СН3СООН + NaСl. В растворе вместо сильной кислоты образуется слабая, и поэтому величина рН уменьшается незначительно. Если к этому буферному раствору добавить щелочь, она нейтрализуется слабой кислотой, и в растворе образуется эквивалентное количество соли: СНзСООН + NaОН ó СНзСООNа + Н2О. В результате рН почти не увеличивается. Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга. Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты: СНзСООNа -> Na + + СН3СОО
СНзСОО — + НОН ó СНзСООН + ОН — . Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени: СНзСООН ó СН3СОО+H — Слабая диссоциация СНзСООН еще более подавляется в при-сутствии СНзСООNа, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:[СНзСООН] = сr. C другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты: [СНзСОО] = сс. Это уравнение называют уравнением буферного раствора (уравнением Гендерсона Гассельбаха). Его анализ для буферного раствора, образованного слабой кислотой и ее солью, показывает, что концентрация водородных ионов в буферном растворе определяется константой диссоциации слабой кислоты и соотношением концентраций кислоты и соли. Уравнение Гендерсона-Хассельбаха для буферных систем основного типа:
31.Емкость буферных растворов и факторы, определяющие её. Буферные системы крови. Водородкарбонатный буфер. Фосфатный буфер.
Буферной емкостью (В) называется количество сильной кислоты или сильного основания, которое нужно прибавить к одному литру буферного раствора, чтобы изменить его рН на единицу. Она выражается в моль/л или чаще в ммоль/л и определяется по формуле: В = (c V) / д pH Vб , где В — буферная емкость; с — концентрация сильной кислоты или основания (моль/л); V — объем добавленного сильного электролита (л); Vб — объем буферного раствора (л); д рН — изменение рН.
Способность растворов поддерживать постоянное значение pH небезгранична. Буферные смеси можно различить по силе оказываемого ими сопротивления по отношению к действию кислот и оснований, вводимых в буферный раствор.
Количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора, чтобы значение его pH изменилось на единицу, называют буферной емкостью.
Таким образом, буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добав-
ляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
http://meduniver.com/Medical/Physiology/764.html
http://helpiks.org/6-49353.html