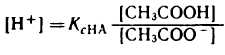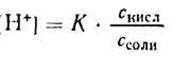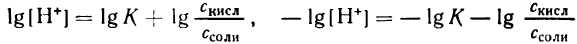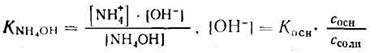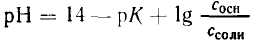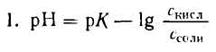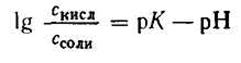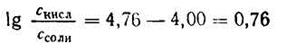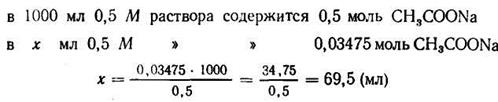Уравнение гендерсона гассельбаха в общем виде
а) Уравнение Гендерсона-Хассельбаха. Как уже обсуждалось ранее, концентрацию ионов Н+ принято выражать не в абсолютных величинах, а в единицах рН. Напомним, что значение рН представляет собой значение -lg ионов Н+.
Аналогичным способом может быть выражена константа диссоциации: рК = -log К.
Следовательно, концентрацию ионов Н+ в уравнении 4 можно выразить в единицах pH через отрицательный логарифм:
Чтобы не производить вычисления с отрицательным логарифмом, можно изменить его знак, поменяв местами числитель и знаменатель дроби согласно правилам логарифмирования. В результате получим:
Для бикарбонатной буферной системы рК равно 6,1, и уравнение выше может быть преобразовано следующим образом:
Последнее уравнение называют уравнением Гендерсона-Хасселъбаха. С его помощью можно рассчитать рН раствора при условии, если известны значения молярной концентрации HCO3 — и PCO2. Из этого уравнения становится очевидным, что увеличение содержания HCO3 — вызывает повышение рН, приводя к алкалозу.
Увеличение PCO2 снижает рН, смещая кислотно-щелочное равновесие в сторону ацидоза. Уравнение Гендерсона-Хассельбаха, дополнительно определяющее признаки нормального состояния рН и кислотно-щелочного равновесия во внеклеточной жидкости, позволяет понять механизмы физиологической регуляции содержания кислот и оснований во внеклеточной жидкости.
Как будет рассмотрено далее, концентрация бикарбонатов регулируется главным образом почками, тогда как PCO2 во внеклеточной жидкости зависит от вентиляции легких. Усиление легочной вентиляции способствует выведению CO2 из плазмы, при снижении показателей вентиляции легких значение PCO2 возрастает. Гомеостаз кислотно-щелочного состояния поддерживается согласованными действиями обеих систем: выделительной и дыхательной. Повреждение одного или обоих регулирующих механизмов приводит к нарушениям, вследствие которых содержание бикарбонатов или PCO2 во внеклеточной жидкости изменяется.
Нарушения, смещающие кислотно-щелочное равновесие путем изменения содержания бикарбонатов во внеклеточной жидкости, называют метаболическими, поэтому ацидоз, вызванный таким изменением, носит название метаболического ацидоза, а алкалоз, первичной причиной которого является увеличение концентрации ионов бикарбоната, называют метаболическим алкалозом. При увеличении PCO2 возникает дыхательный ацидоз, а при снижении — дыхательный алкалоз.
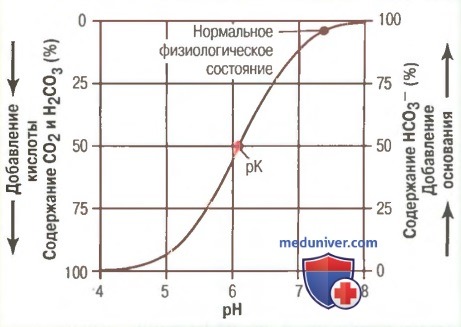
б) Кривая титрования бикарбонатной буферной системы. На рисунке выше показаны сдвиги рН во внеклеточной жидкости в ответ на изменения содержания HCO3 — и CO2 во внеклеточной жидкости. Когда концентрации двух этих компонентов равны, правая часть уравнения Гендерсона-Хасселъбаха становится логарифмом 1, который равен нулю, поэтому величина рН раствора такая же, как и рК (6,1) бикарбонатной буферной системы. При добавлении к ней основания часть растворенного CO2 преобразуется в HCO3 — , увеличивая значение соотношения HCO3 — к CO2 и, соответственно, рН, что становится очевидным из уравнения Гендерсона-Хассельбаха. Добавленная в раствор кислота связывается HCO3 — , который затем преобразуется в растворенный CO2, что уменьшает соотношение между HCO3 — к CO2 и рН внеклеточной жидкости.
в) Буферная емкость раствора определяется суммарной и относительной концентрацией компонентов буферной системы. Особенность расположения ряда точек, изображенных на кривой титрования рисунке, является вполне объяснимой. Во-первых, при условии, когда доля каждого компонента буферного раствора (HCO3 — и CO2) составляет по 50%, рН и рК равны. Во-вторых, буферная система наиболее эффективно действует в центральной части кривой, где рН приближен к рК системы. Это означает, что изменения рН, возникающие в результате добавления к раствору кислот или оснований, в этом диапазоне значений наименьшие. Деятельность буферной системы остается эффективной при отклонениях значений рН в любую сторону в пределах 1, что расширяет границы деятельности буфера от 5,1 до 7,1 единиц. Вне указанных границ буферная емкость быстро снижается. Когда весь CO2 преобразуется в HCO3 — или, наоборот, когда весь HCO3 — преобразуется в CO2, система полностью теряет емкость.
Абсолютная концентрация компонентов буферной системы также является важным показателем, определяющим буферную емкость. При низкой концентрации компонентов буферной системы добавленные даже в небольшом количестве кислоты и щелочи приводят к значительным изменениям рН.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Вычисление рН буферных растворов Уравнение Гендерсона -Хассельбаха
1) Аналитическое выражение для расчета рН буферного раствора, например, ацетатного буфера можно получить из уравнения для константы диссоциации (к реакциям диссоциации применим закон действующих масс).
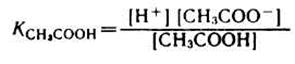
разрешив его относительно концентрации ионов водорода [H + ] можно написать:
Уксусная кислотаприсутствует в растворе в смеси с CH3COONa в виде неионизированных молекул. Поэтому концентрацию молекул можно принять равной общей молярной концентрации кислоты в растворе, т. е. [СН3СООН] = Скисл. Концентрацию анионов уксусной кислоты можно принять равной концентрации соли, т. е. [СН3СОО — ] = Ссоли, так как CH3COONa— сильный электролит, диссоциирующий в растворе на 100%. Приняв эти упрощения, получим:
2. Логарифмируя полученное уравнение и заменяя знаки логарифмов на обратные, получаем:
но – Ig [Н + ] есть рН, а – Ig К есть рК — силовой показатель кислоты.
С учетом этого получим:
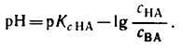
Если при приготовлении буферной системы взять одинаковые концентрации кислоты и соли, то концентрация ионов водорода в таком растворе будет равна константе ионизации кислоты, так как отношение Скис/Ссоли = 1 и [Н + ]=К1, т.е. [Н + ]=К, поэтому рН=рК.
Аналогично для систем NH4OH + NH4C1получают выражения:
1. Запишем уравнение константы ионизации NH4OH и найдем [ОН — ]:
2. Отсюда находим:
Зная, что рН + рОН = 14, получим:
Задача 1. Сколько 0,5 М раствора CH3COONa нужно прибавить к 100 мл 2М раствора СН3СООН, чтобы получить буферный раствор с рН=4?
Откуда
Подставляем числовые данные и получаем:
Число Ig 0,76 = 5,754. Следовательно, отношение концентрации кислоты к концентрации соли должно быть равно 5,754 : 1.
2. Находим концентрацию кислоты в буферной системе:
3. Зная концентрацию кислоты, находим концентрацию солив буферной системе; она должна быть равна 0,2:5,754= 0,03475 (моль).
4. Находим количество 0,5 М раствора ацетата натрия, содержащего 0,03475 моль:
Задача 2.Вычислить рН аммиачной буферной системы, содержащей по 0,5 М NH4ОН и NH4C1. Как изменится рН при добавлении к 1 л этой смеси 0,1 М НС1 и при добавлении к 1 л этой смеси 0,1 М NaOH и при разбавлении раствора водой в 10 раз, если рК (NH4ОН) =4,75?
Дата добавления: 2015-08-08 ; просмотров: 10261 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Постоянное уравнение ионизации по Хендерсону Хассельбальчу и упражнения
константа ионизации (или диссоциация) — это свойство, которое отражает тенденцию вещества выделять ионы водорода; то есть это напрямую связано с силой кислоты. Чем больше значение константы диссоциации (Ка), тем больше высвобождение водородных связей кислотой.
Например, когда речь заходит о воде, ее ионизация называется «автопротолизом» или «автоионизацией». Здесь молекула воды дает H + к другому, производя ионы H3О + и ОН — , как вы можете видеть на изображении ниже.
Диссоциация кислоты из водного раствора может быть схематизирована следующим образом:
Где HA представляет собой кислоту, которая является ионизированной, H3О + к иону гидрония и А — его сопряженное основание. Если Ka является высоким, большая часть HA будет диссоциировать и, следовательно, будет более высокая концентрация иона гидрония. Это повышение кислотности можно определить, наблюдая за изменением рН раствора, значение которого ниже 7..
- 1 ионизационный баланс
- 1,1 Ка
- 2 Уравнение Хендерсона-Хассельбальха
- 2.1 Использование
- 3 Ионизационные постоянные упражнения
- 3.1 Упражнение 1
- 3.2 Упражнение 2
- 3.3 Упражнение 3
- 4 Ссылки
Ионизационный баланс
Двойные стрелки в верхнем химическом уравнении показывают, что между реагентами и продуктом установлен баланс. Поскольку все равновесие имеет константу, то же самое происходит с ионизацией кислоты и выражается следующим образом:
Термодинамически постоянная Ka определяется с точки зрения активности, а не концентрации. Однако в разбавленных водных растворах активность воды составляет около 1, а активность ионов гидрония, конъюгата и недиссоциированной кислоты близка к их молярным концентрациям..
По этим причинам было введено использование константы диссоциации (ka), которая не включает концентрацию воды. Это позволяет упростить схематическое представление о диссоциации слабой кислоты, а константа диссоциации (Ka) выражается таким же образом.
Ka = [H + ] [A — ] / [HA]
Ка
Константа диссоциации (Ка) является формой выражения константы равновесия.
Концентрации недиссоциированной кислоты, конъюгатного основания и гидрония или иона водорода остаются постоянными после достижения равновесного состояния. С другой стороны, концентрация сопряженного основания и иона гидроксония абсолютно одинакова.
Их значения даны в степенях 10 с отрицательными показателями, поэтому была введена более простая и управляемая форма выражения Ка, которую они назвали pKa.
PKa обычно называют константой диссоциации кислоты. Значение рКа является четким показателем силы кислоты.
Те кислоты, которые имеют значение pKa ниже или более отрицательно, чем -1,74 (pKa иона гидроксония), считаются сильными кислотами. В то время как кислоты, которые имеют pKa больше чем -1,74, считаются не сильными кислотами.
Уравнение Хендерсона-Хассельбальха
Из выражения Ка получено уравнение, которое очень полезно в аналитических расчетах.
Ka = [H + ] [A — ] / [HA]
log Ka = log H + + журнал A — — log HA
И очистка журнала H + :
-log H = — log Ka + log A — — log HA
Используя затем определения pH и pKa, и термины перегруппировки:
pH = pKa + log (A — / HA)
Это знаменитое уравнение Хендерсона-Хассельбальха.
использование
Уравнение Хендерсона-Хассельбаха используется для оценки pH буферных растворов, а также того, как они влияют на относительные концентрации основания конъюгата и кислоты в pH.
Когда концентрация основания конъюгата равна концентрации кислоты, соотношение между концентрациями обоих слагаемых равно 1; и, следовательно, его логарифм равен 0.
Как следствие, pH = pKa, что очень важно, поскольку в этой ситуации эффективность буфера максимальна..
Обычно берется зона pH, где существует максимальная буферная емкость, где pH = pka ± 1 единица pH.
Ионизация постоянных упражнений
Упражнение 1
Разбавленный раствор слабой кислоты имеет следующие концентрации в равновесии: недиссоциированная кислота = 0,065 М и концентрация конъюгата основания = 9 · 10. -4 М. Рассчитайте Ka и pKa кислоты.
Концентрация иона водорода или иона гидрония равна концентрации конъюгата основания, так как они происходят от ионизации одной и той же кислоты.
Подставляя в уравнение:
Ka = [H + ] [A — ] / HA
Подставляя в уравнение их соответствующие значения:
Ка = (9 · 10 -4 М) (9 · 10 -4 М) / 65 · 10 -3 M
И рассчитываю тогда свою пКа
= — журнал 1246 · 10 -5
Упражнение 2
Слабая кислота с концентрацией 0,03 М, имеет константу диссоциации (Ка) = 1,5 · 10. -4 . Рассчитайте: а) рН водного раствора; б) степень ионизации кислоты.
В равновесном состоянии концентрация кислоты равна (0,03 М — х), где х — количество кислоты, которая диссоциирует. Следовательно, концентрация иона водорода или гидрония равна x, так же как и концентрация сопряженного основания..
Ka = [H + ] [A — ] / [HA] = 1,5 · 10 -6
Y [HA] = 0,03 М — х. Небольшое значение Ka указывает на то, что кислота, вероятно, очень мало диссоциирует, так что (0,03 М — х) приблизительно равно 0,03 М..
Подставляя в Ка:
1,5 · 10 -6 = х 2 / 3 · 10 -2
х 2 = 4,5 · 10 -8 M 2
х = 2,12 х 10 -4 M
И, наконец, в отношении степени ионизации: ее можно рассчитать с помощью следующего выражения:
[Н + ] или [A — ] / HA] x 100%
(2.12 · 10 -4 / 3 · 10 -2 ) х 100%
Упражнение 3
Я рассчитываю Ka по проценту ионизации кислоты, зная, что она ионизирована на 4,8% от начальной концентрации 1,5 · 10. -3 M.
Для расчета количества кислоты, которая ионизируется, определяют ее 4,8%..
Ионизированное количество = 1,5 · 10 -3 М (4,8 / 100)
Это количество ионизированной кислоты равно концентрации сопряженного основания и концентрации иона гидроксония или иона водорода в равновесии.
Концентрация кислоты в равновесии = начальная концентрация кислоты — количество ионизированной кислоты.
[HA] = 1,5 · 10 -3 М — 7,2 · 10 -5 M
И решить тогда с теми же уравнениями
Ka = [H + ] [A — ] / [HA]
Ка = (7,2 · 10 -5 М х 7,2 · 10 -5 М) / 1,428 · 10 -3 M
http://helpiks.org/4-60678.html
http://ru.thpanorama.com/articles/qumica/constante-de-ionizacin-ecuacin-de-henderson-hasselbalch-y-ejercicios.html