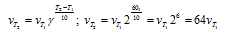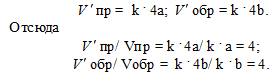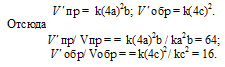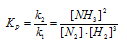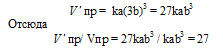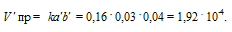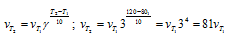Куда сместится равновесие в реакции N2+O2=2NO — Q помогите решить. умоляю!
Куда сместится равновесие в реакции N2+O2=2NO — Q при повышении температуры, при понижении давления и при повышении концентрации NO?
По принципу Ле Шателье:
При повышении температуры — вправо
При понижении давления — не изменится
При повышении концентрации NO — влево
При повышении температуры — вправо
При понижении давления — влево
Оксид азота IV: получение и химические свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения
1. Оксид азота (IV) образуется при окислении оксида азота (II) кислородом или озоном:
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например , при действии концентрированной азотной кислоты на медь:
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например , при разложении нитрата серебра:
Химические свойства
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
Если растворение NO2 в воде проводить в избытке кислорода , то образуется только азотная кислота:
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
При нагревании выделяется кислород:
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
В присутствии кислорода образуются только нитраты:
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор , уголь , сера , оксид серы (IV) окисляется до оксида серы (VI):
4. Оксид азота (IV) димеризуется :
Вычисление концентрации веществ и скорости реакции
Скорость реакции
Задание 127.
Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 °С, если температурный коэффициент скорости данной реакции 2?
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 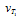
Задание 121.
Окисление серы и ее диоксида протекает по уравнениям:
а) S (к) + O2 = SO2 (г); б) 2SO2 (г) + O2 = 2SO3 (г).
Как изменится скорость этих реакций, если объемы каждой из систем уменьшить в четыре раза?
Решение:
а) S (к) + O2 = SO2 (г)
Обозначим концентрации газообразных реагирующих веществ: [O2] = a, [SO2] = b. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = k . a; Vобр = k . b.
После уменьшения объёма гетерогенной системы в четыре раза концентрация газообразных веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b. При новых концентрациях скорости прямой и обратной реакций будут равны
Следовательно, после уменьшения объёма в системе скорости прямой и обратной реакций увеличились в четыре раза. Равновесие системы не сместилось.
Обозначим концентрации реагирующих веществ: [O2] = a, [SO2] = b, [SO3] = с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = ka 2 b; Vо б р = kc 2 .
После уменьшения объёма гомогенной системы в четыре раза концентрация реагирующих веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b, [SO3] = 4с При новых концентрациях скорости прямой и обратной реакций будут равны:
Следовательно, после уменьшения объёма в системе скорость прямой реакции возросла в 64 раза, а обратной – в 16. Равновесие системы при этом сместилось вправо, в строну уменьшения образования газообразных веществ.
Константы равновесия гомогенной системы
Задание 122.
Напишите выражение для константы равновесия гомогенной системы:
N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза?
Решение:
Уравнение реакции:
Выражение константы равновесия данной реакции имеет вид:
Обозначим концентрации газообразных реагирующих веществ: [N2] = a, [H2] = b. Согласно закону действующих масс, скорость прямой реакций до увеличения концентрации водорода равна: Vпр = kab 3 . После увеличения концентрации водорода в три раза концентрации исходных веществ будут равны: [N2] = a, [H2] = 3b. При новых концентрациях скорости прямой реакций будет равна:
Следовательно, после увеличения концентрации водорода в три раза скорость реакции возросла в 27 раз. Равновесие, согласно принципу Ле Шателье, сместилось в сторону уменьшения концентрации водорода, т. е. вправо.
Задание 123.
Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [O2] = 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NO] = 0,005 моль/л. Ответ: [N2] 0,0465 моль/л; [O2] = 0,0075 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции следует, что на образование 2 моль NO расходуется по 1 моль N2 и О2, т. е. на образование NO требуется в два раза меньше N2 и О2. Исходя из сказанного, можно предположить, что на образование 0,005 моль NO затрачивается по 0,0025 моль N2 и О2. Тогда конечные концентрации исходных веществ будут равны:
[N2]конечн. = [N2]исх. – 0,0025 = 0,049 – 0,0025 = 0,0465 моль/л;
[O2]конечн. = [O2]исх. — 0,0025 = 0,01 – 0,0025 = 0,0075 моль/л.
Ответ: [N2]конечн. = 0,0465 моль/л; [O2]конечн. = 0,0075 моль/л.
Задание 124.
Реакция идет по уравнению N2 + ЗН2 = 2NH3. Концентрации участвующих в ней веществ (моль/л): [N2] = 0,80; [H2] = 1,5; [NH3] = 0,10. Вычислите концентрацию водорода и аммиака [N2] = 0,5 моль/л. Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения следует, что из 1 моль N2 Образуется 2 моль NH3 и расходуется 3 моль Н2. Таким образом, при участии в реакции определённого количества азота образуется в два раза большее количество аммиака и прореагирует в три раза больше водорода. Рассчитаем количество азота, которое прореагировало: 0,80 – 0,50 = 0,30 моль. Рассчитаем количество аммиака, которое образовалось: 0,3 . 2 = 0,6 моль. Рассчитаем количество прореагировавшего водорода: 0,3 . 3 = 0,9 моль. Теперь рассчитаем конечные концентрации реагирующих веществ:
[NH3]конечн. = 0,10 + 0,60 = 0,70 моль;
[Н2]конечн. = 1,5 — 0,90 = 0,60 моль;
[N2]конечн. = 0,80 — 0,50 = 0,30 моль.
Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Скорость, температурный коэффициент скорости реакции
Задание 125.
Реакция идет по уравнению Н2 + I2 = 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ (моль/л): [Н2] = 0,04:
[I2] = 0,05. Вsчислите начальную скорость реакции и ее скорость при [H2] = 0,03 моль/л. Ответ: 3,2 . 10 -4 , 1,92 . 10 -4
Решение:
Уравнение реакции имеет вид:
При исходных концентрациях реагирующих веществ, согласно закону действующих масс, скорость реакции будет равна при обозначении концентраций исходных веществ: [Н2] = a, [I2] = b.
Vпр = kab = 0,16 . 0,04 . 0,05 = 3,2 . 10 -4 .
Рассчитаем количество водорода, которое вступило в реакцию, если концентрация его изменилась и стала 0,03 моль/л, получим: 0,04 — 0,03 = 0,01 моль. Из уравнения реакции следует, что водород и йод реагируют друг с другом в отношении 1 : 1, значит в реакцию вступило тоже 0,01 моль йода. Отсюда, конечная концентрация йода равна: 0,05 -0,01 = 0,04 моль. При новых концентрациях скорость прямой реакции будет равна:
Ответ: 3,2 . 10 -4 , 1,92 . 10 -4 .
Задание 126.
Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С. Температурный коэффициент скорости реакции З.
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 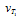
http://chemege.ru/oksid-azota-iv/
http://buzani.ru/zadachi/khimiya-shimanovich/918-skorost-khimicheskoj-reaktsii-zadacha-121-127