Электронная библиотека
Закон Бойля-Мариотта устанавливает зависимость изменения удельного объема идеального газа от его давления при постоянной температуре: при постоянной температуре отношение удельных объемов газа обратно пропорционально отношению его давлений.
Если обозначить начальный и конечный удельные объемы идеального газа через и , а соответствующие им абсолютные давления через и , то по закону Бойля-Мариотта
Закон Гей-Люссака устанавливает зависимость изменения удельного объема идеального газа от его температуры при постоянном давлении: при постоянном давлении отношение удельных объемов идеального газа прямо пропорционально отношению его абсолютных температур.
Из этого закона следует:
Закон Шарля устанавливает зависимость изменение давления идеального газа от его температуры при постоянном удельном объеме: при постоянном удельном объеме отношение абсолютных давлений идеального газа прямо пропорционально отношению его абсолютных температур.
Уравнение состояния идеального газа — основные понятия, формулы и определение с примерами
Содержание:
Уравнение состояния идеального газа:
Уравнения Клапейрона и Менделеева — клапейрона; законы Шарля, Гей-Люссака, Бойля — Мариотта, Авогадро, Дальтона, — пожалуй, такого количества «именных» законов нет ни в одном разделе физики. за каждым из них — кропотливая работа в лабораториях, тщательные измерения, длительные аналитические размышления и точные расчеты. нам намного проще. Мы уже знаем основные положения теории, и «открыть» все вышеупомянутые законы нам не составит труда.
Уравнение состояния идеального газа
Давление газа полностью определяется его температурой и концентрацией молекул: p=nkT. Запишем данное уравнение в виде: pV = NkT. Если состав и масса газа известны, число молекул газа можно найти из соотношения
Произведение числа Авогадро 


Обратите внимание! Состояние данного газа некоторой массы однозначно определяется двумя его макроскопическими параметрами; третий параметр можно найти из уравнения Менделеева — Клапейрона.
Уравнение Клапейрона
С помощью уравнения Менделеева — Клапейрона можно установить связь между макроскопическими параметрами газа при его переходе из одного состояния в другое. Пусть газ, имеющий массу m и молярную массу М, переходит из состояния (

Для каждого состояния запишем уравнение Менделеева — Клапейрона: 



Для данного газа некоторой массы отношение произведения давления на объем к температуре газа является неизменным.
Изопроцессы
Процесс, при котором один из макроскопических параметров данного газа некоторой массы остается неизменным, называют изопроцессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, возможных изопроцессов тоже три: происходящий при неизменной температуре; происходящий при неизменном давлении; происходящий при неизменном объеме. Рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
Пузырек воздуха, поднимаясь со дна глубокого водоема, может увеличиться в объеме в несколько раз, при этом давление внутри пузырька падает, поскольку вследствие дополнительного гидростатического давления воды (
Рис. 30.2. Изотермическое сжатие газа. Если медленно опускать поршень, температура газа под поршнем будет оставаться неизменной и равной температуре окружающей среды. Давление газа при этом будет увеличиваться
Изотермический процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменной температуре.
Пусть некий газ переходит из состояния (



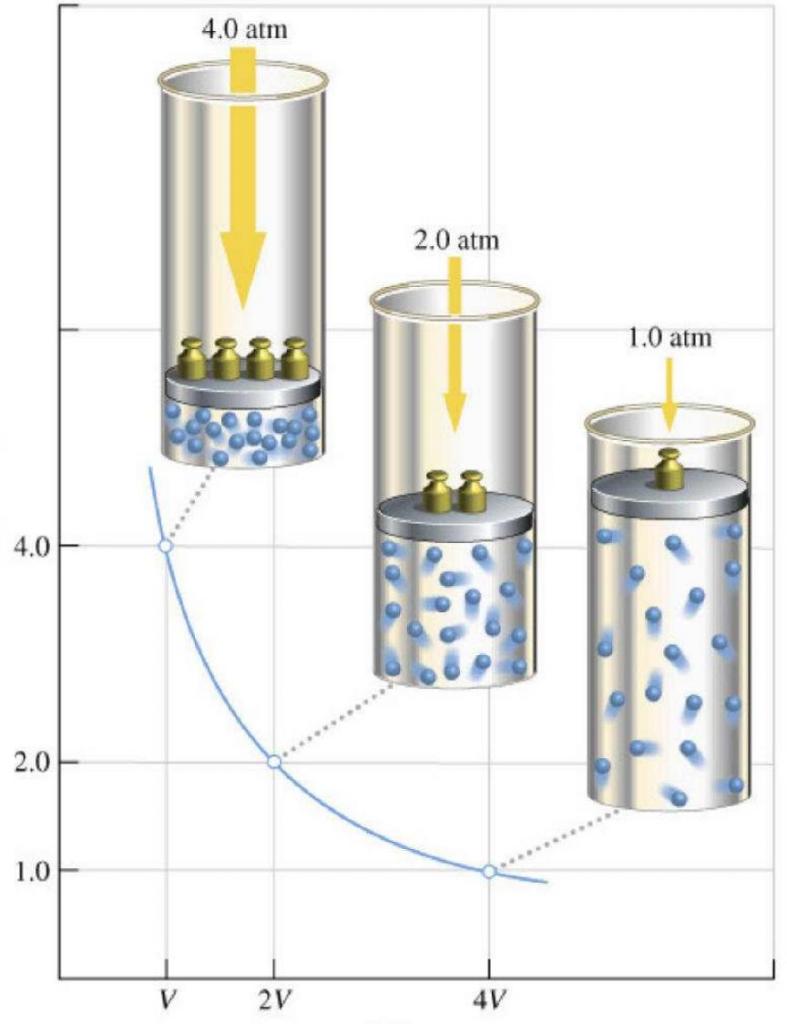
Закон Бойля — Мариотта:
Для данного газа некоторой массы произведение давления газа на его объем остается постоянным, если температура газа не изменяется:
Графики изотермических процессов называют изотермами. Как следует из закона Бойля — Мариотта, при неизменной температуре давление газа данной массы обратно пропорционально его объему: 
Какой процесс называют изобарным. Закон Гей-Люссака
Изобарный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном давлении.
Пусть некий газ переходит из состояния (


Рис. 30.4. Изобарное расширение газа. Если газ находится под тяжелым поршнем массой M и площадью S, который может перемещаться практически без трения, то при увеличении температуры объем газа будет увеличиваться, а давление газа будет оставаться неизменным и равным p
Закон Гей-Люссака
Для данного газа некоторой массы отношение объема газа к температуре остается постоянным, если давление газа не изменяется:
Графики изобарных процессов называют изобарами. Как следует из закона Гей-Люссака, при неизменном давлении объем газа данной массы прямо пропорционален его температуре: V = const⋅T. График данной зависимости — прямая, проходящая через начало координат (рис. 30.5, а). По графику видно, что с приближением к абсолютному нулю объем идеального газа должен уменьшиться до нуля. Понятно, что это невозможно, поскольку реальные газы при низких температурах превращаются в жидкости. В координатах p, V и p, T изобары перпендикулярны оси давления (рис. 30.5, б, в).
Изохорный процесс. Закон Шарля
Если газовый баллон сильно нагреется на солнце, давление в нем повысится настолько, что баллон может взорваться. В данном случае имеем дело с изохорным нагреванием.
Изохорный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном объеме.
Пусть некий газ переходит из состояния (


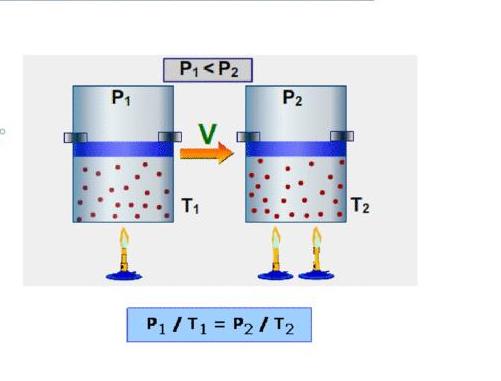
Рис. 30.6. Изохорное нагревание газа. Если газ находится в цилиндре под закрепленным поршнем, то с увеличением температуры давление газа тоже будет увеличиваться. Опыт показывает, что в любой момент времени отношение давления газа к его температуре неизменно:
Закон Шарля
Для данного газа некоторой массы отношение давления газа к его температуре остается постоянным, если объем газа не изменяется:
Графики изохорных процессов называют изохорами. Из закона Шарля следует, что при неизменном объеме давление газа данной массы прямо пропорционально его температуре: p T = ⋅ const . График этой зависимости — прямая, проходящая через начало координат (рис. 30.7, а). В координатах p, V и V, T изохоры перпендикулярны оси объема (рис. 30.7, б, в).
Пример №1
В вертикальной цилиндрической емкости под легкоподвижным поршнем находится 2 моль гелия и 1 моль молекулярного водорода. Температуру смеси увеличили в 2 раза, и весь водород распался на атомы. Во сколько раз увеличился объем смеси газов?
Анализ физической проблемы. Смесь газов находится под легкоподвижным поршнем, поэтому давление смеси не изменяется:
Решение:
Воспользуемся уравнением состояния идеального газа: pV = νRT. Запишем это уравнение для состояний смеси газов до и после распада: 




Ответ: примерно в 2,7 раза.
Пример №2
На рис. 1 представлен график изменения состояния идеального газа неизменной массы в координатах V, T. Представьте график данного процесса в координатах p, V и p, T.
Решение:
1. Выясним, какой изопроцесс соответствует каждому участку графика (рис. 1).
Зная законы, которым подчиняются эти изопроцессы, определим, как изменяются макроскопические параметры газа. Участок 1–2: изотермическое расширение; T = const, V ↑, следовательно, по закону Бойля — Мариотта p ↓. Участок 2–3: изохорное нагревание; V = const, T ↑, следовательно, по закону Шарля p ↑ . Участок 3–1: изобарное охлаждение; p = const , T ↓, следовательно, по закону Гей-Люссака V ↓ .
2. Учитывая, что точки 1 и 2 лежат на одной изотерме, точки 1 и 3 — на одной изобаре, а точки 2 и 3 на одной изохоре, и используя результаты анализа, построим график процесса в координатах p, V и p, T (рис. 2)
- Из соотношения p=nkT можно получить ряд важных законов, большинство из которых установлены экспериментально.
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона):
— универсальная газовая постоянная.
- Уравнение Клапейрона:
- Законы, которым подчиняются изопроцессы, то есть процессы, при которых один из макроскопических параметров данного газа некоторой массы остается неизменным:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Основные законы газов в физике: Бойля-Мариотта, Шарля, Гей-Люссака, Авогадро и Клапейрона-Менделеева
Ученые начали исследовать поведение газов при различных внешних условиях со второй половины XVII века. В течение почти двух веков были экспериментально открыты основные газовые законы в физике, анализируя которые Эмиль Клапейрон в 1834 году записал универсальное уравнение состояния. Рассмотрим подробнее в статье эти законы.
Идеальные газы
Прежде чем переходить к описанию законов газов в физике, дадим характеристику модели, на которую они опираются. Речь идет о модели идеального газа. Согласно ей, рассматриваемое агрегатное состояние материи состоит из невзаимодействующих друг с другом частиц (атомов и молекул), которые полагают безразмерными. Частицы движутся со скоростями несколько сотен метров в секунду в разных направлениях. Их средняя кинетическая энергия характеризует температуру всей системы, а столкновения со стенками сосуда приводят к появлению давления в ней.
Поведение реальных газов, которые находятся при не слишком больших давлениях и температурах в несколько сотен кельвин, хорошо согласуется с предсказаниями описанной модели. Например, земной воздух можно считать идеальной смесью газов.
Закон Бойля-Мариотта
Рассматривая с точки зрения термодинамики газы, газовый закон Роберта Бойля и Эдма Мариотта следует назвать в первую очередь, поскольку он был экспериментально открыт раньше всех остальных законов (вторая половина XVII века). Он гласит, что при постоянной температуре в закрытой газовой системе любое изменение объема приводит к обратно пропорциональному изменению давления. Математически закон записывается в следующих двух формах:
График закона Бойля-Мариотта называется изотермой. Она представляет собой гиперболическую зависимость функций P(V) или V(P).
Законы Шарля и Гей-Люссака
Оба закона газов в физике были открыты примерно в одно и то же время (конец XVIII — начало XIX веков) французами Шарлем и Гей-Люссаком.
Закон Шарля описывает поведение газовой системы во время изобарного процесса, то есть перехода между равновесными состояниями при постоянном давлении. Закон гласит, что при увеличении температуры в указанных условиях объем растет прямо пропорционально. Математически его записывают следующим образом:
Закон Шарля можно получить экспериментально, если в цилиндр под подвижный поршень закачать некоторый объем газа, а затем нагревать систему и фиксировать в ней температуру и объем.
Третий основной газовый закон носит фамилию Гей-Люссака. Он описывает поведение системы во время изохорного процесса, то есть при постоянном объеме. Если в предыдущем случае газ закачивался в цилиндр с подвижным поршнем, то в законе Гей-Люссака объем цилиндра фиксирован. Изменяются лишь давление и температура. Математически его выражают так:
Видно, что эта зависимость ничем не отличается от предыдущей. Только в данном случае вместо величины V стоит P.
Графики изобары (P=const) и изохоры (V=const) представляют собой прямые линии с положительным наклоном, поскольку увеличение объема (давления) всегда приводит к возрастанию абсолютной температуры. Важно запомнить, что приведенные в этом пункте формулы справедливы только в том случае, если в них использовать температуру в единицах абсолютной шкалы, то есть в кельвинах.
Закон или принцип Авогадро
В начале того же XIX века итальянец Амедео Авогадро, исследуя поведение разных газов, взятых в разных количествах, пришел к удивительному заключению. Ученый показал экспериментально, что разные газы при одинаковых давлениях и температурах занимают объем, пропорциональный количеству вещества в молях. В виде формулы этот принцип представляется так:
Важный вывод, который можно сделать из этого закона газов в физике, заключается в отсутствии в нем зависимости от химического состава. Отметим, что на принципе Авогадро основан закон парциальных давлений для смеси идеальных газов, который носит фамилию Дальтона.
Закон Клапейрона-Менделеева
Он также называется законом состояния газов и обобщает экспериментальный опыт всех предыдущих законов. Соответствующее уравнение впервые записал Эмиль Клапейрон в 1834 году, а Менделеев ввел постоянную универсальную для газов R. Уравнение Клапейрона-Менделеева имеет вид:
Каждый школьник может получить из него любой из перечисленных выше законов газов в физике, если зафиксирует две соответствующие переменные.
http://www.evkova.org/uravnenie-sostoyaniya-idealnogo-gaza
http://fb.ru/article/460483/osnovnyie-zakonyi-gazov-v-fizike-boylya-mariotta-sharlya-gey-lyussaka-avogadro-i-klapeyrona-mendeleeva




























 — универсальная газовая постоянная.
— универсальная газовая постоянная.