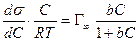Лако-красочные материалы — производство
Технологии и оборудование для изготовления красок, ЛКМ
Гиббсовская адсорбция из бинарных растворов
При рассмотрении адсорбции газов и паров на твердых адсорбентах допускалось, что до адсорбции поверхность адсорбента свободна от молекул адсорбата и она постепенно заполняется адсорбатом с ростом давления в соответствии с изотермой адсорбции. При адсорбции из жидких растворов поверхность адсорбента всегда полностью занята молекулами растворителя И растворенного вещества. Растворенное вещество может адсорбироваться только вытесняя из поверхностного слоя молекулы растворителя, т. е. происходит обменная молекулярная адсорбция. Таким образом, в адсорбции из растворов участвуют как минимум два адсорбирующихся компонента. Применительно к молекулярной адсорбции из бинарного раствора фундаментальное адсорбционное уравнение Гиббса (11.63) принимает вид
— с/а = Г, й(1, + Г2йц2 (111.92)
Где Гі и Г2—величина гиббсовской адсорбции компонентов / (растворитель) и 2 (растворенное вещество) соответственно.
Чтобы связать величины гиббсовской адсорбции с концентрациями компонентов в растворе, используем уравнение Гиббса — Дюгема:
Подставив вместо n0 (в скобках) его выражение (III.97), получим
П|П2 + л22 + Лої і s 4- /l2n2s — njfi2 — л22 — Alxu то Гг>0, а произведение xtx2 объясняет наличие максимума [кривая Гг (Л]- Если в системе возможно увеличение коэффициента распределения компонента 1 при изменении состава раствора, то изотерма адсорбции пересекает ось составов [кривая Г2 (2)] в точке, соответствующей равенству А/х^=А2/х2. Из соотношения (III.101) следует симметричность изотермы адсорбции компонента 1 по отношению к изотерме адсорбции компонента 2.
Лекция 13. Адсорбция
13.1. Уравнение адсорбции Гиббса
Строгое определение понятия адсорбции по Дж. Гиббсу: адсорбцией данного компонента на границе раздела двух фаз называется разность между фактическим количеством этого компонента в системе и тем его количеством, которое было бы в системе, если бы концентрации в обеих сосуществующих фазах были постоянны вплоть до некоторой геометрической поверхности, разделяющей их.
Эта разность может быть положительной или отрицательной. Она обозначается символом G (гамма) и имеет размерность моль/м 2 . Эту величину называют избыточной адсорбцией по Дж. Гиббсу.
Хотя в приведенном определении адсорбция отнесена к геометрической поверхности, не имеющей толщины (что удобно при выводе уравнений), фактически граница между фазами представляет собой очень тонкий слой (поверхностный слой), в котором все свойства отличаются от свойств объемных фаз и изменяются не скачкообразно, а непрерывно.
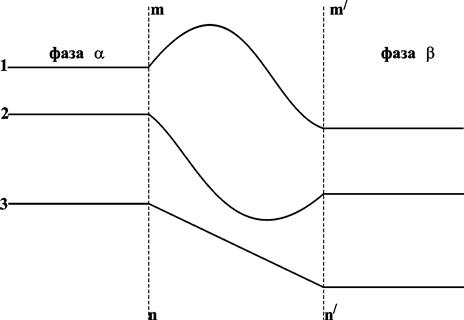
На рис. 13.1 показано возможное изменение концентрации вблизи границы раздела: концентрация компонента может быть как выше концентраций в обеих фазах (1), так и ниже (2) или иметь промежуточное значение. Эта область может рассматриваться как поверхностный слой. Таким образом, изучая границу раздела фаз, нужно рассматривать состояние трех фаз: двух объемных и одной поверхностной.
Рис. 13.1. Изменение концентрации компонентов у границы раздела фаз;
поверхностный слой – mn-m’n’
Уравнение, устанавливающее связь между всеми параметрами процесса адсорбции – величиной поверхностного натяжения s, концентрацией компонента [C] в одной из фаз, его адсорбцией Г, было выведено Дж. Гиббсом в 1876 г. Это уравнение является общим термодинамическим уравнением, справедливым для любых составов и природы поверхности раздела фаз.
Рассмотрим систему, состоящую из двух компонентов 1 и 2 и двух фаз a и b, разделенных поверхностью раздела с площадью S. Общее число молей каждого компонента в системе равно n1 o и n2 o . Если считать, что поверхностный слой не имеет толщины, т.е. представляет собой геометрическую поверхность, то обе объемные фазы будут иметь постоянный состав вплоть до этой геометрической поверхности. Обозначим число молей каждого компонента в каждой из этих фаз соответственно через n1 a ,n1 b ; n2 a ,n2 b . Так как на поверхности имеет место адсорбция, то, очевидно, n1 o ¹ n1 a + n1 b и n2 o ¹ n2 a + n2 b .
По вышеприведенному определению адсорбция каждого компонента Г1 и Г2 , отнесенная к единице площади поверхности, равна
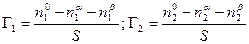
Чтобы найти Г1 и Г2, напишем уравнение энергии Гиббса для двух фаз a и b в отдельности и для всей системы в целом. В последнем случае, очевидно, нужно включить в уравнение член sdS:
dG o = — S o dT + V o dP + sdS + m1dn1 o + m2dn2 o . (13.2)
Укажем на уравнение Гиббса-Дюгема, которое устанавливает связь между химическими потенциалами:
dG = — S dT + VdP + Smidn1 (P, T – постоянные). (13.3)
Тогда для бинарной системы получим
Интегрируя это уравнение при постоянных значениях m1 и m2, получим
Из (13.4) и (13.6) вытекает, что
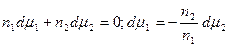
Это уравнение носит название уравнения Гиббса-Дюгема и связывает изменение химических потенциалов компонентов. Тогда с учетом уравнения Гиббса-Дюгема и поверхностных явлений получаем:
Сложение двух первых уравнений и вычитание полученной суммы из третьего дает
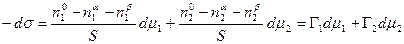
В качестве примера рассмотрим две конкретные системы: двухкомпонентный жидкий раствор, находящийся в равновесии со своим двухкомпонентным насыщенным паром, и твердое тело, находящееся в равновесии с однокомпонентным газом, совершенно не растворимым в этом твердом теле.
Поскольку в первом случае точное положение разделяющей геометрической поверхности несколько условно, то можно выбрать положение ее, при котором
Во втором случае вследствие нерастворимости газа в объеме твердого тела, объемные свойства этого тела, в частности его химический потенциал, не изменяются при адсорбции. Приписывая твердому телу индекс 1, имеем:
В обоих случаях получено одно и то же уравнение. Поэтому можно считать, что адсорбционное уравнение Гиббса имеет вид:
Оно является основным в учении о поверхностных явлениях.
Рассмотрим далее реальный раствор. Для реального раствора
где а – активность, тогда:
Подставив это значение в уравнение (13.12), получим:
ds = — Г Rt d lna,
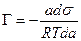
В разбавленных растворах а » С (где С – концентрация)
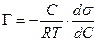
а для идеального или разреженного идеального газа
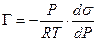
Уравнение (13.14) показывает, что если при адсорбции поверхностное натяжение s уменьшается с ростом концентрации С, т.е. ds/dC 0 и Г – отрицательно. Это соответствует поверхностно-инактивным веществам. Если известна зависимость s от С (т.е. изотерма поверхностного натяжения s = f(C) , то по уравнению Гиббса можно для каждого значения концентрации найти ds/dC и по уравнению Гиббса вычислить значение Г, т.е. построить изотерму адсорбции.
13.2. Обзор сорбционных явлений
Адсорбция на границе раздела твердое тело/газ. В общем случае явления, связанные с перераспределением веществ между различными частями гетерогенной системы, называются сорбцией. Сорбция (от лат. sorbeo – сгущать) – это изменение концентрации (часто увеличение) либо у поверхности раздела фаз (адсорбция), либо в объеме одной из фаз (абсорбция). Например, образование раствора за счет поглощения НСl (газа) и поглощение газа металлом (абсорбция). Поверхностная сорбция – адсорбция.
Твердое тело, у поверхности которого происходит адсорбция, называется адсорбентом, адсорбирующийся газ или адсорбирующийся компонент жидкого раствора – адсорбтивом, а адсорбированое вещество – адсорбат.
В строгом определении адсорбции она рассматривается как избыток вещества вблизи поверхности по сравнению с равным объемом вдали от нее. В ряде случаев удобнее рассматривать не избыток, а все количество адсорбата вблизи поверхности. Это количество обозначают символом а и называют полным содержанием, или просто адсорбцией (без указания гиббсова). Так как для пористых твердых тел бывает затруднительно знать величину поверхности, то часто адсорбцию относят не к единице поверхности, а к единице массы (моль/кг или моль/г).
Адсорбция самопроизвольна и протекает при Р = const со снижением энергии Гиббса, а при V = const – со снижением энергии Гельмгольца. Однако при этом происходит не выравнивание концентраций по всему объему системы, а увеличение разности концентраций между газовой фазой (раствором) и поверхностью. Одновременно уменьшается подвижность сорбирующихся молекул. Оба фактора ведут к уменьшению энтропии (DS o , так как DG o = DH o + TDS o ,
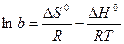
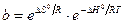
Таким образом, адсорбционный коэффициент b связан со стантартной энтропией DS° и со стандартной теплотой адсорбции q = –DH°.
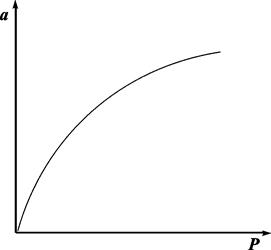
Очень часто аm называют «емкость монослоя». На рис.13.3 показана кривая, выражающая изотерму адсорбции по Ленгмюру
Рис. 13.3. Изотерма адсорбции по Ленгмюру
При очень малых заполнениях и, следовательно, очень малых давлениях Р в знаменателе, согласно (13.25), bр > 1 и а = аm, т.е. величина адсорбции перестает зависеть от давления, поскольку все центры уже заняты.
Для расчета параметров am и b уравнение Ленгмюра представляют в виде
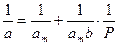
Тангенс угла наклона этой линии равен 1/amb, а отрезок, отсекаемый на оси ординат, равен 1/am.
Уравнение Ленгмюра, полученное на основании модели локализованной адсорбции газов на поверхности твердого тела, часто хорошо описывает адсорбцию растворенных веществ на поверхности жидкости (поверхность раздела раствор/газ), при которой адсорбция не локализована, так как молекулы подвижны и образуют двумерную газо- или жидкообразную пленку.
Обусловлено это тем, что основные положения модели Ленгмюра соблюдаются при адсорбции из растворов: поверхность жидкости идеально однородна, взаимодействие адсорбированных молекул в адсорбционном слое мало отличается от их взаимодействия в растворе. Оно к тому же ослаблено за счет взаимодействия молекул растворенного вещества с молекулами растворителя и практически не влияет на адсорбцию.
Уравнение Ленгмюра связано с уравнением состояния адсорбционной пленки – уравнением Гиббса. Так,
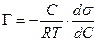
а по уравнению Ленгмюра
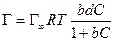
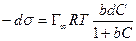
После интегрирования в пределах от sо до s и от 0 до С получим:
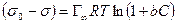
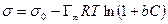
где Г¥ связано с площадью, занимаемой 1 моль адсорбированного вещества в мономолекулярном слое, следующим соотношением: 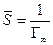
Дата добавления: 2016-02-09 ; просмотров: 2879 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://helpiks.org/6-84315.html