Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2151b4cfd5215d • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Гидролиз соли СuCl2, образованной слабым основанием и сильной кислотой

Анионы хлора не принимают участия в реакциях, поскольку не образуют с водой слабого электролита. Т. к. заряд катиона меди равен «2+» то стадий гидролиза будет также две. Водный раствор будет иметь кислую реакцию, так как взаимодействие ионов слабого основания Сu2+ с водой приведет к смещению равновесия диссоциации воды и к образованию свободных протонов водорода:
1 стадия гидролиза:
Краткое ионно-молекулярное уравнение: Сu2+ + HOH ↔ CuOH+ + H+
Полное ионно-молекулярное уравнение: Сu2++2Cl-+H2O↔CuOH++H++2Cl-
Молекулярное уравнение: CuCl2 + H2O↔ CuOHCl + HCl
2 стадия гидролиза
Краткое ионно-молекулярное уравнение: СuOH+ + HOH ↔ Cu(OH)2 + H+
Полное ионно-молекулярное уравнение: СuOH++Cl-+HOH↔Cu(OH)2+H++Cl-
Молекулярное уравнение: CuOHCl + H2O ↔ Cu(OH)2 + HCl
Запишем выражение для константа равновесия процесса гидролиза по второй стадии исходя из краткого ионного уравнения:
Поскольку концентрация воды величина практически постоянная, то умножив константу равновесия на величину [H2O], получаем Кгидролиза по 2 ступени
Кгидролиза по 2 ступени =
Из ионного произведения воды Кw = [H+] [OH-] выразим концентрацию [H+]:

Для того, чтобы понять, что представляет величина 
1 ступень: Сu(OH)2 ↔ CuOH+ + OH — Кb(1 ступени) =
2 ступень CuOH+ ↔ Cu 2+ + OH — Кb(2 ступени) =
Очевидно, что 
Следовательно, 
Кислую реакцию среды соли CuCl2 подтвердим расчетами, то есть определим pH раствора, зная, что С(CuCl2)= 0,001 моль/л.
Прежде всего найдем константу гидролиза Кг2, для этого воспользуемся значением константы диссоциации меди гидроксида (Кb1 = 3,4·10-7), ионное произведение воды Кw = 10-14: Кг2 = Кw / Кb1 = 10-14 /(3,4·10-7) = 2,9·10-8



Для вычисления pH следует принять во внимание, что в результате гидролиза каждого катиона Cu2+ образуется один ион H+. Если исходная концентрация гидролизующихся катионов была С моль/л, а гидролизу подверглась доля β этих катионов, то при этом образовалось βС моль/л ионов H+.
Таким образом, [H+] = β·СBaS = 5,38·10-3 ·0,001= 5,38·10-6 моль/л
Следовательно, рH = – lg [H+] = – lg 5,38·10-6 = 5,26
Выполненные расчеты подтвердили, что соль CuCl2 имеет кислую реакцию среды.
Гидролиз хлорида меди. Расчет концентрации ионов кальция
Страницы работы
Содержание работы
1. Какая из перечисленных солей подвергается гидролизу: CuCl2, Na2SO4, Са(NОз)2? Рассчитать рН раствора, если концентрация этой соли равна 0.5 моль/л, а константа диссоциации основания равна Кь2 = 2.19 * 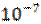
Сульфат натрия Na2SO4 и нитрат кальция Са(NОз)2 – соли сильных оснований и сильных кислот, поэтому гидролизу не подвергаются.
Гидролизоваться будет хлорид меди (2) CuCl2 – соль слабого основания (Cu(OH)2) и сильной кислоты (HCl). Гидролиз протекает по катиону, преимущественно по I ступени. Среда кислая.
Диссоциация хлорида меди (2):
Гидролиз хлорида меди по первой ступени:
Cu 2+ + H2O ↔ CuOH + + H +
Для солей, гидролизующихся по катиону, константа гидролиза Кг равна:
Кг = Kw/Kb, где Kw = 10 -14 – ионное произведение воды, Кb – константа диссоциации основания.
Т.к. гидролиз хлорида меди (2) протекает преимущественно по первой ступени, то для расчёта используем константу гидролиза по первой ступени, которая равна: Кг(1) = Kw/Kb(2)
Итак, рН для данного раствора равен:
2. Определите рН 0.1 М раствора плавиковой кислоты (HF), константа диссоциации которой равна Ка = 6.67*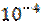
Плавиковая кислота – слабый электролит. Для слабых кислот концентрация водородных ионов в растворе рассчитывается по формуле:
рН = — lg[H + ] = — lg 8,17*10 -3 = 2,09
3. В какую сторону сместится равновесие реакции 2СО + O2 2СO2 а) при увеличении температуры (∆Н ; .
Диссоциация карбоната кальция:
Согласно уравнению диссоциации соли,
[Ca 2+ ] = √ПР = √(4,4*10 -9 ) = 6,63*10 -5 (моль/л)
Переведём концентрацию ионов кальция в г/л:
С = М*МВ = 6,63*10 -5 моль/л * 40 г/моль = 2,652*10 -3 г/л
(С – концентрация, выраженная в граммах растворённого вещества на литр раствора, М – молярная концентрация раствора, МВ – молярная масса катиона кальция)
http://pandia.ru/text/80/277/52907.php
http://vunivere.ru/work59419









