Гидролиз нитрата железа (II)
Fe(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
Fe 2+ + 2NO3 — + HOH ⇄ FeOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Fe 2+ + HOH ⇄ FeOH + + H +
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
FeOH + + NO3 — + HOH ⇄ Fe(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
FeOH + + HOH ⇄ Fe(OH)2 + H +
Среда и pH раствора нитрата железа (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
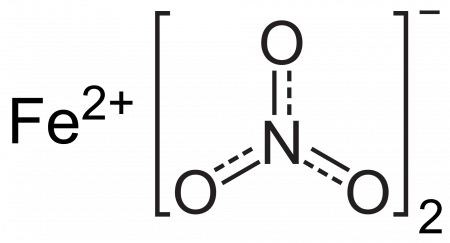
Нитрат железа (II)
| Нитрат железа (II) | |
|---|---|
 | |
| Систематическое наименование | Нитрат железа (II) |
| Хим. формула | FeN2O6 |
| Рац. формула | Fe(NO3)2 |
| Состояние | твёрдое |
| Молярная масса | |
| Температура | |
| • плавления | (гексагидрат) 60,5°C |
| Рег. номер CAS | 14013-86-6 |
| PubChem | 9815404 |
| SMILES | |
| RTECS | NO7175000 |
| ChemSpider | 7991154 и 32867051 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат железа (II) — соль азотной кислоты и двухвалентного железа.
Содержание
Физические свойства
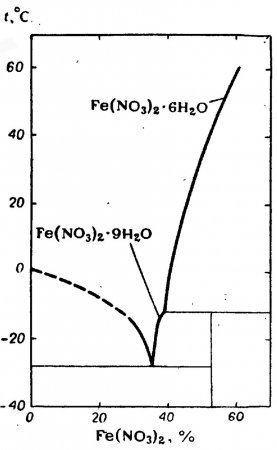
Нитрат железа (II) существует в основном в виде кристаллогидратов Fe(NO3)2·6H2O и Fe(NO3)2·9H2O.
Гексагидрат нитрата железа (II) Fe(NO3)2·6H2O — светло-зелёные кристаллы с ромбической кристаллической решеткой. Хорошо растворяется в воде, причем растворимость растёт вместе с повышением температуры. В равновесии с насыщенным водным раствором существует в интервале от -12 до 60,5 °C и концентрации раствора в пределах 39-69,5%. При более низких температурах и концентрациях растворов устойчив нонагидрат нитрата железа (II) Fe(NO3)2·9H2O.
График растворимости представлен на рисунке.
| Состояние | Температура, °С | Концентрация, % |
| Лед+Fe(NO3)2·9H2O | -28 | (35) |
| Fe(NO3)2·9H2O+Fe(NO3)2·6H2O | (39) | |
| Fe(NO3)2·6H2O | 60,5 | 62,5 |
Безводный нитрат железа (II) и его кристаллогидраты неустойчивы, поэтому легко окисляются на воздухе.
Получение
Нитрат железа (II) образуется при растворении железа в разбавленной азотной кислоте на холоде:
В чистом состоянии его лучше получать обменной реакцией сульфата железа (II) с нитратом свинца (II):
Химические свойства
Проявляет восстановительные свойства. Гидролиз практически не проявляется.
- Водный раствор нитрата железа (II) разлагается при кипячении с образованием основного нитрата железа (III):
4 Fe(NO3)2 + O2 + 2H2O → t 4Fe(OH)(NO3)2
- Реагирует с щелочами с образованием гидроксида железа (II):
Fe(NO3)2 + 2NaOH → Fe(OH)2↓ + 2NaNO3
- С растворимыми карбонатами дает белый карбонат железа (II):
Fe(NO3)2 + K2CO3 → FeCO3↓ + 2KNO3
- Восстанавливается до металлического железа при действии более активного металла
Fe(NO3)2 + Mg → Fe + Mg(NO3)2
- Взаимодействует с гексацианоферратом (III) калия (красной кровяной солью) с образованием тёмно-синего осадка гексацианоферрата (II) железа (III)-калия (берлинская лазурь):
Fe(NO3)2 + K3[Fe(CN)6] → KFe[Fe(CN)6]↓ + 2KNO3
- При термическом разложении образуется оксид железа (III), а не оксид железа (II):
4 Fe(NO3)2 → t 2Fe2O3 + 8NO2↑ + O2↑
—>Киберхимия —>
—> —>Форма входа —>
—> —>Категории раздела —>
—> —>Поиск —>
—> —>Друзья сайта —>
—> —>Статистика —>
Каталог файлов
| [ —>Скачать с сервера (68.5 Kb) ] | 08.02.2014, 22:03 | ||||||||||
| Температура, °С | Концентрация, г/100 г воды | Концентрация, % |
| 0 | 67,08 | 40,15 |
| 20 | 82,48 | 45,2 |
| 40 | 104,83 | 51,18 |
Безводный нитрат железа(III) получить не удалось.
В растворе бледно-фиолетовый гексаакваанион [Fe(H 2O) 6] 3+ преобладает только в том случае, если pH
0. При более высоких значениях pH раствор желтеет из-за гидролиза, а если pH выше 2-3, происходит дальнейшая конденсация и начинается образование коллоидных гелей, и в конечном итоге образуется красновато-коричневый осадок гидратированного оксида железа (III).
Получение
Химические свойства
Равновесие можно сместить в обратную сторону сильно подкислив раствор HNO 3.
 .
.http://chem.ru/nitrat-zheleza-ii.html
http://chemistry.3dn.ru/load/n_o_fe/1-1-0-4043