Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пособие-репетитор по химии
ЗАНЯТИЕ 7
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22,/2005; 1, 2, 3, 5, 6/2006
План

2. Гидролиз солей различных типов.
3. Обратимый и необратимый гидролиз.
Слово «гидролиз» (от греч. 

Гидролизом соли называют взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Сущность процесса гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами или ионами водорода из молекул воды. В результате этого взаимодействия образуется слабый электролит. Химическое равновесие процесса диссоциации воды смещается вправо, в сторону образования ионов. Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН – , что и определяет среду раствора соли. При разбавлении раствора или при повышении температуры степень гидролиза увеличивается.
Любую соль можно представить как продукт реакции нейтрализации. В зависимости от силы исходных кислоты и основания различают 4 типа солей. Гидролиз солей разных типов протекает по-разному и дает различную среду раствора.
Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по анионному типу, среда раствора – щелочная (рН > 7), например:
СН3СООNa + HOH 
СН3СОО – + HOH 
В том случае, когда соль образована слабой многоосновной кислотой и сильным основанием, гидролиз по аниону протекает ступенчато и число ступеней гидролиза зависит от основности слабой кислоты. На первых ступенях гидролиза образуется кислая соль (вместо кислоты) и сильное основание, например:
Na2SO3 + HOH 
SO3 2– + HOH 
NaHSO3 + HOH 
HSO3 – + HOH 
Na2SO3 + 2HOH 
SO3 2– + 2HOH 
Соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катионному типу, среда раствора – кислая (рН + + HOH 
Если соль образована слабым многокислотным основанием и сильной кислотой, катионный гидролиз протекает cтупенчато в зависимости от кислотности слабого основания. Вместо основания на первых ступенях такого гидролиза образуется основная соль, например:
ZnCl2 + HOH 
Zn 2+ + HOH 
Zn(OH)Cl + HOH 

Zn(OH) + + HOH 

ZnCl2 + 2HOH 

Соль, образованная слабым основанием и слабой кислотой, гидролизуется одновременно и по катиону, и по аниону. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной, в зависимости от степени диссоциации продуктов гидролиза, например:
(NH4)2CO3 + 2HOH 
2NH4 + + СО3 2– + 2НОН 
Соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается, т.к. в процессе реакции не образуется слабый электролит; среда раствора при этом нейтральная, например:
NaCl + HOH 
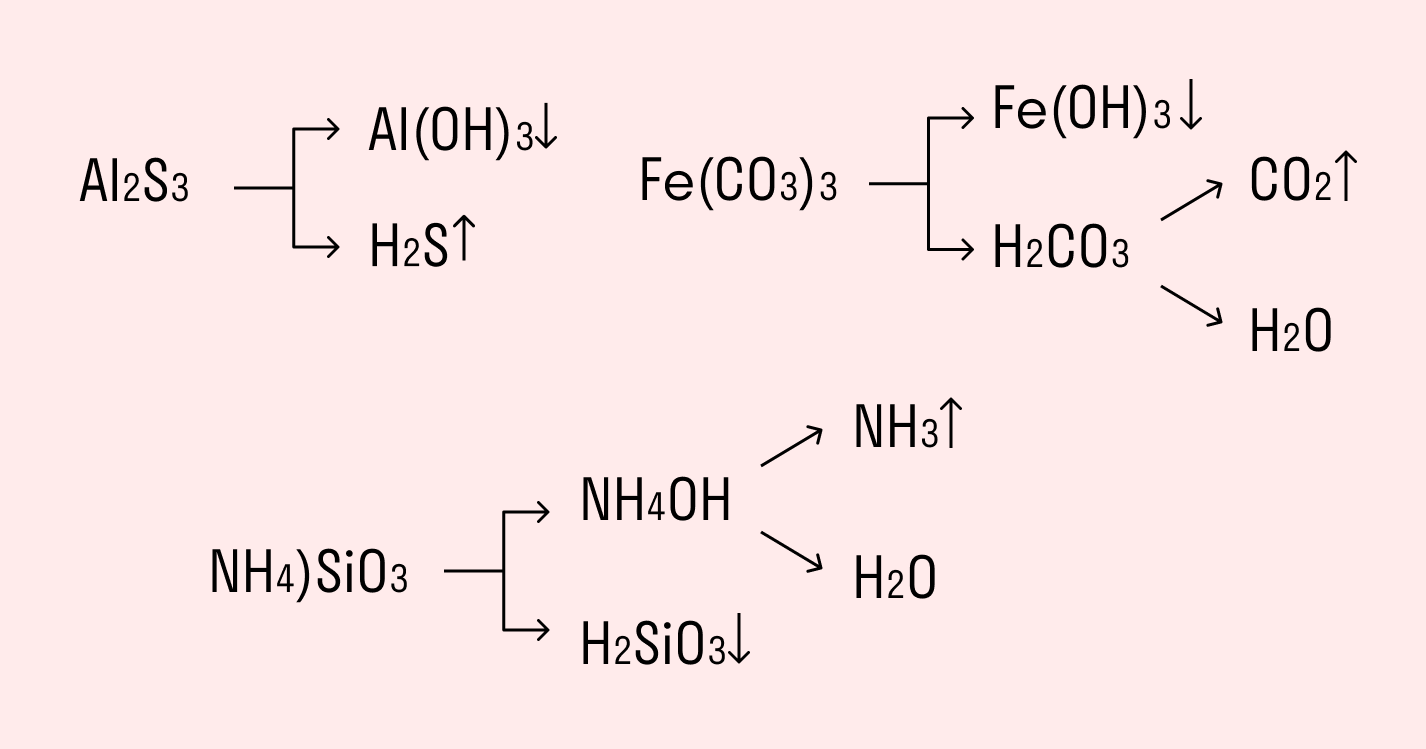
Для большинства солей гидролиз является обратимым процессом, однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз – необратимый процесс. Необратимому гидролизу подвергаются соли, образованные слабым нерастворимым или летучим основанием и слабой нерастворимой или летучей кислотой. Такие соли не могут существовать в водных растворах (Аl2S3, Fe2(СО3)3 и т.п.), например:
Al2S3 + 6HOH = 2Al(OH)3 

Из-за необратимого гидролиза в реакциях обмена между водными растворами двух солей не всегда образуются новые соли. В таких случаях необходимо учитывать реакции гидролиза исходных солей. Например, при взаимодействии водных растворов сульфида калия и хлорида алюминия сначала протекают обменные реакции исходных реагентов с водой, а потом – продуктов реакции между собой. Процесс описывается суммарным уравнением реакции:
3К2S + 2AlCl3 + 6H2O = 2Al(OH)3 

Тест по теме «Гидролиз солей»

а) А – хлорид натрия, В – нитрат серебра;
б) А – нитрат бария, В – фосфорная кислота;
в) А – хлорид меди(II), В – уксусная кислота;
г) А – фторид натрия, В – хлорид бария.
2. Сумма коэффициентов в уравнении реакции между водными растворами нитрата хрома(III) и сульфида натрия равна:
а) 19; б) 12; в) 6; г) 22.
3. Газ выделяется при смешивании растворов хлорида хрома(III) и:
а) гидросульфида аммония;
б) гидроортофосфата калия;
в) гидросульфата натрия;
г) силиката натрия.
4. В четырех пробирках находятся водные растворы перечисленных ниже солей. Раствор какой соли можно отличить от других с помощью лакмуса?
а) бромид алюминия; б) сульфат цинка;
в) нитрат свинца; г) силикат калия.
5. Гидролиз протекает при растворении в воде:
а) бромида кальция; б) фосфата кальция;
в) нитрита кальция; г) ацетата кальция.
6. Гидролизу по аниону подвергается соль:
а) хлорид бария; б) нитрит калия;
в) хлорид аммония; г) фосфат натрия.
7. Цинк будет растворяться при погружении его в раствор:
а) хлорида натрия; б) хлорида бария;
в) хлорида алюминия; г) хлорида калия.
8. Пара веществ, в растворе которых фиолетовый лакмус изменяет окраску на красную и синюю, соответственно:
а) карбонат натрия и сульфит калия;
б) сульфат цинка и бромид алюминия;
в) хлорид никеля(II) и нитрит бария;
г) нитрат натрия и хлорид кальция.
9. Гидролиз невозможен для следующей группы соединений:
а) оксиды; б) нитриды;
в) фосфиды; г) гидриды.
10. Подавить гидролиз сульфата магния можно:
а) разбавлением раствора;
б) нагреванием раствора;
в) добавлением раствора серной кислоты;
г) добавлением раствора гидроксида натрия.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| а, б | г | а | г | в, г | б, г | в | в | а | в |
Задачи и упражнения по теме «Гидролиз солей»

Гидролиз солей
| Гидролизуются соли (формулы солей) | Растворы с рН | Уравнения гидролиза (молекулярные и ионные) солей с рН |
|---|---|---|
| CoCl2, . | CoCl2, . | CoCl2 + H2O  CoOHCl + HCl, CoOHCl + HCl, |
| . | . | Co 2+ + 2Cl – + H2O  |
| . | . |  CoOH + + H + + 2Cl – , CoOH + + H + + 2Cl – , |
| . | . | . |
Уравнения гидролиза солей с рН 3+ + H2O 
2Fe(OH)SO4 + 2H2O 
Fe(OH) 2+ + H2O 
[Fe(OH)2]2SO4 + 2Н2О 

Fe(OH)2 + + Н2О 

Ni(OH)NO3 + H2O 

NiOH + + H2O 

2. Составьте молекулярные уравнения гидролиза солей на основании сокращенных ионных уравнений:
а) Cr 3+ + H2O = CrOH 2+ + H + ;
б) Fe 2+ + H2O = FeOH + + H + ;
в) Al 3+ + H2O = AlOH 2+ + H + ;
г) Сu 2+ + H2O = CuOH + + H + .
Молекулярные уравнения гидролиза:
а) CrCl3 + H2O 
б) Fe(NO3)2 + H2O 
в) AlCl3 + H2O 
г) СuBr2 + H2O 
3. Опишите процессы, происходящие при сливании водных растворов следующих солей:
а) нитрат хрома(III) и сульфид натрия;
б) хлорид алюминия и сульфид натрия;
в) сульфат железа(III) и карбонат натрия;
г) сульфат алюминия и сульфид аммония;
д) хлорид железа(III) и карбонат аммония.
Обмен и гидролиз одновременно:
а) 2Cr(NO3)3 + 3Na2S + 6H2O = 2Cr(OH)3 

б) 2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 

в) Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 

г) Al2(SO4)3 + 3(NH4)2S + 6H2O = 2Al(OH)3 

д) 2FeCl3 + 3(NH4)2CO3 + 3H2O = 2Fe(OH)3 

4. При добавлении к водному раствору вещества А раздельно аммиака, сульфида натрия и нитрата серебра образуются белые осадки, причем два из них – одинакового состава. Определите вещество А.
5. При добавлении к водному раствору вещества А раздельно сульфида калия, аммиака и хлорида бария образуются осадки. В первом и втором случае – серо-зеленого цвета одного состава, в третьем случае – белый кристаллический. Определите вещество А.
Задачи
1. К 50 г раствора карбоната натрия с массовой долей растворенного вещества 10,6% прилили избыточное количество раствора сульфата алюминия. Какой газ выделяется при этом? Каков объем (н.у.) этого газа?
2. Вычислите относительную плотность по воздуху и по гелию газа, выделяющегося при гидролизе нитрида магния.
3. Вычислите относительную плотность по воздуху и по неону газа, выделяющегося при гидролизе фосфида кальция.
4. Гидроксид алюминия массой 11,7 г обработали раствором серной кислоты объемом 45 мл с молярной концентрацией 5 моль/л. Какая реакция среды будет у полученного раствора?


Мольные соотношения реагентов отвечают стехиометрическим коэффициентам: 0,15/2 = 0,225/3.
Однако среда раствора не нейтральная, а кислая, т.к. протекает гидролиз соли Al2(SO4)3:
Al2(SO4)3 + 6НОН 

Гидролиз
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
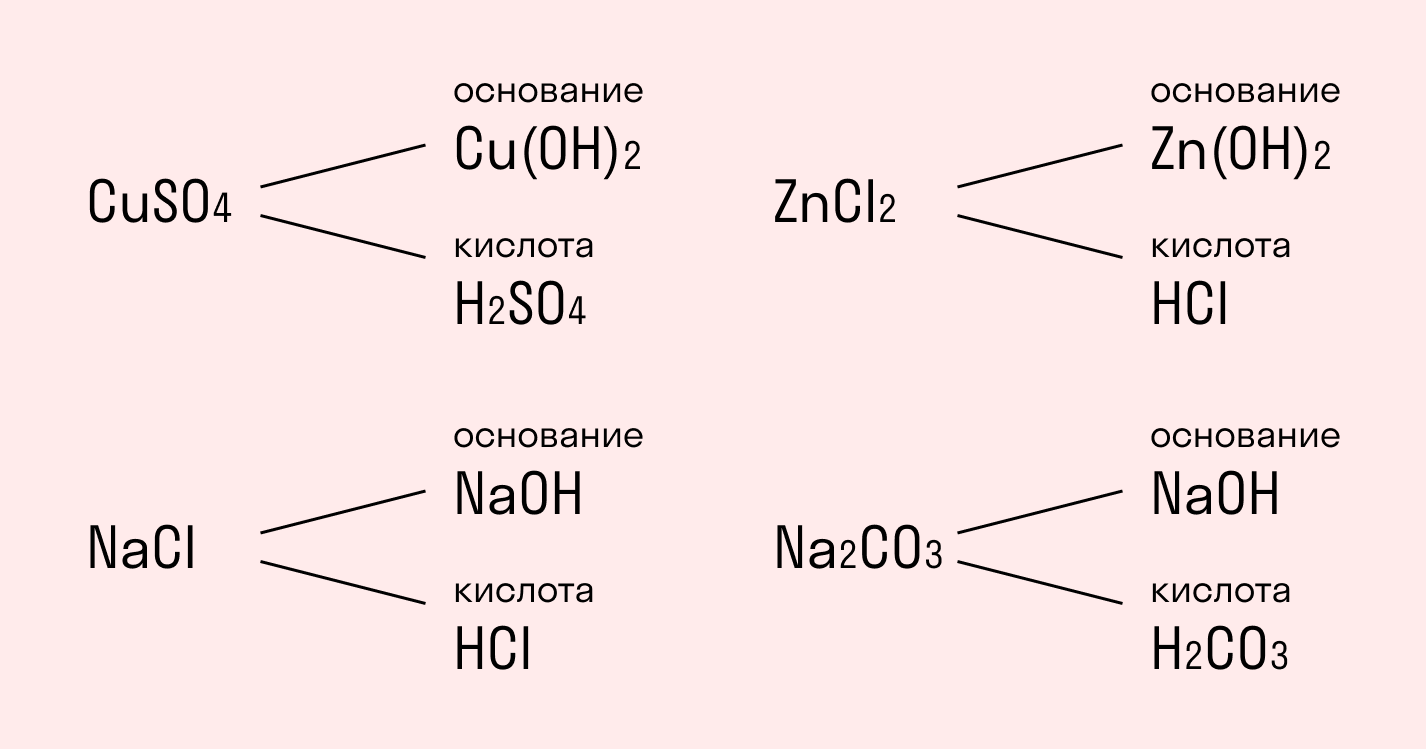
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H + или гидроксильная группа OH − .
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
В данном случае:
XY — формула соли;
XH — кислотный остаток;
Индикаторы среды раствора
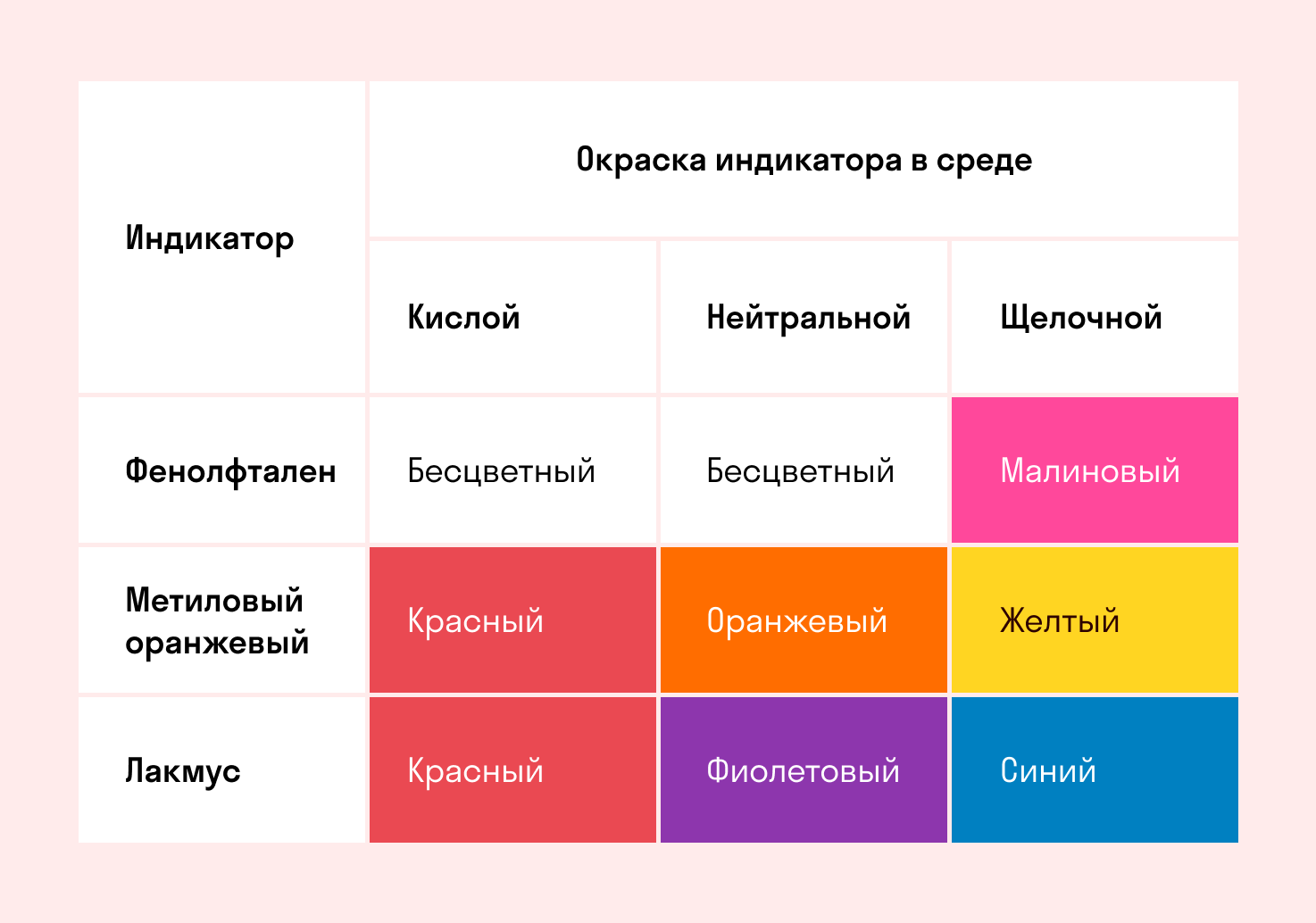
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
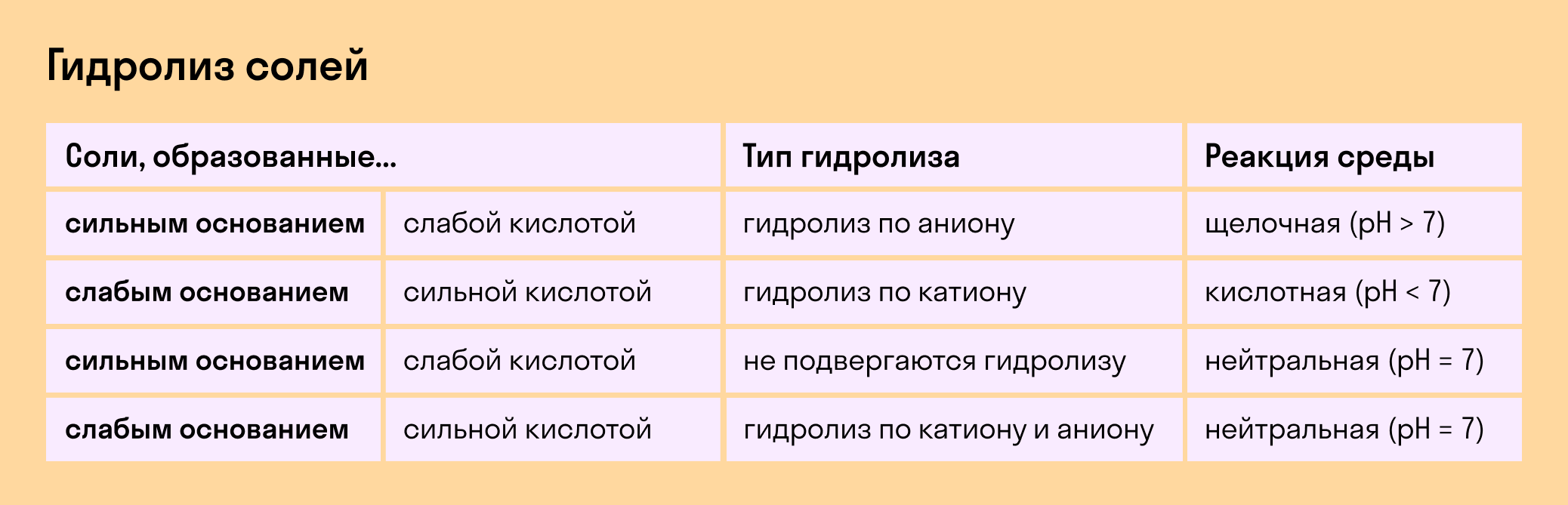
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
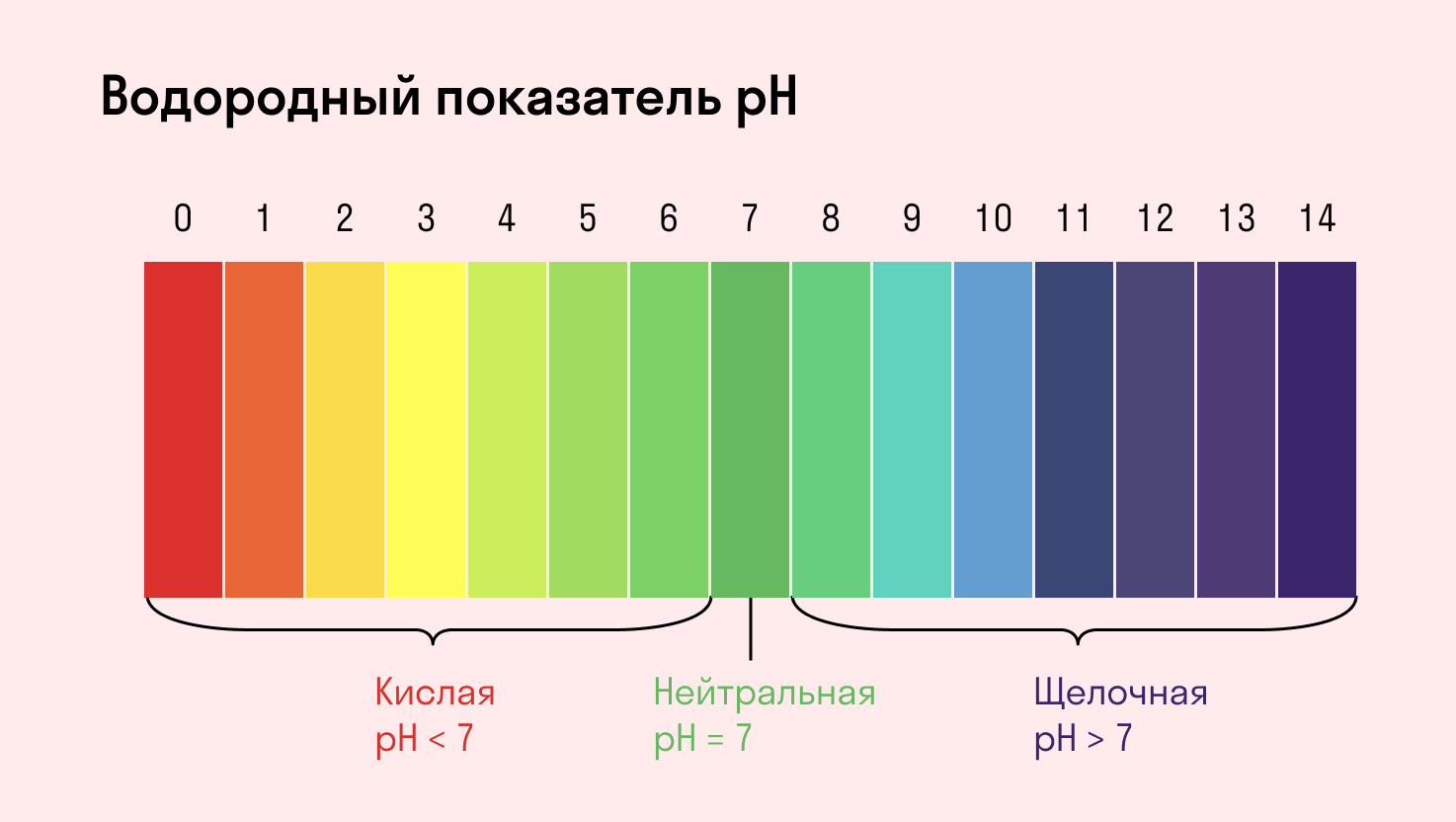
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH − . В итоге образуется раствор с избытком ионов водорода H + .
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4 + связывает ионы воды OH − .
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H + в молекуле воды. В итоге получается раствор с повышенным содержанием OH − .
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2 − связывает ионы воды H + .
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
http://him.1sept.ru/article.php?ID=200600803
http://skysmart.ru/articles/chemistry/gidroliz