Уравнение гидролиза жира как доказать что образуется мыло
Известно несколько способов получения мыл.
- Нейтрализация кислот углекислым натрием (кальцинированной содой)
- Нейтрализация кислот гидроксидом натрия (каустической содой)
Жидкие калиевые мыла и твердые натриевые мыла получают растворением высших алифатических кислот в водных растворах едких щелочей:
- Омыление триглицеридов гидроксидом натрия
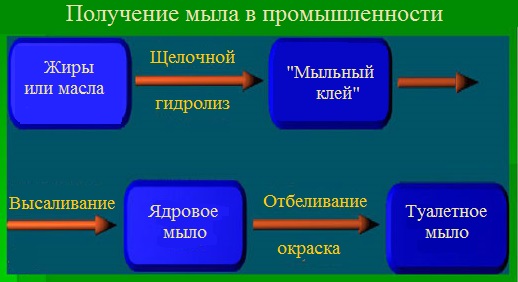
Получение мыла основано на реакции омыления — кипячением животного сала либо растительного масла с гидроксидом натрия или калия (гидролиз сложных эфиров жирных кислот (т.е. жиров) в присутствии щелочей), в результате которого образуется трехатомный спирт глицерин и соли высших карбоновых кислот (мыло):
Прямой способ. В специальных емкостях (варочных котлах) нагретые жиры омыляют едкой щёлочью (обычно гидроксидом натрия). Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи.
В результате реакции в варочных котлах образуется однородная вязкая жидкость, густеющая при охлаждении — мыльный клей, состоящий из мыла и глицерина. Содержание жирных кислот в мыле, полученном непосредственно из мыльного клея обычно 40—60 %. Такой продукт имеет название «клеевого мыла».
Косвенный способ заключается в дальнейшей обработке мыльного клея.
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи или раствором хлорида натрия. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром.
Он содержит не менее 60 % жирных кислот; нижний слой — подмыльный щёлок, раствор электролита с большим содержанием глицерина. (также содержит загрязняющие компоненты, содержавшиеся в исходном сырье).
Полученное мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием.
Производство хозяйственного мыла заканчивают на стадии высаливания, при этом происходит очистка мыла от белковых, красящих и механических примесей. Производство туалетного мыла проходит все стадии механической обработки. Наиболее важной из них является шлифовка, т.е. переведение ядрового мыла в раствор кипячением с горячей водой и повторным высаливанием. При этом мыло получается особо чистым и светлым.
Для улучшения некоторых характеристик хозяйственного мыла, а также для удешевления в него вводят наполнители: некоторые натриевые соли, которые при растворении в воде приводят к подщелачиванию; клеи и крахмал – способствуют пенообразованию мыльного раствора и стойкости пены, однако моющей способностью не обладают.
Особое место среди наполнителей занимает сапонин, получаемый выщелачиванием некоторых растений и прежде всего мыльного корня. Он хорошо растворяется в воде и его растворы сильно пенятся. Сапонин применяют для дорогих сортов мыла.
При использовании в качестве щёлочи каустической соды получают твердое натриевое мыло. Мягкое или даже жидкое калиевое мыло образуется, когда применяется каустический поташ.
Главное условие красящих веществ, употребляемых для подкраски туалетного мыла, — это хорошее смешивание их с мылом и отсутствие вредного влияния на кожу.
Красный цвет для прозрачного мыла получают при помощи фуксина и эозина, для непрозрачного мыла используют киноварь и сурик. Желтый цвет мылу придает экстракт куркумы и пикриновая кислота. Для получения мыла зеленого цвета применяют зеленый анилин или хромовую зеленую краску. Коричневый цвет мыла образуется из светлой или темной коричневой анилиновой краски или жженого сахара.
В промышленности вместо щелочи применяют соду, а так как жиры являются одной из главных составляющих пищи человека, то за основу берут не животные жиры, а углеводороды, входящие в состав парафинов (нефти).
Мыла полученные из синтетических кислот аналогичны по своей химической природе обычным мылам.
Биологически важные вещества
| Жиры – это сложные эфиры, образованные глицерином и высшими одноосновными карбоновыми кислотами (жирными кислотами). . |
Жиры образуются при взаимодействии глицерина и высших карбоновых кислот:
| Жирные (высшие) кислоты | |
| Предельные кислоты | Непредельные кислоты |
| Масляная кислота С3Н7 -СООН | Олеиновая кислота С 17 Н 33 СООН (содержит одну двойную связь в радикале) |
| Пальмитиновая кислота С15Н31 — СООН | Линолевая кислота С 17 Н 31 СООН (две двойные связи в радикале) СН3-(СН2)4-СН = СН-СН2-СН = СН-СООН |
| Стеариновая кислота С 17 Н 35 — СООН | Линоленовая кислота С 17 Н 29 СООН (три двойные связи в радикале) СН3СН2СН=CHCH2CH=CHCH2CH=СН(СН2)4СООН |
Номенклатура жиров
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:
Физические свойства жиров
Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
Химические свойства жиров
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин |
1.2. Щелочной гидролиз — омыление жиров
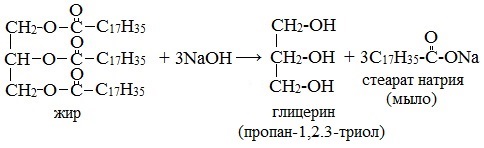
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия . |
2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
| Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина: |
| Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира. |
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
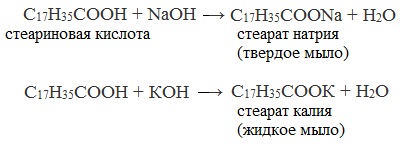
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca 2+ и Mg 2+ дают с высшими кислотами нерастворимые в воде соли.
| Например, тристеарат глицерина взаимодействует с сульфатом кальция |
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата .
Далее алкилсульфат гидролизуется щелочью:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Белки
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями.
Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Макромолекулы белков имеют стереорегулярное строение, исключительно важное для проявления ими определенных биологических свойств.
Структуры белков
| Первичная структура — последовательность α-аминокислотных звеньев в полипептидной цепи | Вторичная структура – спиральная структура полипептидной цепи, закрепленная водородными связями между группами N-H и С=О |
 |  |
| Третичная структура – определенная форма спирали в пространстве, образованная с помощью дисульфидных мостиков -S-S-, водородных связей и других взаимодействий | Четвертичная структура — объединение нескольких белковых макромолекул в так называемые глобулы (бывает не у всех белков) |
 |  |
Химические свойства белков
Качественные реакции на белки
- Биуретовая реакция – фиолетовое окрашивание при действии на белки свежеосажденного гидроксида меди (II).
- Ксантопротеиновая реакция – желтое окрашивание при действии на белки концентрированной азотной кислоты.
Денатурация белка
Это разрушение структуры белка при нагревании, изменении кислотности среды, действии излучения, спирта, тяжелых металлов, радиации.
Пример денатурации — свертывание яичных белков при варке яиц.
Денатурация бывает обратимой и необратимой.
- При обратимой денатурации первичная структура белка не разрушается.
- Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
- При необратимой денатурации происходит также гидролиз белка — необратимое разрушение первичной структуры в кислом или щелочномрастворе с образованием аминокислот или более коротких пептидных фрагментов.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Углеводы
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Классификация углеводов
По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6 Дезоксирибоза С5Н10О4 | Сахароза С12Н22О11 Целлобиоза С12Н22О11 | Целлюлоза (С6Н10О5)n Крахмал(С6Н10О5)n |
По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
Химические свойства, общие для всех углеводов
1. Горение
Все углеводы горят до углекислого газа и воды.
| Например, при горении глюкозы образуются вода и углекислый газ |
2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
| Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода |
Моносахариды
| Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. |
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза C6H12O6 | Фруктоза C6H12O6 | Рибоза C5H10O5 |
| Структурная формула |  |  |  |
| Классификация |
|
|
|
Глюкоза
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
| α-глюкоза | β-глюкоза |
 |  |
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
| Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи. |
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
| Простые эфиры глюкозы получили название гликозидов. |
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |
Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
Фруктоза
| Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). |
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
| Фруктоза | α-D-фруктоза | β-D-фруктоза |
 |  |  |
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Дисахариды
| Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). |
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
| Поэтому сахароза не вступает в реакции альдегидной группы – с аммиачным раствором оксида серебра с гидроксидом меди при нагревании. Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться. |
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
| Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов. |
При гидролизе мальтозы образуется глюкоза.
Полисахариды
| Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. |
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
Запись полного гидролиза крахмала без промежуточных этапов:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Урок химии по теме «Жиры. Мыло». 10-й класс
Класс: 10
Презентация к уроку
Цели:
Обучающие:
- сформировать представление о жирах и мылах как о химических соединениях, изучив их химический состав и химические свойства, закрепить умения писать уравнения реакции, познакомить со способами их переработки;
Развивающие:
- совершенствовать логическое мышление, актуализировать знания о жирах из курса биологии; развить кругозор учащихся, знакомя их с применением жиров и жироподобных веществ и их производных, научить делать выводы.
Воспитательные:
- создать положительную мотивацию изучения химии через ознакомление учащихся с ролью жиров и мыла в жизни человека, проявлять творческий подход к выполнению заданий.
Методическое обеспечение урока: интерактивная доска. Слайды, содержащие информацию по новому материалу, задания для проверки первичного усвоения знаний, тестовые задания. Для эксперимента: пробирки, растительное масло, сливочное масло, маргарин, ацетон, растворы гидроксида натрия, серной кислоты, перманганата калия.
На демонстрационном столе учителя: гербарий и изображения масличных растений, животных, из которых получают жир; образцы сливочного, подсолнечного, оливкового масел, маргарин, олифа, глицерин, мыло жидкое и твердое, свеча, синтетические моющие средства. Чёрный ящик с куском мыла.
Тип урока – урок изучения нового материала – лекция, дополненная просмотром слайдов, беседа, демонстрация эксперимента, сообщения учащихся, игровой момент, тестирование.
План урока.
1. Организационный момент.
• Проверка явки учащихся
2. Актуализация знаний учащихся.
• Проверка имеющихся знаний и умений
• Подготовка к изучению новой темы.
3. Изучение нового материала.
• Из истории изучения жиров
• Состав строение, номенклатура
• Применение жиров и мыла
4. Игра “Чёрный ящик”.
5. Первичное закрепление пройденного материала.
• Решение тестовых заданий
7. Домашнее задание.
Ход урока
I. Организационный момент.
2. Актуализация знаний учащихся.
Вы знаете, что есть такое тяжелое детское заболевание – рахит. Оказывается и его профилактика и лечение не обходятся без жира, а именно, хорошо знакомого вам рыбьего жира. Что же это за вещества – жиры, которые играют в нашей жизни такую большую роль? Вот о них и пойдет речь на сегодняшнем уроке. Итак, тема урока: “Жиры. Мыла”.
Фронтальный опрос.
1. Какие вещества называются многоатомными спиртами? Приведите примеры спиртов.
2. Какие вещества называются карбоновыми кислотами? Приведите примеры высших карбоновых кислот (предельных и непредельных).
3. Какие вещества называются сложными эфирами?
4. Какие свойства характерны для сложных эфиров?
5. Что такое реакция этерификации?
3. Изучение нового материала.
Вот теперь мы можем поговорить о жирах. С жирами вы сталкиваетесь каждый день. В школьном курсе на изучение темы отводится один урок. О биологической роли жиров вы узнали в курсе “Общая биология”. На этом уроке вы получите представление о жирах и мылах как о химических соединениях, их свойствах, способах их переработки, применении. Приобретёте некоторые практические советы.
Из истории изучения жиров.
Жиры наряду с углеводами и белками являются ценным пищевым продуктом. Для здорового организма человека суточная потребность жира составляет 70-100 г. Избыток жиров в организме человека является одной из основных причин многих заболеваний, в частности, особенно сердечно — сосудистых, ожирения.
Люди очень давно научились выделять жир из натуральных объектов и использовать его в повседневной жизни. Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым в воду спускали суда; атлеты древней Эллады натирали растительными маслами обнаженный тела, чтобы сделать кожу более эластичной.
Химикам очень давно хотелось разобраться в том, что же собой представляет жир. Однако лишь в 1779 году великий шведский химик К. Шееле приблизился к решению этой задачи. Нагревая оливковое масло с оксидом свинца, он получил осадок и какое-то сладкое, растворимое в воде вещество. Он назвал его “жировым сахаром”. Только через 45 лет французский химик М. Шеврель определил строение этого жирового сахара и назвал его глицерином (от греч. “гликос” — сладкий). Он же доказал, что осадок представляет собой свинцовые соли так называемых жирных кислот.
Состав, строение жиров.
Жиры – это смесь сложных эфиров, образованных трехатомным спиртом (глицерином) и жирными кислотами, имеющих в углеводородном радикале от 4 до 24 атомов углерода.
Кислоты, содержащиеся в природных жирах, являются монокарбоновыми с нормальной цепью и четным числом атомов углерода (за некоторым исключением).
Из всех непредельных кислот, содержащихся в природных жирах, наиболее распространены:
- олеиновая кислота С17Н33СООН,
- линолевая кислота С17Н31СООН,
- линоленовая кислота С17Н29СООН.
- Из предельных кислот распространены:
- пальмитиновая кислота С15Н31СООН,
- стеариновая кислота С17Н35СООН,
- миристиновая кислота С13Н27СООН.
Номенклатура.
По систематической номенклатуре жиры называют триацилглицеринами. У ацилов суффикс – оил (ленолеоил, пальмитоил, стеароил и т.д.)
Классификация жиров.
Жиры можно классифицировать по составу на простые — если все ацильные остатки одинаковые, и смешанные — если ацильные остатки разные.
Жиры можно классифицировать по происхождению на животные и растительные. Растительные жиры называют маслами.
Жиры можно разделить на жидкие (большинство растительных масел, жиры рыб и морских млекопитающих) и твердые (жиры наземных животных, кокосовое масло). Жидкие жиры содержат 70-85% непредельных кислот, а твердые жиры содержат около 50 % и более предельных кислот.
Растительные жиры (масла) делят на:
— высыхающие, т.е. окисляющиеся и затвердевающие на воздухе (имеющие две или более двойные связи: льняное, маковое, конопляное масло).
— полувысыхающие, (имеющие одну-две двойные связи: подсолнечное, соевое, хлопковое масло).
— невысыхающие, (имеющие одну двойную связь: арахисовое, касторовое, оливковое, пальмовое, кокосовое масло).
Какие физические свойства жиров вы знаете и можете назвать?
Да. Жиры — это жидкие, мазеобразные или твердые вещества, легкоплавкие, нерастворимы в воде, хорошо растворимы в неполярных растворителях (ацетоне, бензине, тетрахлорметане), плохо — в низших спиртах. Не имеют точки плавления, плавятся в интервале температур, так как представляют собой смеси разных молекул. Не кипят при обычных условиях, при высоких температурах разлагаются. Эмульгируются щелочами. Плотность жиров меньше 1 г/мл.
Эксперимент: в три пробирки налить по 5 мл воды, ацетона, раствора гидроксида натрия и добавить в них по нескольку капель растительного масла. Учащиеся наблюдают, что происходит при встряхивании пробирок. После обсуждения эксперимента учащиеся записывают вывод в тетрадь о физических свойствах жиров: нерастворимы в воде, легче воды, хорошо растворяются в органических растворителях, эмульгируются щелочами.
Химические свойства жиров.
1). Каждый слышал такую фразу: при физической нагрузке человек сжигает жир. Выражение образное, но не лишено химического смысла. Мы уже вспомнили, что при расщеплении и окислении жиров в организме выделяется значительное количество энергии, необходимой для протекания жизненно важных эндотермических процессов поддержания постоянной температуры тела. Т.е жиры, как большинство органических соединений горят.
Эксперимент: в форфоровой чашке налито несколько мл растительного масла и помещен фитиль. Фитиль поджечь. Жир горит ярким сильно коптящим пламенем.
До 19в. для освещения улиц и домов использовали китовый жир и сало. Помимо того, что пищевое сырье использовалось для технических целей, это привело к массовому истреблению редких животных.
2). Двойные связи непредельных кислот, входящих в состав жира, могут быть прогидрированы в присутствии никелевых катализаторов. Продукты гидрирования известны под названием салолин, саломас. Гидрогенизацией некоторых распространенных растительных масел (арахисовое, соевое, хлопковое) получают пищевые жиры, например маргарины.
Сравните цены 1 л растительного масла и 1 кг животного жира. Твердые жиры более дорогостоящи и ценны. По химическому составу они отличаются лишь наличием двойных С = С связей в углеводородных радикалах жидких жиров.
Эксперимент: 3 капли растительного масла + 2 капли Na2СО3 + 2 капли раствора KMnO4 встряхивают. Малиновая окраска исчезает. Значит произошло обесцвечивание раствора KMnO4, что показало и доказало наличие кратных связей в растительных жирах.
Впервые маргарин появился на свет более 100 лет назад для обозначения продукта, полученного французским химиком Меж-Мурье в 1869 году. Император Франции Наполеон III пообещал крупный приз тому, кто сумеет найти дешевый заменитель сливочного масла в рационе солдат. Меж-Мурье предложил схему производства, сохранившуюся в своей основе вплоть до наших дней. Он представил на конкурс продукт, который был назван маргарином потому, что в его составе предполагалось преобладание маргариновой кислоты С16Н33 СООН. В выборе названия немалое значение имел и внешний вид полупрозрачной голубоватой массы продукта (от греч. “маргон” — жемчуг).
В 1930 году маргарин начали получать в СССР.
Маргарин – это твердый жир, содержащий только остатки предельных карбоновых кислот. Поэтому маргарин не будет проявлять свойства непредельных углеводородов.
Сливочное масло – содержит остатки непредельных кислот, поэтому будет обесцвечивать бромную воду или раствор перманганата калия.
Представьте, что вы частный предприниматель в сфере торговли и собираетесь закупить оптовую партию сливочного масла. Сейчас много недобросовестных производителей, которые фальсифицируют пищевые продукты, и сливочное масло часто становится объектом фальсификации. К нему подмешивают более дешевые продукты: маргарин или растительные масла. Обнаружить подделку и доказать её можно с помощью сложных и дорогостоящих анализов. Но есть и такие признаки, которые можно обнаружить и без всяких анализов и которые должны насторожить вас при покупке. Какие это признаки?
Эксперимент: опустить в раствор KMnO4 кусочек исследуемого жира, если раствор обесцветился, значит – это сливочное масло, если не обесцветился, значит это маргарин.
3). Одним из важнейших свойств жиров, как и других сложных эфиров, является реакция гидролиза – (гидро – вода, лиз – разрушение). В незначительной степени гидролиз протекает и при хранении жира под действием влаги, света и тепла. Жир становится прогорклым — т.е. приобретает неприятный вкус и запах, обусловленный образующимися кислотами:
Данная реакция является обратимой. Для получения глицерина и жирных кислот реакцию проводят в кислой среде при кипячении или под давлением.
4). Среди реакций жиров особое значение имеет гидролиз, идущий в присутствии оснований. Щелочной гидролиз называют омылением. Он в отличии от кислотного необратим, и в результате его получаются щелочные соли высших карбоновых кислот – мыла.
Мыло – щелочная соль высших карбоновых кислот.
Жидкое мыло образовано солями калия, а твердое мыло – солями натрия.
Хозяйственное мыло предназначено для стирки. Его качество в соответствии с назначением определяется содержанием жирных кислот, массовая доля которых (в %) отпечатывается на одной из граней куска: чем она выше, тем обильнее пена, тем лучше моет и стирает мыло. Вторым критерием качества является наличие свободной щелочи. Вот здесь, наоборот: чем меньше ее, тем лучше – ведь щелочь вредна и для кожи человека, и для тканей, особенно шерсти и шелка. В последние годы хозяйственное мыло получают из синтетических жирных кислот.
Для получения мыла высших сортов ядровое мыло, образующееся в начальной стадии технологического процесса, высушивают, перетирают 2 – 3 раза на вальцах, смешивают с добавками (отдушка, красители, смягчители кожи) и формирую куски туалетного, банного, детского мыла. В таком продукте массовая доля жирных кислот достигает 80%.
А что было до этого, чем мылись раньше? В древности женщины на Руси, стремясь сохранить пушистость, мягкость и блеск волос, пользовались таким рецептом: в дубовом ведре тщательно размешивается со свежей ключевой или дождевой водой ковш золы, да не простой, а лучше еловой или от подсолнечника, постоит такая смесь сутки. Процедит осторожно через чистую тряпочку или сольет девушка воду с осадка, разведет ее чистой водой, подогреет в рубленой бане и вымоет свои прекрасные волосы. В золе содержится много карбонат — ионов и ионов калия, что создает в ее водном растворе щелочную среду и способствует умягчению воды за счет выведения ионов кальция и магния в виде нерастворимых веществ. Такой раствор при стирке или при мытье волос продолжает гидролизоваться, разрушая жиры. В результате получается хорошо растворимый в воде глицерин. Анионы же высшей жирной кислоты вместе с иными видами загрязнений образуют эмульсию, которая выносится раствором при ополаскивании.
В Европу мыло проникло в семнадцатом веке. Доступно оно было не всем, так как было дорогое. Настоящая мыловаренная промышленность развилась в первой половине девятнадцатого века благодаря трудам французского химика М.Шевреля.
Из курса истории вы помните, что во время великой Отечественной войны Ленинград (а ныне Санкт-Петербург) был блокирован гитлеровцами почти на 2.5 года. Все было в Ленинграде за это время: голод, холод, нехватка лекарств, но удивительно, что не было эпидемий инфекционных заболеваний, которые обычно сопутствуют таким жизненно тяжелым ситуациям. А помогло ленинградцам то, что они сами варили мыло как дезинфицирующее средство из жиров различных животных – собак, крыс, кошек.
Мыловарение – один из самых древних химических процессов, стоящих на службе человека. Уже в 1в. использовали процесс омыления для получения твердых и жидких мылоподобных продуктов путем кипячения жиров с золой наземных растений (содержащих соли калия) или морских водорослей (содержащих соли натрия). Натриевые соли высших карбоновых кислот имеют твердое агрегатное состояние, а калиевые – жидкое.
“Мыло душистое” в быту незаменимо. Но и оно не без недостатков: плохо мылится в жесткой воде, а при стирке в такой воде на белой одежде остается сероватый налет. Жёсткая вода содержит катионы Са 2+ и Mg 2+ . В такой воде мыло теряет моющую способность. Кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде. Вместо пены они образуют хлопья (осадок) и мыло расходуется бесполезно:
2C17 H35 COONa + Ca 2+ —> (C17 H35 COO)2 Ca
+ 2Na +
Этого недостатка лишены синтетические моющие средства, представляющие собой натриевые соли высших сульфокислот или алкилбензолсульфокислот. Принцип действия синтетических моющих средств точно такой же, как и у мыла, однако они имеют некоторые преимущества:
— не теряют моющую способность в жесткой воде;
— не разъедают руки, т.к. не дают щелочной реакции в растворе.
Но остатки синтетических моющих средств в сточной воде очень медленно разлагаются биологическим путем и вызывают загрязнение окружающей среды.
5). Весьма важными являются реакции полимеризации масел. По этому признаку растительные масла делят на высыхающие, полувысыхающие и невысыхающие. Высыхающие в тонком слое образуют блестящие тонкие пленки. На этом основано использование этих масел для приготовления лаков и красок.
Практические советы.
Вам надо удалить пятно от подсолнечного масла. Растительное масло хорошо растворяется в бензине или керосине.
Если вы за праздничным столом посадили на одежду жирное пятно и не можете заняться его выведением, рекомендуется немедленно засыпать пятно солью. Соль адсорбирует жиры. Можно также воспользоваться с этой целью зубным порошком.
При старении пятна растительного масла, особенно на свету и при повышенных температурах, образуются прочные полимерные соединения, также за счет двойных связей происходит взаимодействие молекул жира с молекулами ткани. Вывести такое пятно очень трудно, поэтому жирное пятно выводите сразу сами или в “Еврочистке”.
Получение жиров.
Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, гуси, киты, тюлени, рыбы: акула, тресковые, сельди. Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельдевых – жиры, используемые для подкормки сельскохозяйственных животных.
Источниками масел являются растения: хлопка, льна, сои, арахиса, кунжута, рапса, горчицы, оливы, подсолнечника, конопли, клещевины, мака, масличной пальмы, кокоса и многих других.
Из живых организмов и растений жиры получают:
- Вытапливанием
- Экстрагированием
- Прессованием
- Сепаратированием
- Гидрированием жиров в технике.
Применение жиров и мыла.
Жиры используются в пищу.
Некоторые масла используются для изготовления косметических средств (кремов, масок, мазей).
Ряд жиров имеет лекарственное значение: касторовое, облепиховое масло, рыбий и гусиный жир.
Жиры сельдевых рыб используются для подкормки сельскохозяйственных животных.
Высыхающие растительные масла используются для производства олиф.
Сырьем для производства маргарина являются многие растительные масла и китовый жир.
Животные жиры идут для производства мыла, стеариновых свечей.
Жиры используются для получения глицерина и смазочных материалов. Однако использование пищевых продуктов как химического сырья – непозволительная роскошь. Поэтому химики разработали процессы, позволяющие использовать для получения, например, высших карбоновых кислот парафина.
Мыло в быту и промышленности все чаще заменяется на синтетические моющие средства.
4. Игра “Чёрный ящик”.
В закрытой коробке находится нечто, относящееся к теме “Жиры”. Учитель предлагает узнать, что лежит в коробке. Учащиеся задают вопросы, на которые можно ответить только “да” или “нет”. Нужно достичь цели, задав учителю наименьшее число вопросов.
Учитель может положить в коробку продукты переработки жиров, глицерин, карбоновую кислоту, входящую в состав жиров, какое-нибудь масло. Например, в коробке находится мыло.
Вопросы могут быть следующими:
- Это жир? — Нет.
- Это продукт его переработки? — Да.
- Это твердое? — Да.
- Это растворимое? — Да.
- Это используется для стирки? — Да.
- Это мыло? — Да.
5. Первичное закрепление пройденного материала.
В течение 3 минут просмотреть конспект и ответить на вопросы теста (приложение 1).
6. Рефлексия.
Учащимся предлагается оценить свою деятельность на уроке, дать оценку полученным знаниям, их значимости в дальнейшей деятельности.
- Сегодня я узнал.
- Было интересно.
- Было трудно.
- Я приобрел.
- Я научился.
- Меня удивило.
- Урок дал мне для жизни.
7. Домашнее задание: параграф 34, стр.165 № 8,12,14 (уч. Цветков Л.А.)
http://chemege.ru/zhiry-belki-uglevody/
http://urok.1sept.ru/articles/647211
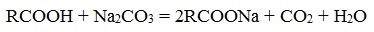

































 + 2Na +
+ 2Na +