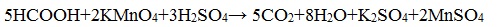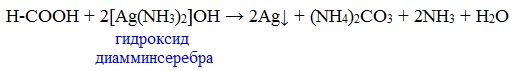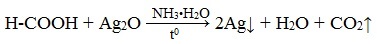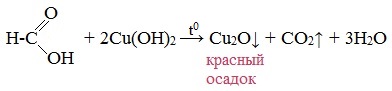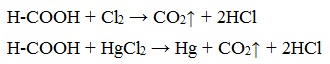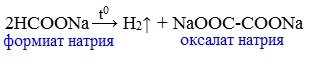Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Пропионовая кислота: свойства, польза и вред, реакции, применениеПропионовая кислота – это соединение, которое наиболее часто используется в качестве пищевой добавки-консерванта, препятствующего развитию патогенной микрофлоры. Вещество бесцветное, но с отчетливым неприятным запахом. Пропионовую кислоту называют также пропановой и метилуксусной кислотой. В промышленности применяется искусственно синтезированная пищевая добавка Е280; в природе она встречается, но добывать кислоту из естественных источников нецелесообразно. Впервые рассматриваемый реагент был получен в конце 19 века в Германии – открытие принадлежит авторству немецкого ученого Йохана Готлиба. Он зафиксировал присутствие кислоты в продуктах распада сахаров. Что такое пропионовая кислота: ее особенностиПропионовая кислота – это жидкость без цвета с характерным запахом. Вещество легко соединяется с обычной водой вне зависимости от ее количества и температуры, а также с органическими растворителями. Реактив широко применяется на предприятиях, специализирующихся на изготовлении средств для борьбы с сорняками, производстве медикаментов, душистых веществ, изделий из пластмасс и растворителей. В продуктах питания пропионовая кислота выступает в роли консерванта, препятствующего порче пищи. Ее также добавляют в корма для животных, в них соединение выполняет аналогичные функции. В зависимости от сферы применения и особенностей вещества данную кислоту относят к классу:
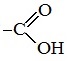
Пропионовая кислота, с точки зрения химической промышленности, – это одноосновная предельная карбоновая кислота. При работе с ней крайне важно использовать средства индивидуальной защиты: маски, перчатки, халаты. При попадании на кожу пропановая кислота может вызывать серьезные ожоги. В продуктах питания пропионовая кислота полностью безопасна: попадая в желудочно-кишечный тракт, она распадается на метаболиты, которые впоследствии легко выводятся из организма естественным путем. Формула пропионовой кислоты и ее основные свойстваЭмпирическая формула метилуксусной кислоты: C3H6O2 Вещество представляет собой одноосновную предельную карбоновую кислоту. В нормальных условиях вещество выглядит как прозрачная жидкость. Кислота едкая, обладает сильным неприятным запахом. Температура плавления реагента -21˚С. Температура воспламенения – 440˚С. Вспыхнуть кислота может и при меньшей температуре, однако поддерживать горение не сможет. Молярная масса – 74 г/моль. Пропионовая кислота легко растворяется в воде и органических растворителях. Стоит отметить, что при смешивании рассматриваемого соединения с водой, его запах становится менее выразительным. Молекула пропионовой кислоты Получение пропионовой кислотыКак уже было сказано выше, впервые пропионовая кислота была получена в конце 19 столетия, а именно – в 1844 году в Германии. Особого внимания вещество тогда не получило, а к его изучению вернулись только спустя 3 года – в 1847 году. Исследованиями кислоты занимался французский химик Жан-Батист Дюма, который, еще не зная о работе немецких ученых, самостоятельно синтезировал соединение. Натуральная пропионовая кислота вырабатывается в процессе жизнедеятельности бактерий Propionibacterium, находящихся в кишечнике каждого человека. Помимо этого, пропановая кислота является компонентом нефти. Однако, ни один из естественных источников не годится для промышленного применения вещества. В промышленных масштабах вещество добывают методом гидрокарбоксилирования этилового спирта. Реакция протекает при температуре в диапазоне от 270 до 320˚С и давлении на отметке 25-30 Мпа. В качестве катализатора применяются карбонилы никеля. В ходе реакции достигается максимальный выход пропановой кислоты – 95%. Данный метод считается наиболее эффективным, однако и у него есть свои недостатки: строгие условия, необходимые для правильного протекания синтеза; необходимость применения высококанцерогенных соединений (карбонилов никеля). В Санкт-Петербурге на базе описанной выше реакции был разработан новый способ производства соединения, предполагающий использование кобальт-пиридинового комплекса. Реакция протекает в одну стадию, в относительно мягких условиях: при температуре в диапазоне от 150 до 170˚С и давлении 5-15 Мпа. В качестве катализатора в данном способе применяется кобальткарбонилпиридиновый комплекс. Выход кислоты в результате синтеза несколько меньше, чем в предыдущем методе – он составляет 92%: Новая методика получения пропионовой кислоты позволила исключить необходимость применения коррозионных агентов и канцерогенных веществ, а также снизить материальные затраты на добычу соединения. Существуют и другие, менее популярные, способы получения пропионовой кислоты. Так, например, иногда специалисты применяют метод парафазного окисления углеводорода. Реакция протекает при температуре 1000˚С. Реакции с пропионовой кислотойПропионовая кислота легко вступает в реакции с металлами, их оксидами и гидроксидами: При взаимодействии с солями пропионовая кислота вытесняет более слабую кислоту: Пропановая кислота способна вступать в реакцию этерификации: При попадании в водный раствор пропионовая кислота диссоциирует: Сферы применения пропионовой кислотыПропионовая кислота востребована во многих сферах: ее используют в производстве продуктов питания, в фармацевтике, в тяжелой промышленности. В пищевой промышленности пропановая кислота известна под индексом Е280. Она используется в роли консерванта, позволяющего значительно увеличить срок хранения производимой продукции. В составе косметических средств пропионовая кислота применяется для уменьшения сыпи и борьбы с грибками, которые ее вызывают. В сельском хозяйстве кислота служит основой для гербицидов – специальных средств, препятствующих росту сорняков. В качестве химического реагента пропионовая кислота помогает скрывать неприятный запах – при взаимодействии с сильно пахнущими эфирами соединение не только уменьшает исходящий от них запах, но и теряет свой. Кроме того, пропионовую кислоту используют при изготовлении:
Пропионовая кислота в пищевой промышленностиПропионовая кислота обладает ярко выраженными бактерицидными и фунгицидными свойствами. Другими словами, она способно препятствовать развитию патогенных микроорганизмов, продлевая тем самым срок хранения продуктов питания. Именно поэтому многие производители вводят в состав своей продукции консервант под индексом Е280. Кроме того, пищевая добавка применяется в составе кормов для крупного скота, где она также выполняет роль консерванта. В России существуют определенные требования к объемам используемой пропионовой кислоты:
Помимо хлебобулочных изделий, пропионовая кислота широко применяется в производстве молочной продукции. Химическая промышленностьПропионовая кислота широко применяется для производства других химических соединений. Так, она выступает промежуточным продуктом в реакциях синтеза многих полимеров и пестицидов. В реакциях со сложными эфирами пропановая кислота отвечает за нейтрализацию неприятных запахов. ФармакологияПропионовая кислота входит в состав нестероидных противовоспалительных препаратов, обладающих обезболивающими, противовоспалительными и жаропонижающими свойствами. Медикаменты с такой добавкой способны снимать болевые ощущения, облегчать состояние при лихорадках и воспалениях. Влияние пропионовой кислоты на организм человекаПропионовая кислота в качестве пищевой добавки разрешена во многих странах Европы, Америке, Канаде и России. В некоторых странах существуют рекомендации относительно объема использования добавки. Исследования, проведенные учеными по всему миру, доказали безвредность пищевой добавки Е280 для человеческого организма: оно не обладает мутагенными, токсичными и канцерогенными свойствами. Пропионовая кислота не скапливается в организме и легко выводится из него естественным путем. Польза пропионовой кислотыПропионовая кислота способна выполнять следующие функции:
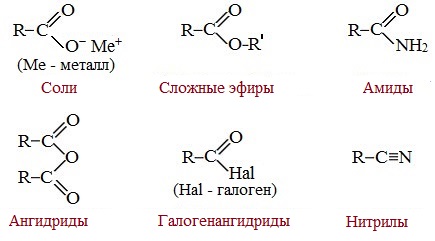
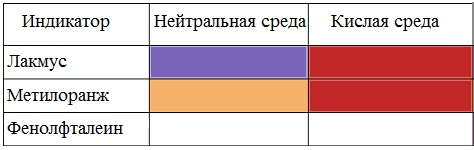
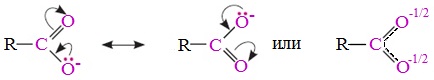
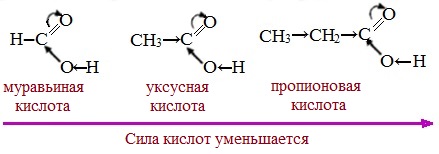
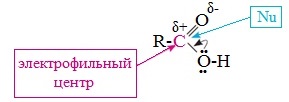
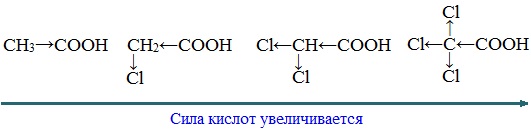
Вред пропионовой кислотыНаибольший вред пропионовая кислота оказывает при работе с ней. Контакт с веществом на производстве может стать причиной серьезных ожогов, поэтому химики используют средства индивидуальной защиты. Противопоказания к употреблению пропионовой кислотыКак таковых противопоказаний к употреблению пищевой добавки Е280. Как показали многочисленные исследования, в небольших количествах оно полностью безопасно и неспособно нанести вред здоровью. Однако ограничить его потребление рекомендовано беременным и кормящим женщинам, а также маленьким детям. Существуют сведения о том, что данная кислота может стать причиной образования и развития злокачественных новообразований, однако никаких подтверждений этой информации нет. Класс опасности пропионовой кислоты и правила ее храненияПропионовая кислота принадлежит к 3 классу опасности – то есть, к умеренно опасным соединениям. Предельная концентрация веществ данной категории в воздухе составляет 10 миллиграмм на 1 м 3 . Хранить пропионовую кислоту необходимо в герметичной таре в хорошо вентилируемых сухих помещениях при температуре не выше 30˚С. Срок годности пищевой добавки Е280 – 3 года. Не допускается совместное хранение пропионовой кислоты с легковоспламеняющимися веществами, а также неорганическими соединениями, имеющими сильные окислительные свойства. Все работы с пропионовой кислотой должны осуществляться с применением индивидуальной защиты. Где купить пропионовую кислоту и сколько она стоитПриобретать пропионовую кислоту лучше всего у немецких производителей. За килограмм реагента они, как правило просят 200-250 рублей. За кислоту, применяемую для анализов, придется заплатить немного больше – 300-350 рублей. ЗаключениеПропионовая кислота – это бесцветная едкая жидкость с резким запахом. Она широко применяется в пищевой и фармацевтической промышленности, а также сельском хозяйстве. В составе продуктов питания пропионовую кислоту обозначают индексом Е280. Встретить ее можно в мучных и молочных изделиях. В продуктах питания пищевая добавка содержится в небольших концентрациях и полностью безопасно для человека, а вот при работе с ним в химических лабораториях важно использовать средства индивидуальной защиты, дабы уберечь кожу от ожогов. Уравнение горения пропионовой кислоты в кислородеДля насыщенных монокарбоновых кислот характерна высокая реакционная способность. Она определяется в основном наличием в их структуре карбоксильной группы. Карбоксильная группа представляет собой сопряженную систему, в которой неподеленная пара электронов атома кислорода гидроксильной группы вступает в сопряжение с π-электронами карбонильной группы (р,π-сопряжение). Вследствие +М-эффекта со стороны группы –ОН электронная плотность в сопряженной системе смещена в сторону атома кислорода карбонильной группы Но в то же время за счет +М-эффекта со стороны группы –ОН в молекулах карбоновых кислот в некоторой степени уменьшается частичный положительный заряд (δ+) на атоме углерода карбонильной группы по сравнению с альдегидами и кетонами. Кроме того, вследствие –I-эффекта карбоксильной группы в молекуле карбоновой кислоты происходит смещение электронной плотности с углеводородного остатка, что приводит к появлению СН-кислотного центра у α-углеродного атома. Исходя из строения, в молекулах карбоновых кислот можно выделить реакционные центры, определяющие возможные реакции с их участием. 1. Кислотные свойства кабоновых кислот проявляются в реакциях с основаниями за счет ОН-кислотного центра. 2. С участием электрофильного центра (атома углерода карбоксильной группы) происходят реакции нуклеофильного замещения в карбоновых кислотах и их функциональных производных. 3. Основный центр – карбонильная группа (оксогруппа) со своей электронной парой – протонируется на стадии катализа в реакциях нуклеофильного замещения. 4. СН-кислотный центр определяет возможность замещения атома водорода в алкильном радикале и реакции конденсации. Карбоновые кислоты вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе. I. Реакции с разрывом связи О-Н(кислотные свойства карбоновых кислот обусловлены подвижностью атома водорода карбоксильной группы и их способностью отщеплять его в виде протона) Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот. Карбоновые кислоты изменяют окраску индикаторов. 1. Диссоциация В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: они диссоциируют с образованием протона (Н + ) и кислотного остатка (карбоксилат-иона): Уравнение реакции, учитывающее участие молекулы воды: Растворы карбоновых кислот изменяют окраску индикаторов, имеют кислый вкус, проводят электрический ток. В карбоксилат-ионе оба атома кислорода равноценны, а отрицательный заряд равномерно делокализован (рассредоточен) между ними. В результате делокализации отрицательного заряда карбоксилат-ион обладает высокой устойчивостью. Сила кислоты определяется устойчивостью образующегося аниона, поэтому карбоновые кислоты превосходят по кислотным свойствам спирты и фенолы, где возможность делокализации заряда в анионе меньшая. Тем не менее, монокарбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа –СООН связана с атомом водорода. Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индукционного эффекта. Алкильные радикалы, связанные с карбоксильной группой, обладают положительным индукционным эффектом (+І). Они отталкивают от себя электронную плотность, тем самым уменьшая частичный положительный заряд (δ+) на атоме углерода карбоксильной группы. Положительный индукционный эффект возрастает по мере увеличения длины углеводородного радикала, что в свою очередь ослабляет полярность связи О-Н. Алкильные группы понижают кислотность. В гомологическом ряду предельных монокарбоновых кислот кислотные свойства уменьшаются от муравьиной кислоты к высшим карбоновым кислотам. Такие заместители, как хлор или фенильный радикал, оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индукционный эффект (— I). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. Карбоновые кислоты – слабые электролиты. Равновесие процесса диссоциации сильно смещено влево, об этом свидетельствует тот факт, что даже сильноразбавленные водные растворы кислот имеют резкий запах. Видеоопыт «Растворимость в воде различных карбоновых кислот» Видеоопыт «Карбоновые кислоты — слабые электролиты» 2. Образование солей Карбоновые кислоты проявляют все свойства минеральных кислот. Карбоновые кислоты при взаимодействии с активными металлами, основными оксидами, основаниями и солями слабых кислот образую соли. а) взаимодействие с активными металлами Цинк и уксусная кислота
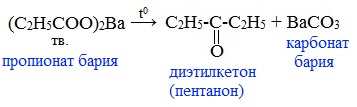
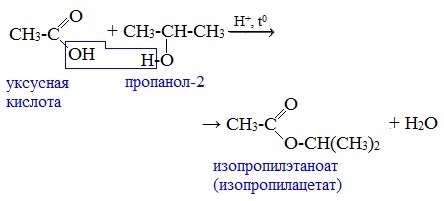
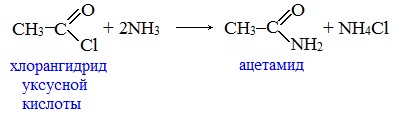
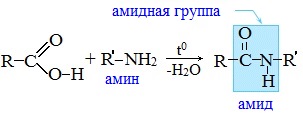
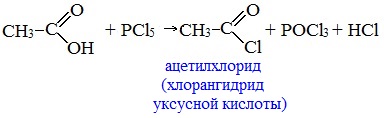
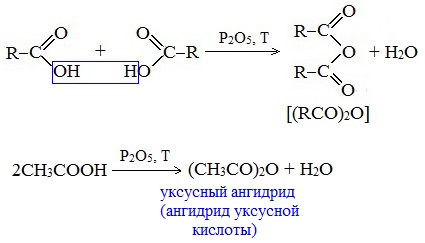
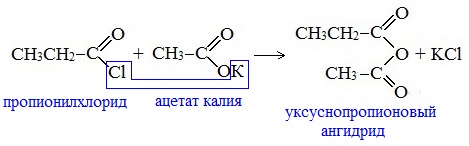
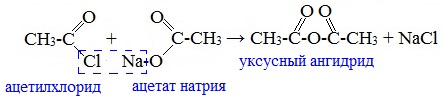
Видеоопыт «Взаимодействие уксусной кислоты с металлами» б) взаимодействие c основаниями (реакция нейтрализации) Видеоопыт «Взаимодействие уксусной кислоты с раствором щелочи» в) взаимодействие с основными и амофтерными оксидами Оксид меди(II) и уксусная кислота Видеоопыт «Взаимодействие уксусной кислоты с оксидом меди (II)» г) взаимодействие с солями более слабых кислот Видеоопыт «Взаимодействие уксусной кислоты с карбонатом натрия» д) взаимодействие с аммиаком или гидроксидом аммония Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п. Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных. Видеоопыт «Свойства карбоновых кислот» Свойства солей карбоновых кислот1) Взаимодействие с сильными кислотами Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей. Из неорганических кислот лишь угольная кислота слабее рассматриваемых кислот и может вытесняться ими из её солей — карбонатов и гидрокарбонатов. Качественная реакция на ацетат-ион СН3СОО — ! Запах уксусной кислоты. 2) Гидролиз по аниону Натриевыс и калиевые соли карбоновых кислот в водных растворах находятся частично в гидролизованном состояния. Этим объясняется щелочная реакция мыльного раствора. Видеоопыт «Гидролиз ацетата натрия» 3) Электролиз солей активных металлов (реакция Кольбе) Одним из применений солей карбоновых кислот является электролиз их водных растворов, в результате которого образуются насыщенные углеводороды: Электролизом раствора соли карбоновой кислоты можно получить алкан с удлиненной цепью. 4) Пиролиз солей карбоновых кислот При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны: 4) Декарбоксилирование солей щелочных металлов (реакция Дюма) В процессе сплавления солей карбоновых кислот с твердой щелочью происходит расщепление углеродной связи и образуются алканы с числом атомов углерода на один меньше, чем у исходной кислоты: II. Реакции с разрывом связи C-ОПониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы –ОН с образованием функциональных производных карбоновых кислот (сложных эфиров, амидов, ангидридов и галогенангидридов). 1. Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации) Карбоновые кислоты при нагревании в присутствии кислотного катализатора реагируют со спиртами, образуя сложные эфиры: Механизм этой реакции был установлен методом меченых атомов. С этой целью использовали спирт, меченный изотопом кислорода 18 О. После реакции изотоп кислорода был обнаружен в молекуле сложного эфира. 2. Взаимодействие с аммиаком с образованием амидов Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают: Вместо карбоновых кислот чаще используют их галогенангидриды: Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами): Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из α-аминокислот с участием амидных групп — пептидных связей. 3. Взаимодействие с галогенидами фосфора или тионилхлоридом с образованием галогенангидридов карбоновых кислот Наибольшее значение имеют хлорангидриды. Хлорирующие реагенты –галогениды фосфора PCl3, PCl5, тионилхлорид SOCl2. Для получения хлорангидридов чаще используют тионилхлорид, так как в этом случае образуются газообразные побочные продукты. Галогенангидриды карбоновых кислот — весьма реакционноспособные вещества, широко применяемые в органическом синтезе. 4. Образование ангидридов кислот (межмолекулярная дегидратация) Ангидриды кислот образуются в результате межмолекулярной дегидратации кислот при их нагревании в присутствии оксида фосфора (V) в качестве водоотнимающего средства.
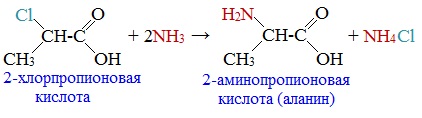
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты с безводной солью другой карбоновой кислоты: Муравьиная кислота не образует ангидрида. Дегидратация ее приводит к образованию оксида углерода (II). Наиболее широкое применение находит уксусный ангидрид. Большое количество его расходуется для синтеза ацетилцеллюлозы, которая идет на изготовление искусственного шелка. Уксусный ангидрид используется также для получения аспирина. III. Реакции с разрывом связи C-Н у ɑ-углеродного атома(реакции с участием радикала) 1. Реакции замещения (с галогенами) Атомы водорода у ɑ-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты и могут замещаться на атомы галогена с образование ɑ-галогенкарбоновых кислот. Карбоновые кислоты взаимодействуют с галогенами в присутствии красного фосфора (реакция Геля-Фольгарда-Зелинского): 2-Хлорпропионовая кислота – промежуточный продукт для получения аминокислот. Действием на 2-хлорпропионовую кислоту аммиака получают 2-аминопропионовую кислоту (аланин):
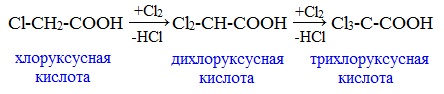
Дальнейшее хлорирование приводит к образованию дихлоруксусной и трихлоруксусной кислот:
В атмосфере кислорода карбоновые кислоты сгорают с образованием оксида углерода (IV) СО2 и Н2О: Видеоопыт «Горение уксусной кислоты на воздухе» В отличие от альдегидов, карбоновые кислоты достаточно устойчивы к действию даже такого сильного окислителя, как перманганат калия. Исключение составляет муравьиная кислота, которая проявляет восстановительные свойства благодаря наличию альдегидной группы. V. Реакции каталитического восстановленияКарбоновые кислоты с трудом восстанавливаются каталитическим гид-рированием, однако при взаимодействии с алюмогидридом лития (LiAlH4) или дибораном (В2Н6) восстановление осуществляется достаточно энергично: Особенности строения и свойства муравьиной кислоты
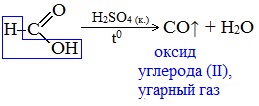
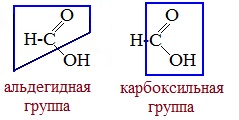
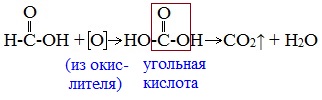
В отличие от других карбоновых кислот в молекуле муравьиной кислоты функциональная карбоксильная группа связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиная кислота является более сильной кислотой по сравнению с другими членами своего гомологического ряда. Все предельные карбоновые кислоты устойчивы к действия концентрированной серной и азотной кислот. Но муравьиная кислота при нагревании с концентрированной серной кислотой разлагается на воду и монооксид углерода (угарный газ). 1. Разложение при нагревании При нагревании с концентрированной H2SO4 муравьиная кислота разлагается на оксид углерода (II) и воду: Данную реакцию используют в лаборатории для получения чистого оксида углерода (II). Видеоопыт «Разложение муравьиной кислоты» Молекула муравьиной кислоты, в отличие от других карбоновых кислот, наряду с карбоксильной группой содержит в своей структуре и альдегидную группу. Поэтому муравьиная кислота вступает в реакции, характерные как для кислот, так и для альдегидов. Как и альдегиды, НСООН проявляет восстановительные свойства. Проявляя свойства альдегида, муравьиная кислота легко окисляется до угольной кислоты: 2. Окисление перманганатом калия Видеоопыт «Окисление муравьиной кислоты раствором перманганата калия» Муравьиная кислота окисляется аммиачным раствором Ag2О и гидроксидом меди (II) Cu (OH)2, т.е. дает качественные реакции на альдегидную группу! 3. Реакция «серебряного зеркала» или в упрощенном виде 4. Окисление гидроксидом меди (II) 5. Окисление хлором, хлоридом ртути Муравьиная кислота окисляется и другими окислителями (Сl2, HgCl2). Формиаты щелочных металлов при сплавлении образуют соли щавелевой кислоты — оксалаты: Видеоопыт «Взаимодействие бромной воды с олеиновой кислотой» источники: http://chtoikak.ru/propionovaya-kislota.html http://himija-online.ru/organicheskaya-ximiya/karbonovye-kisloty/ximicheskie-svojstva-karbonovyx-kislot.html |


 неподеленные пары электронов которого не участвуют в сопряжении. В результате смещения электронной плотности связь О-Н оказывается сильно поляризованной (по сравнению со спиртами и фенолами), что приводит к появлению в карбоксильной группе ОН-кислотного центра.
неподеленные пары электронов которого не участвуют в сопряжении. В результате смещения электронной плотности связь О-Н оказывается сильно поляризованной (по сравнению со спиртами и фенолами), что приводит к появлению в карбоксильной группе ОН-кислотного центра.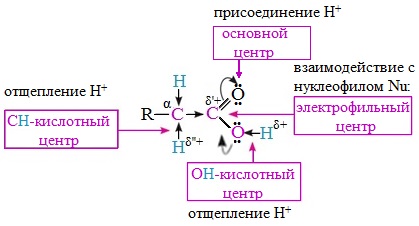
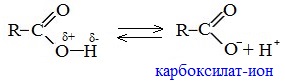
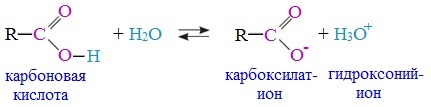
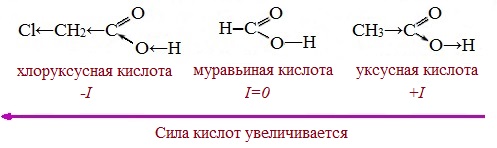
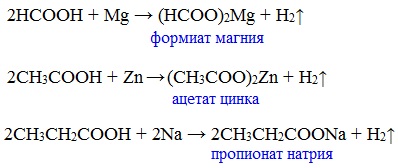

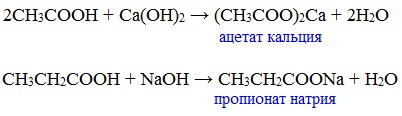
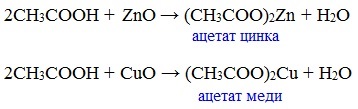

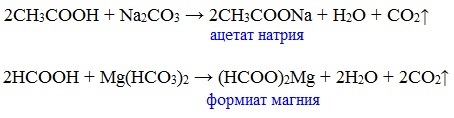

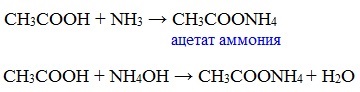
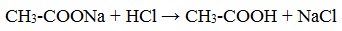
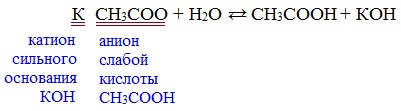
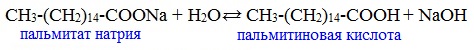

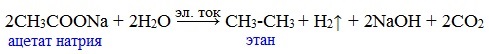
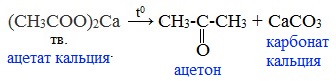
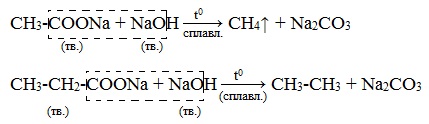
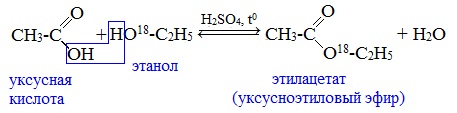
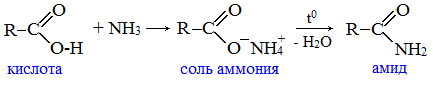

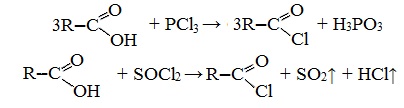

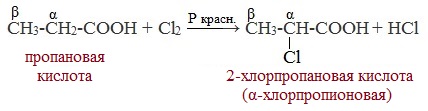
 При пропускании хлора через кипящую уксусную кислоту в присутствии красного фосфора образуется кристаллическое вещество – хлоруксусная кислота:
При пропускании хлора через кипящую уксусную кислоту в присутствии красного фосфора образуется кристаллическое вещество – хлоруксусная кислота: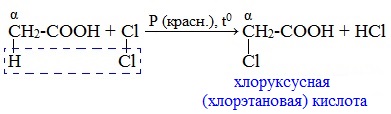
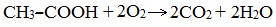
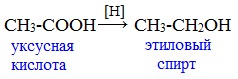
 Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.