Температура горения водорода: описание и условия реакции, применение в технике
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
Что такое водород?
Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.
Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 o C) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).
Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Химическая реакция горения
Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).
С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Инициация реакции
Как было отмечено, сделать это можно двумя способами:
- С помощью искры, которая должна предоставить всего 0,02 мДж теплоты. Это очень маленькое значение энергии, для сравнения скажем, что аналогичное значение для бензиновой смеси составляет 0,24 мДж, а для метановой — 0,29 мДж. С уменьшением давления энергия инициации реакции растет. Так, при 2 кПа она составляет уже 0,56 мДж. В любом случае, это очень маленькие значения, поэтому водород-кислородная смесь считается легко воспламеняющейся.
- С помощью температуры. То есть кислород-водородную смесь можно просто нагревать, и выше некоторой температуры она сама воспламенится. Когда это произойдет, зависит от давления и процентного соотношения газов. В широком интервале концентраций при атмосферном давлении реакция самовозгорания происходит при температурах выше 773-850 К, то есть выше 500-577 o C. Это достаточно высокие значения по сравнению с бензиновой смесью, которая начинает самовоспламеняться уже при температурах ниже 300 o C.
Процентное содержание газов в горючей смеси
Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Безопасность горения
Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Температура реакции горения
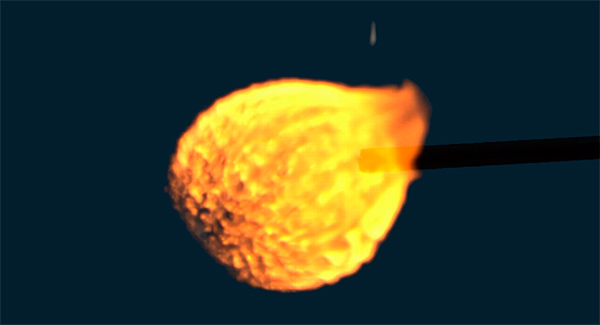
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 o C для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 o C (для других концентраций она может достигать 2500 o C), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 o C). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 o C).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м 3 этого газа весит всего 90 грамм. Если сжечь этот 1 м 3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.
Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Расчеты горения
Расчеты горения ведут по химическим уравнениям реакций, используя законы газового состояния: Бойля – Мариотта 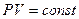
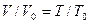
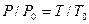
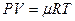
Рассмотрим реакцию горения водорода в кислороде: 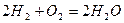
Рассмотрим реакцию горения метана в кислороде: 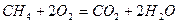
В практических условиях сжигание газа осуществляется в воздухе. Примем состав сухого воздуха: О2 – 21 %, N2 – 79%. Следовательно, 1 м 3 кислорода содержится в 100/21 = 4,76 м 3 воздуха. Или на 1 м 3 кислорода приходится 3,76 м 3 азота. Отсюда условная формула воздуха: (О2 + 3,76N2).
Запишем реакцию горения водорода в воздухе:
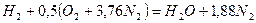
Из уравнения следует, что при нормальных условиях для полного сгорания 1 м 3 водорода требуется 0,5 × 4,76 = 2,38 м 3 воздуха. Таким образом, для сгорания 1 м 3 водорода требуется 2,38 м 3 воздуха. В результате образуются продукты сгорания: 1 м 3 воды в виде пара и 1,88 м 3 азота.
Запишем реакцию горения метана в воздухе:
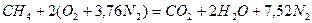
Из уравнения следует, что для полного сгорания 1 м 3 метана необходимо 2 × 4,76 = 9,52 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 метана требуется 9,52 м 3 сухого воздуха. Продукты сгорания содержат 1 м 3 диоксида углерода, 2 м 3 паров воды и 7,52 м 3 азота.
Запишем реакцию горения пропана в воздухе:
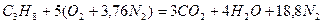
Из уравнения видно, что для полного сгорания 1 м 3 пропана необходимо 5 × 4,76 = 23,8 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 пропана требуется 23,8 м 3 сухого воздуха.
Приведенные расчеты выполнены для стехиометрических уравнений и полученные соотношения воздуха и газа называются стехиометрическими. Например, для горения метана в воздухе стехиометрическое соотношение – 9,52. В реальных условиях воздуха может не хватать для полного сгорания газа или, напротив, воздух подается в избыточном количестве. Для характеристики реальных соотношений воздуха и газа в процессе горения введена безразмерная величина: коэффициент избытка воздуха (окислителя) – коэффициент α. Для стехиометрического соотношения α = 1. Если имеет место недостаток воздуха, то α 1. Например, в процессе горения израсходовано 23 м 3 воздуха и 2 м 3 метана. Подсчитываем коэффициент α. Реальное соотношение воздуха и газа 23/2 = 11,5. Отсюда α = 11,5/9,52 = 1,2.
Выше показано, как можно подсчитывать необходимое количество воздуха для сгорания и определять объем продуктов сгорания для индивидуальных газов. Но обычно используемый газ – смесь различных газов. В этом случае расчет теоретически необходимого объема воздуха (воздуха сухого) ведется по формуле:
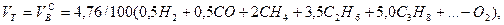
где 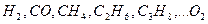
Используемый для сжигания атмосферный воздух содержит влагу, поэтому расчет объема влажного воздуха производят по формуле:
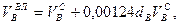
где 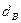
0,00124 – объем 1 г водяного пара.
И, наконец, определяется объем воздуха действительный с учетом величины коэффициента α по формуле:
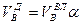
Пример. Имеется газ состава СН4 – 95%, С3Н8 – 5%. Определить объем воздуха действительного для сжигания данного газа при α = 1,1 и 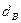

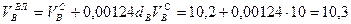
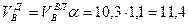
Объем продуктов сгорания газовой смеси определяется по следующим формулам.
Объем диоксида углерода
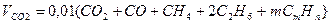
Объем водяных паров
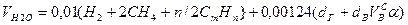
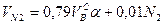
где N2 – процентное содержание азота в газовой смеси.
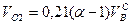
Суммарный объем продуктов сгорания

Дата добавления: 2015-06-22 ; просмотров: 8094 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Гремучий газ формула химическая
Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств [1] . Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около 50 МДж/кг).
Смеси водорода с кислородом или воздухом взрывоопасны и называются гремучим газом (название происходит от knallgas, нем. knall — громкий хлопок, резкий звук выстрела или взрыва). При зажигании искрой или другим источником смесь водорода с воздухом небольшого объёма сгорает чрезвычайно быстро, с громким хлопком, что субъективно воспринимается как взрыв. В физике горения такой процесс считается медленным горением, или дефлаграцией, однако гремучий газ способен и к детонации, при этом действие взрыва оказывается существенно более сильным.
Наиболее опасны околостехиометрические смеси, где на один моль кислорода приходится два моля водорода, то есть, с учётом того, что в воздухе соотношение кислорода и азота по объёму составляет примерно 1:3,76, объёмное соотношение водорода с воздухом в гремучем газе в стехиометрическом соотношении составляет 2:4,76 ≈ 0,4. Однако гремучий газ способен гореть в широком диапазоне концентраций водорода, от 4 — 9 объёмных процентов в бедных смесях до 75% в богатых смесях, приблизительно в этих же пределах он способен и детонировать [2] .
Гремучий газ самовоспламеняется при атмосферном давлении и температуре 510 °C. При комнатной температуре в отсутствие источников зажигания (искра, открытое пламя) гремучий газ может храниться неограниченно долго, однако он способен взорваться от самого слабого источника, так как для инициирования взрыва достаточно искры с энергией 17 микроджоулей [3] . С учётом того, что водород обладает способностью проникать через стенки сосудов, в которых он хранится, например, диффундировать сквозь металлические стенки газового баллона, и не обладает никаким запахом, при работе с ним следует быть чрезвычайно осторожным.
Содержание
Получение [ править | править код ]
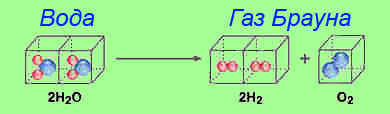
В 1766 г. водород получил Генри Кавендиш в реакции металла с кислотой: Fe + H2SO4 → FeSO4 + H2 (газ). В лабораторных условиях гремучий газ можно получить электролизом воды в реакции H2O → H2 + 0,5 O2.
Применение [ править | править код ]
В XIX веке для освещения в театрах использовался так называемый друммондов свет, где свечение получалось с помощью пламени кислород-водородной смеси, направленного непосредственно на цилиндр из негашёной извести, которая может нагреваться до высоких температур (белого каления) без расплавления. В пламени кислород-водородной смеси достигается высокая температура, и также в XIX веке это нашло применение в паяльных лампах для плавления тугоплавких материалов, резки и сварки металлов. Однако все эти попытки применения гремучего газа были ограничены тем, что он очень опасен в обращении, и были найдены более безопасные варианты решения этих задач.
В настоящее время водород считается перспективным топливом для водородной энергетики. При горении водорода образуется чистая вода, поэтому этот процесс считается экологически чистым. Основные проблемы связаны с тем, что затраты на производство, хранение и транспортировку водорода к месту его непосредственного применения слишком высоки, и при учёте всей совокупности факторов водород пока не может конкурировать с традиционными углеводородными топливами.
Кинетическая схема горения водорода [ править | править код ]
Горение водорода формально выражается глобальной реакцией H2 + 0,5 O2 → H2O. Однако эта глобальная реакция не позволяет описать разветвлённые цепные реакции, протекающие в смесях водорода с кислородом или воздухом. В реакциях участвуют восемь компонентов: H2, O2, H, O, OH, HO2, H2O, H2O2. Подробная кинетическая схема химических реакций между этими молекулами и атомами включает более 20 элементарных реакций с участием свободных радикалов в реагирующей смеси. При наличии в системе соединений азота или углерода число компонентов и элементарных реакций существенно увеличивается.
В силу того, что механизм горения водорода является одним из наиболее простых по сравнению с прочими газообразными топливами, такими как синтез-газ или углеводородные топлива, а кинетические схемы горения углеводородных топлив включают в себя все компоненты и элементарные реакции из механизма горения водорода, он изучается чрезвычайно интенсивно многими группами исследователей [4] [5] [6] . Однако, несмотря на более чем столетнюю историю исследований, этот механизм до сих пор изучен не полностью.
Критические явления при воспламенении [ править | править код ]
При комнатной температуре стехиометрическая смесь водорода и кислорода может храниться в закрытом сосуде неограниченно долго. Однако при повышении температуры сосуда выше некоторого критического значения, зависящего от давления, смесь воспламеняется и сгорает чрезвычайно быстро, со вспышкой или взрывом. Это явление нашло своё объяснение в теории цепных реакций, за которую Н. Н. Семёнов и Сирил Хиншелвуд были удостоены Нобелевской премии по химии 1956 года.
Кривая зависимости между критическими давлением и температурой, при которых происходит самовоспламенение смеси, имеет характерную Z-образную форму, как показано на рисунке. Нижняя, средняя и верхняя ветви этой кривой называются соответственно первым, вторым и третьим пределами воспламенения. Если рассматриваются только первые два предела, то кривая имеет форму полуострова, и традиционно этот рисунок называется полуостровом воспламенения.
Спорные теории [ править | править код ]
В 1960-е года американский инженер Уильям Роудс (William Rhodes) якобы открыл «новую форму» воды, коммерциализированную Юллом Брауном (Yull Brown), болгарским физиком, эмигрировавшим в Австралию. «Брауновский газ», то есть фактически смесь кислорода и водорода, получаемая в аппарате электролиза воды, объявлялся способным очищать радиоактивные отходы, гореть как топливо, расслаблять мышцы и стимулировать проращивание семян [8] . Впоследствии итальянский физик Руджеро Сантилли (en:Ruggero Santilli) выдвинул гипотезу, утверждающую существование новой формы воды в виде «газа HHO», то есть химической структуры вида (H × H — O), где «×» представляет гипотетическую магнекулярную связь, а «—» — обычную ковалентную связь. Статья Сантилли, опубликованная в авторитетном реферируемом журнале International Journal of Hydrogen Energy [9] , вызвала жёсткую критику со стороны коллег, назвавших утверждения Сантилли псевдонаучными [10] , однако некоторые другие учёные выступили в поддержку Сантилли [11] [12] .
Уйти от сжигания ископаемых углеводородов и получить дешевый альтернативный источник энергии – было и остается мечтой многих предприимчивых людей. Да и кто из домовладельцев не хотел бы получить подобный источник в свое распоряжение, чтобы с минимальными затратами обогревать свое жилище? Один из таких источников – так называемый газ Брауна, получаемый из обыкновенной воды. Но как его добыть и насколько он дешев – вопросы, ответы на которые можно найти в данном материале.
Немного теории
Необходимо отметить, что резонансное разложение воды в газ Брауна – отнюдь не миф, а реальный химический процесс, призванный выделять газообразное горючее из воды. Этот газ получил свое имя в честь изобретателя, который первым попытался вывести эту технологию за рамки экспериментов. Другое название, бытующее в интернете – гремучий газ (гипотетическая формула ННО).
Горючий газ Брауна – это не что иное, как смесь свободного водорода и кислорода, выделяемого из воды путем электролитической реакции.
Вода, чью химическую формулу (Н2О) знают даже дети, — это водород, который полностью окислен. По отдельности данные химические элементы весьма активны, водород хорошо горит и считается энергоносителем, а кислород поддерживает горение. Вот почему расщепить воду, чья цена – копейки, на столь полезные составляющие стало очень популярной идеей.
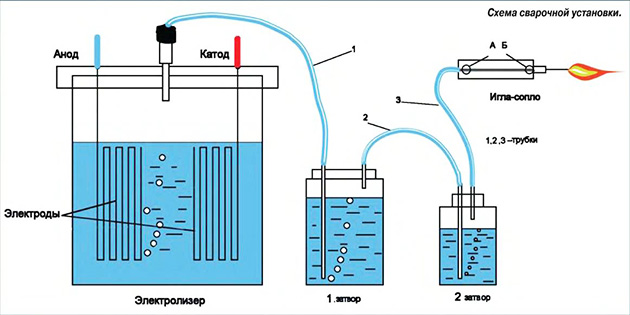
В результате трудами разных людей на свет появился генератор для получения газа – электролизер. Глубоко не вдаваясь в тонкости процесса, отметим, что вышеозначенный аппарат методом электролиза выделяет из воды газ Брауна, а точнее, смесь кислорода с водородом. Для этого через погруженные в емкость с водой электроды пропускается ток оптимальной частоты. Полученный газ скапливается под водяным затвором и при достижении определенного давления выходит по трубке наружу и может быть использован в разных целях.
Целесообразность получения газа Брауна
Генераторы газа Брауна, чей принцип работы описан выше, нашли свое практическое применение в 2 сферах:
- производство водородного топлива для автомобилей;
- газопламенные работы (сварка и пайка металлов).
Ездить с электролизером на борту автомобиль не может, поскольку ему требуется внешний источник электроэнергии. Штатной батареи хватает ненадолго, потому что на получение газа Брауна необходимо израсходовать больше энергии, чем отдает само топливо при сжигании. Поэтому компании, всерьез разрабатывающие тему водородного горючего на авто, внедрили схему заправки машин топливом, полученным из отдельного генератора.
Со сваркой и пайкой металлов дело обстоит лучше, водородные горелки используются на многих производствах Западной Европы. Так как температура горения газа Брауна (2235 °C) ниже, чем ацетилена (2620 °C), а продуктом сжигания является водяной пар, то многие мероприятия по экологической безопасности стали излишними. Промышленные генераторы газа, что при этом используются, весьма дороги, поскольку для повышения эффективности в них применяются катализаторы из редких элементов, в том числе платины.
Менеджеры одной из британских производственных компаний подсчитали, что общая стоимость выделения и использования газа Брауна равняется затратам на закупку и доставку ацетилена. Только сжигание водорода безопаснее и экологичнее. Другое дело, что на его получение расходуется электроэнергия, добытая путем сжигания тех же углеводородов.
На данный момент отопление газом Брауна крайне неэффективно, потому что энергии на производство горючего затрачивается больше, нежели получается при его сгорании. Существующие электролизеры пока что не в состоянии обеспечить высокий выход топлива при малых затратах. Чтобы в этом убедиться, стоит посмотреть видео:
На второй минуте отснятого материала четко видны показания приборов генератора при работающей водородной горелке. Напряжение – 250 В, сила тока – 14 А, соответственно, потребляемая мощность аппарата составляет 250 х 14 = 3500 Вт или 3.5 кВт. А теперь вопрос: сможет ли такой факел нагреть воду для обогрева комнаты площадью хотя бы 30 м2? Даже визуально заметно, что нет. А простой электрокотел мощностью 3.5 кВт легко обогреет помещение до 40 м2.
Вывод: Горючий газ Брауна в домашних условиях не может сравниться по отоплению с обычными электрическими нагревателями. Слишком много уходит энергии на его выделение из воды, а значит, использовать его для обогрева – нецелесообразно. Самостоятельным получением водорода можно заниматься как хобби либо в качестве эксперимента.
Как получить водород в домашних условиях?
На просторах интернета легко можно отыскать чертежи и схемы самых разнообразных самодельных установок, позволяющих выделять из воды газ Брауна. Если отфильтровать информационный мусор, относящийся к этой теме, то выяснится, что у себя дома вы сможете получить водород двумя путями. Первый – это приобрести готовый электролизер, таковые уже имеются в продаже. Одна беда – цена их слишком высока, а величина КПД неизвестна.
Покупая водородный генератор, надо понимать, что он не станет для вас панацеей в плане отопления. Цена оборудования и потребляемой электроэнергии получится выше, чем простой электрический нагрев воды, так что об окупаемости речи не идет.
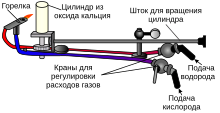
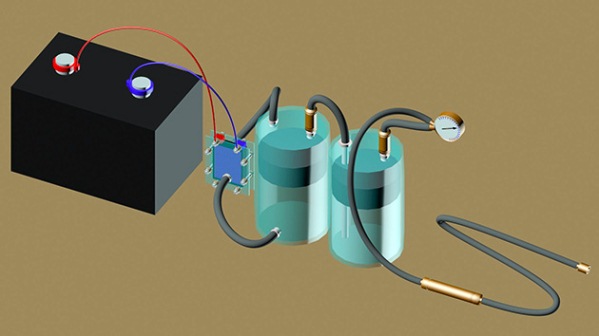
Можно в качестве эксперимента сделать генератор газа Брауна своими руками, позволяющий выделить небольшое количество горючего. Использовать его для обогрева здания вряд ли получится, а вот на питание небольшой горелки для плавления металла вполне может хватить. Для начала надо изготовить электролизер, представляющий собой емкость с водой, куда погружены электроды. Чем больше площадь поверхности электродов, тем выше производительность установки. Подойдут стальные пластины произвольного размера, прикрепленные к основанию из диэлектрика. Рабочая схема аппарата показана на рисунке:
Электроды опускаются в герметично закрытую емкость с водой, куда для улучшения реакции добавлена обычная соль. Через крышку выводится трубка для газа, идущая во второй сосуд, являющийся водяным затвором, он наполняется водой на 2/3.
Вторая трубка, выходящая из этой емкости, подключается к горелке. Напряжение на электроды лучше подавать с помощью автотрансформатора, контролируя его величину мультиметром. Как собрать мини-генератор газа Брауна своими руками, показано на видео:
Внимание! Если вам удалось добиться сколько-нибудь значительной производительности установки, горелку к трубке следует подключать через обратный клапан, чтобы избежать обратного удара и взрыва.
Заключение
На данный момент не существует недорогого и одновременно высокоэффективного оборудования для получения газа Брауна из воды. Пока первенство в отоплении остается за углеводородами, но технологии продолжают совершенствоваться и не исключено, что скоро водородные генераторы станут достойно конкурировать с традиционными источниками тепловой энергии.
Грем у чий газ, смесь двух объёмов водорода и одного объёма кислорода. При поджигании гремучий газ сильно взрывается, в присутствии губчатой платины горит спокойнее; реакция 2H2+O2=2H2O+ +572,5 кдж (136,74 ккал) позволяет получать высокие температуры (около 2800°C). Поэтому пламя гремучего газа служит для плавки кварца, платины и др., а также газовой сварки и резки металлов.
http://helpiks.org/3-94961.html
http://iobogrev.ru/gremuchij-gaz-formula-himicheskaja