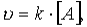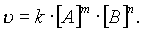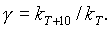Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
Один из основных законов физической химии; устанавливает зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия. Норвежские учёные К. Гульдберг и П. Вааге, сформулировавшие Д. м. з. в 1864—67, назвали «действующей массой» вещества его количество в единице объёма, т. е. концентрацию, отсюда — наименование закона.
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для мономолекулярной реакции скорость реакции u определяется концентрацией молекул вещества А:
где k — коэффициент пропорциональности, который называется константой скорости реакции;[А] — молярная концентрация вещества А.
В случае бимолекулярной реакции, ее скорость определяется концентрацией молекул не только вещества А, но и вещества В
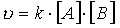
В случае тримолекулярной реакции, скорость реакции выражается уравнением 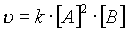
В общем случае, если в реакцию вступают одновременно т молекул вещества А и n молекул вещества В, т. е.
тА + пВ = С,
уравнение скорости реакции имеет вид
Вид уравнения определяется тем, что необходимым условием элементарного акта реакции является столкновение молекул исходных веществ, т. е. их встреча в некотором малом объёме (порядка размера молекул). Вероятность найти в данный момент в данном малом объёме молекулу А пропорциональна [А], т. е., чем больше концентрация реагирующих веществ, тем больше скорость реакции в данный момент времени. Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, а в случае жидкого раствора — также и от давления; последняя зависимость существенна лишь при высоких давлениях, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Пример
Запишите выражение закона действия масс для следующих реакций:
Решение
a) Поскольку в данной реакции все вещества находятся в газообразном состоянии, то данная система будет являться гомогенной и в формулу закона для прямой реакции будут входить концентрации всех компонентов:
u=[N2] 
для обратной реакции
b) Поскольку в данной реакции вещества находятся в газообразном и кристал-лическом состоянии, то данная система будет являться гетерогенной и в формулу закона для прямой реакции будут входить концентрации только газообразных веществ ([C] не учитывается, т. к. углерод находится в кристаллическом состоянии, а концентрации кристаллических веществ равны единице.):
для обратной реакции
u=[CO] 2 .
Температура.Многочисленные опыты показывают, что при повышении температуры скорость большинства химических реакций существенно увеличивается, причем для реакций в гомогенных системах при нагревании на каждые десять градусов скорость реакции возрастает в 2—4 раза (правило Вант-Гоффа). Это правило связано с понятием температурного коэффициента скорости реакции 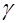
При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле
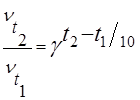
где ut2 и ut1 — скорости реакции при температурах t2 и t1 соответственно; 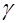
С одной стороны, увеличение температуры приводит к увеличению скорости движения молекул и, как следствие, к более частым столкновениям. Но этот фактор не вызывает увеличение скорости даже в 2а раза, т. к. не все столкновения оказываются эффективными. Реакция начнётся только в том случае, если энергия молекул превысит некоторую величину, достаточную для преодоления барьера отталкивания. В этом случае происходит сближение взаимодействующих частиц, при котором становиться возможным образование химической связи. При этом возникает активированный комплекс— единое образование из столкнувшихся молекул, находящихся в состоянии перераспределения электронной плотности. Такие молекулы называются активными, а энергия, которой должны обладать эти сталкивающиеся молекулы, чтобы их столкновение привело к химическому превращению, называют энергией активации. Отсюда следует, что при увеличении температуры увеличивается доля активных, т. е. способных к взаимодействию молекул, и скорость реакции увеличивается. Этот факт может быть доказан с помощью графика:
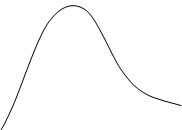
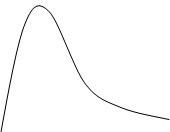

 |
Рисунок 2. — График зависимости доли активных молекул от температуры
N – доля молекул с данной энергией;
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса
k = A ∙ e √ Ea/RT , где
A — постоянная, зависящая от природы реагирующих веществ; R — универсальная газовая постоянная [8,314 Дж/(моль ∙ К) = 0,082 л ∙ ═атм/(моль ∙ К)]; Ea — энергия активации.
Показательно, что для экзотермической реакции( идущей с выделением теплоты) энергия активации перекрывается тепловым эффектом реакции.
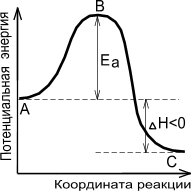 | 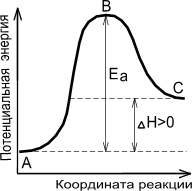 |
| Экзотермическая реакция | Эндотермическая реакция |
Рисунок 3. — Энергетическая диаграмма химической реакции.
В — активированный комплекс (переходное состояние),
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ — путем их растворения.
Катализ— процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы – вещест-ва, изменяющие скорость химической реакции, которые могут входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Каталитические реакции — реакции, протекающие в присутствии катализато-ров. Положительнымназывают катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) — при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного — снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия. Катализаторы, замедляющие химическую реакцию, называются ингибиторами. В зависимости от того, находится катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации. При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель. Механизм гетерогенного катализа сложнее, чем у гомогенного.
Механизм гетерогенного катализа включает пять стадий, причем все они обратимы: 1-я — диффузия реагирующих веществ к поверхности твердого вещества; 2-я — физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их; 3-я — химическая реакция между реагирующими молекулами; 4-я— десорбция продуктов с поверхности катализатора; 5-я — диффузия продукта с поверхности катализатора в общий поток.
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2 O5 при производстве серной кислоты (контактный метод).
Промоторы (или активаторы) — вещества, повышающие активность катализатора. При этом промоторы могут сами и не обладать каталитическими свойствами.
Каталитические яды — посторонние примеси в реакционной смеси, приводящие к частичной или полной потере активности катализатора. Так, следы мышьяка, фосфора вызывают быструю потерю катализатором V2 O5 активности (контактный метод производства H2 SO4 ).
1.2 Примеры решения задач:
Закон действия масс Гульдберга и Вааге
Содержание:
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 16.04.2019 |
- Данный тип работы не является научным трудом, не является готовой выпускной квалификационной работой!
- Данный тип работы представляет собой готовый результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала для самостоятельной подготовки учебной работы.
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
Посмотрите похожие темы возможно они вам могут быть полезны:
Введение:
Когда впервые обнаруживается, что определенная идея объясняет или исправляет многие факты, такая идея называется гипотезой. Гипотеза может быть подвергнута дальнейшей проверке и экспериментально подтвердить выводы, вытекающие из нее. Если гипотеза согласуется с результатами эксперимента, то она называется теорией или законом. Закон может быть просто обобщением положений, касающихся экспериментально выявленных фактов.
Слабые электролиты при растворении и плавлении частично диссоциируют на ионы. Параллельно с процессом диссоциации происходит обратный процесс — ассоциация — образование молекул из ионов. В определенный момент времени скорости прямой и обратной реакций уравниваются, и наступает состояние химического равновесия. В этом состоянии система будет оставаться так долго, пока любое внешнее воздействие не приведет к сдвигу равновесия. Состояние химического равновесия характеризуется константой равновесия.
Целью теста является изучение закона масс.
Для достижения цели были определены следующие задачи:
- Изучите основы вселенной.
- Рассмотрим закон масс.
Основы Вселенной
Закон действующих масс включен в научную и учебную литературу как один из основных законов химии. Тот факт, что процесс химического взаимодействия зависит от количества активных масс, был подтвержден фактами как из области органической, так и неорганической химии. Дж. Роуз (1851), Р. Бунзен (1853), Д. Гладстон (1855) дали материал, чтобы доказать существование обратимых химических превращений и возможность изменения направления реакции путем выбора подходящих условий ее протекания. Французский химик Сент-Клер Девиль (1818–1881) в 1857 году доказал, что разложение химических соединений может начаться даже ниже температуры их полного разложения.
Ко времени этого открытия Анри Этьен Сен-Клер Девиль уже был профессором Высшей нормальной школы в Париже. В 1861 году он стал членом Парижской академии наук. Именно Сен-Клер Девиль разработал первый промышленный метод производства алюминия (1854). Французский ученый также предложил новый метод плавления и очистки платины. Он также синтезировал различные минералы. Интересно, что в 1869 году Сент-Клер Девиль был избран членом-корреспондентом Петербургской академии наук.
Так, в статье 1857 г. «О диссоциации или самопроизвольном разложении веществ под воздействием тепла» (1857 г.) Сен-Клер Девиль показал, что под воздействием температуры водяной пар разлагается на кислород и водород при температуре плавления платина (1750 ° C) и при температуре плавления серебра (950 ° C).
Позже, в лекциях о диссоциации, прочитанных в 1864 году перед Французским химическим обществом, Сен-Клер Девиль формулирует окончательное заключение своих экспериментов: «Превращение водяного пара в смесь водорода и кислорода — это полное изменение состояния, соответствующее определенному температура, и эта температура постоянна при переходе из одного состояния в другое, в каком бы направлении эти изменения не происходили. «Это самопроизвольное разложение воды называется диссоциацией».
Следует отметить, что такое определение охватывает только случаи, «в которых разложение происходит частично и при температуре ниже температуры, которая соответствует абсолютному разрушению соединения».
Французский ученый показал, что некоторые соединения, даже самые стабильные, легко диссоциируют при высоких температурах (1200–1500 ° С). Химическое равновесие, установленное в этом случае, можно контролировать, изменяя температуру и давление.
Сен-Клер Девиль также предложил метод «закаливания» химических реакций. «Оказалось», — пишет Ю. И. Соловьев, «что если вы очень быстро охладите любую систему, в которой равновесное состояние устанавливается при высокой температуре, то эта система, кажется, застывает в состоянии, в котором оказалось ее внезапное охлаждение. Этот метод холодного горячего трубки был следующим. Испытуемый газ медленно пропускали через фарфоровую трубку, нагретую до высокой температуры. В центре фарфоровой трубки прошла тонкая серебряная трубка, по которой текла холодная вода. Когда моноксид углерода пропускали через горячую фарфоровую трубку в противоположном направлении, углерод наносился на серебряную трубку; при прохождении хлористого водорода был получен хлорид серебра. Впоследствии В. Нернст показал, что методом «закалки» можно количественно изучить равновесие системы, которое было установлено при высокой температуре.
Сент-Клер Девиль связал химическое равновесие с двумя взаимозависимыми процессами: соединение и разложение. Его работы по термической диссоциации имели первостепенное значение для дальнейшего развития учения о химическом равновесии».
«. Исследования Анри Сен-Клера Девиля, посвященные феномену диссоциации, — писал Дж. Дюма, — являются величайшим приобретением не только химии, но и физики. Благодаря открытию этого основного явления он открыл в науке новый путь — путь сближения химических явлений с чисто физическими».
Высоко оценил работу Сен-Клера Девиля по разобщению его преемника, русского физика-химика Н. Н. Бекетова. Они представляют собой не только «историческую эру в развитии химии», но и «поворот в направлении изучения химии», с тех пор снова (почти заброшенное) изучение химических явлений началось (вместо почти исключительного изучения состава и структура соединений), то есть изучение статической химии пошло вместе с изучением динамической химии».
Николай Николаевич Бекетов (1827–1911) в 1848 году окончил Казанский университет. С 1859 по 1887 год он был профессором химии в Харьковском университете. В 1886 году Николай Николаевич стал академиком Петербургской академии наук. Основные труды ученого посвящены изучению природы химического сродства, химического равновесия и термохимии. В 1864 году Бекетов организовал физико-химический факультет на физико-математическом факультете Харьковского университета, где сам прочитал систематический курс лекций по физической химии.
В 1859-1865 гг. Бекетов изучал зависимость явлений смещения одних элементов другими от внешних физических условий (температуры, давления и т. д.). На примере одной из реакций — водородного вытеснения металлов из растворов их солей — он показал, что «это действие водорода зависит от давления газа и прочности раствора металла, или, другими словами, от химической массы восстановленного тела. » Он обнаружил, что «химическое воздействие газов зависит от давления и, в зависимости от величины давления, может происходить даже в противоположном направлении». Ученый проясняет ситуацию, говоря, что действие газа пропорционально давлению или массе. Несомненно, данные исследований русского ученого имели большое значение для разработки учения о химическом равновесии и для подготовки к открытию закона действующих масс.
В 1862 г. появились работы М. Бертело и Л. Пеана де Сен-Жиля, обобщающие большое количество фактического материала о зависимости предела реакций этерификации и омыления от количества взаимодействующих веществ, — «Исследования по аффинности. образование и разложение эфиров».
Следующий шаг сделан Анри Дебре (1827–1888), французским химиком, который работал в 1855–1868 годах ассистентом Сен-Клера Девиля в Высшей нормальной школе. В 1867-1868 годах учитель в Политехнической школе в Париже делает обобщение давления газообразного компонента или компонентов, полученных в процессе диссоциации, постоянно при любой определенной температуре и не зависит от количества исходного вещества что подверглось разложению. Дебре показал, что во многих случаях, когда твердое вещество диссоциирует, давление диссоциации зависит не от количества присутствующих веществ, а только от температуры.
Первоначально были предприняты попытки установить коэффициенты сродства для каждого соотношения взятых масс в отдельности. Однако позже возникает идея найти общий способ расчета условий равновесия для любых количеств реагирующих веществ.
Като Максимилиан Гулдберг (1836–1902), норвежский физик и химик, профессор технологии в Университете Кристиании (ныне Осло), и Питер Вааге (1833–1900), норвежский химик, профессор химии в Университете Кристиании, представили Равновесие в 1862–1867 гг. обратимой метаболической реакции как равенства двух сил аффинности, действующих в противоположных направлениях. Авторы математически сформулировали закон действующих масс, построив свою теорию на общем условии равновесия. Кроме того, они опирались на экспериментальные данные М. Бертело и Пена де Сен-Жиля, а также на собственные результаты. Они придерживались механической интерпретации природы сил родства, принятой в шестидесятых.
Гоулдберг и Ваге написали: «Мы считаем, что для определения величины химических сил необходимо исследовать химические процессы всегда в таких условиях, когда оба противоположных направления появляются одновременно . Если мы предположим, что две противоположные силы действуют в данной Химический процесс: один стремится к образованию новых веществ, а другой — к восстановлению исходных соединений из новых, становится очевидным, что когда эти силы в химическом процессе становятся одинаковыми, система находится в равновесии».
В 1867 г. в своей монографии «Исследования сил химического сродства» Гульдберг и Вааге показали, что химические реакции протекают как в прямом, так и в обратном направлении. «Сила, вызывающая образование A и B, увеличивается пропорционально коэффициенту сродства для реакции A + B = A ‘+ B’, но, кроме того, она зависит от масс A и B. Сила пропорциональна произведению действующих масс двух тел A и B. «Силы» прямой и обратной реакций уравновешены . » это закон действующих масс.
В 1879 году появилась новая статья Гулдберга и Ваге «О химическом сродстве». Здесь ученые дают молекулярно-кинетическое объяснение химическим реакциям и равновесиям вместо идеи действия статических «сил». Объясняя процесс равновесия противоположных реакций, авторы считают, что «недостаточно простых предположений о силах притяжения между веществами или их компонентами . Необходимо учитывать движение атомов и молекул . Состояние равновесия, возникающее в химическом процессе такого типа, представляет собой состояние подвижного равновесия, поскольку одновременно происходят две противоположные химические реакции: происходит не только образование A’TL B ‘, но также обратное образование A и B. Если они равны количества каждой из этих пар образуются в единицу времени, существует равновесие. »
Основываясь на своей интерпретации химического равновесия, Гульдберг и Ваге впервые дают кинетический вывод о законе действия массы. Они заключают, что скорость реакции определяется вероятностью столкновения частиц, взаимодействующих.
В 1880 году появилось большое количество работ в поддержку закона нынешних масс. В будущем стало возможным установить неприменимость этого закона к несовершенным системам. «Модернизация» формулы концентрации позволила успешно применить закон действующих масс для изучения равновесия химических реакций. Сегодня закон служит основным уравнением химической кинетики, используемым для расчета технологических процессов.
Закон о массах (ZDM)
Один из основных законов физической химии; устанавливается зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия. Норвежские ученые К. Гульдберг и П. Вахаге, которые сформулировали закон действующих масс в 1864–1867 гг., Назвали «действующей массой» вещества его количество на единицу объема, то есть его концентрацию, отсюда и название закон
Если реакция происходит в идеальной газовой смеси или идеальном жидком растворе: aA + a’A ‘= bB + b’B’, (А, А ‘и т. д. — вещества, А, А’ и т. д. — стехиометрические коэффициенты), затем, согласно ЗДМ., Скорость реакции в прямом направлении: r + = k + [A] a [A ‘] a’.
Здесь [A] — концентрация вещества A и т. д., K + — константа скорости реакции (в прямом направлении), k + зависит от температуры, а в случае жидкого раствора — также от давления; последняя зависимость значима только при высоких давлениях. Форма уравнения (2) определяется тем, что необходимым условием элементарного события реакции является столкновение молекул исходных материалов, т. е. Их встреча в небольшом объеме (порядка размера молекул ). Вероятность нахождения молекулы A в данном небольшом объеме в данный момент пропорциональна [A]; вероятность нахождения в нем одновременно молекул A и a ‘молекул A’ по теореме о вероятности комплексного события пропорциональна [A] a [A ‘] a’. Количество столкновений молекул исходных материалов в единице объема за единицу времени пропорционально этой величине. Определенная доля этих столкновений приводит к реакции. Это подразумевает уравнение. Мономолекулярные реакции требуют особого внимания.
Скорость реакции (1) в обратном направлении r- = k- [B] b [B ‘] b’.
Если реакция обратима, то есть она протекает одновременно в противоположных направлениях, то наблюдается наблюдаемая скорость реакции r = r + — r-, когда r + = r- химическое равновесие.
Уравнения (2) и (3) применимы к простой (одностадийной) реакции и к отдельным стадиям сложной реакции, но не к сложной реакции в целом. Уравнения (4) и (5), выражающие HMD для равновесия, также справедливы в случае сложной реакции.
Общим условием равновесия в отношении реакции (1), применимость которой не ограничена идеальными системами, является уравнение в которой [A] — активность вещества A и т. д. Уравнение (6) получено из принципов термодинамики. Использование ZDM. для равновесия максимально достижимые скорости конверсии рассчитываются для обратимых реакций. К последним относятся важные промышленные процессы — синтез аммиака, окисление диоксида серы и многие другие. На основе ZDM получены кинетические уравнения для скоростей реакций, которые используются при расчете химического оборудования.
Вывод:
Закон действующих масс включен в научную и учебную литературу как один из основных законов химии. Тот факт, что процесс химического взаимодействия зависит от количества активных масс, был подтвержден фактами как из области органической, так и неорганической химии. Дж. Роуз (1851), Р. Бунзен (1853), Д. Гладстон (1855) дали материал, чтобы доказать существование обратимых химических превращений и возможность изменения направления реакции путем выбора подходящих условий ее протекания.
Закон масс действует для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Эта стадия, скорость которой минимальна, ограничивает скорость реакции в целом. Поэтому математическое выражение закона действующих масс написано для самой медленной (предельной) стадии процесса.
Таким образом, закон действия массы справедлив только для самого простого по своему механизму взаимодействия, происходящего в газах или в разбавленных растворах.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Закон действующих масс. Константа скорости
В основе учения о химической кинетике лежит её основной постулат, который под названием “закон действующих масс”был открыт К.М.Гульдбергом и П.Вааге в 1864 — 67 г. г. (В некоторых учебниках можно встретить ошибочное выражение “закон действия масс”, которого следует избегать. К.М.Гульдберг и П.Вааге термином “действующая масса” обозначили то понятие, которое сейчас общепринято называют концентрацией. Термин “концентрация” был введён Я.Вант-Гоффом в 90-х годах XIX в.).
В современной формулировке закон читается так:
Скорость химической реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ (имеющихся в данный момент времени), возведённых в некоторые степени.
Эти степени не всегда соответствуют стехиометрическим коэффициентам при формулах этих веществ в уравнении реакции, что было проиллюстрировано в п. 12.3.
Например, для произвольной реакции
когда соотношение концентраций исходных веществ и продуктов близко к соотношению их стехиометрических коэффициентов, математическое выражение закона действующих масс будет выглядеть так:
v = k C a A C b B (12.3)
где CA и CB — концентрации исходных веществ А и В в данный момент времени; а и b — стехиометрические коэффициенты при формулах веществ А и В в уравнении реакции; k — коэффициент пропорциональности, называемый константой скорости данной реакции при данной температуре.
Уточнение о том, что показатели степени при концентрациях реагентов не обязательно совпадают со стехиометрическими коэффициентами, связано с упомянутым выше (п. 12.3) несовпадением порядка и молекулярности реакций. Оно становится понятным, если вспомнить, что показатель степени в уравнении (12.3) представляет собой порядок реакции, который может не соответствовать стехиометрии уравнения реакции и должен для каждого данного случая определяться экспериментально. Поэтому, если соотношения концентраций исходных веществ значительно отличаются от стехиометрии реакции, то степени при концентрациях в уравнении закона действующих масс должны быть соответствующим образом изменены.
Константа скоростиk численно равна скорости реакции в стандартном состоянии, то есть при концентрациях всех реагентов, равных 1 в выбранной системе единиц. Она количественно характеризует реакционную способность веществ в элементарной реакции при данной температуре в данной среде.
В случае сложных реакций, в особенности гетерогенных, константа в уравнении закона действующих масс называется коэффициентом скоростиили эффективной константой скоростии является эмпирической величиной, физический смысл которой определяется конкретным механизмом реакции.
12.6. Расчёт констант скорости для реакций различных порядков
Наибольшее практическое значение для фармации имеют реакции 1-го и 2-го порядков. Этим порядкам подчиняется подавляющее большинство реакций синтеза и разложения лекарственных веществ, а также реакций, используемых при различных методиках анализа.
http://natalibrilenova.ru/zakon-dejstviya-mass-guldberga-i-vaage/
http://helpiks.org/6-61937.html