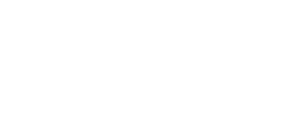
Уравнение хаггинса для приведенной вязкости
2.4.3. Гидродинамические свойства
разбавленных растворов полимеров
Изменение термодинамического качества растворителя, молекулярной массы полимера или температуры раствора вызывает изменение размеров и формы молекулярных клубков. Это приводит к изменению гидродинамических свойств разбавленных растворов полимеров.
Согласно закону Стокса сила сопротивления, которое испытывает сферическая частица при движении в вязкой среде с вязкостью η0, определяется по формуле
где v — средняя скорость движения частиц в растворе.
Движение статистически свернутой в клубок макромолекулы в разбавленном растворе определяется коэффициентом поступательного трения f’:
Для длинных гибких полимерных цепей установлено, что f’ ≈ М
| 1/2 |
| v |
. В этом случае
Для жестких макромолекул принимают
где L — «контурная длина» полимерной цепи.
Макромолекулы, находящиеся в растворе, испытывают гидродинамическое воздействие молекул растворителя, а те в свою очередь — кинетически активных участков полимерных цепей (см. рис. 2.4).
Влияние концентрации полимера на вязкостные свойства его растворов может быть описано некоторым степенным рядом:
В первом приближении эта зависимость определяется как закон Эйнштейна:
здесь ψ — коэффициент формы; для сферической частицы ψ = 2,5, для клубков анизотропной формы
где а и b — большая и малая полуоси гипотетического эллипсоида вращения молекулярного клубка; φ — объемная доля полимера.
Закон Эйнштейна выполняется достаточно строго лишь до концентрации Ск ≤ [η] -1 .
При содержании полимера в растворе большем, чем Ск, нарушается линейная зависимость ηуд/C = f(C) вследствие интенсификации межмолекулярных взаимодействий.
Хаггинс показал, что A0 = [η], a A1 = [η] 2 k‘. Для большинства систем полимер — растворитель справедливо следующее уравнение:
Соответствующее разложение в ряд аналогичной зависимости приведенной логарифмической вязкости дает следующее соотношение:
Легко показать, что k’ = 0,5 + β 0 .
Величина k’ — константа Хаггинса — зависит от молекулярной массы и свойств системы полимер — растворитель и может служить характеристикой интенсивности взаимодействия полимера с растворителем. Значение k’ возрастает с ухудшением термодинамического качества растворителя и уменьшается с понижением температуры.
Судить о степени разветвленности полимера по величине k’ нельзя.
Задача. Рассчитать средневязкостную молекулярную массу М v и константу Хаггинса k’ для растворов изотактического полипропилена в тетралине при 125°С, если получены следующие значения удельной вязкости:
| С, г/100 см 3 | 0,1 | 0,2 | 0,3 | 0,4 |
| ηуд | 0,21 | 0,43 | 0,65 | 0,88 |
Решение. Рассчитываем для каждой концентрации приведенную вязкость ηуд/С : 2,10; 2,15; 2,17; 2,20 и строим график зависимости ηуд/С от С (рис. 2.7). Находим [η] = 2,08 и по уравнению Марка — Хаувинка — Флори (1.32) вычисляем молекулярную массу.
Согласно Приложению 6,
Kη = 0,8·10 -4 , а α = 0,8; M
| 0,8 |
| v |
= 2,08/(0,8·10 -4 ) и М у = 3,56·10 5 .

Рис. 2.7. Зависимость приведенной вязкости ηуд/С от концентрации С для растворов изотактического полипропилена в тетралине при 125°С
Из рис. 2.7 находим значение А1 как тангенс угла наклона прямой tgβ:
Изменение термодинамического качества растворителя обусловливает соответствующее увеличение или уменьшение коэффициентов разбухания молекулярного клубка ζ.
Как отмечалось ранее, в хороших растворителях ζ > 1. Вычислить [ h 2 ] 1/2 и η можно из уравнения Флори
здесь Ф0 — некоторая постоянная, уменьшающаяся от 2,84·10 21 в θ-растворителе до 1,60·10 21 в хороших растворителях (концентрация раствора выражена в г/100 см 3 ).
Вопрос. При добавлении в диметилформамидный раствор полиакрилонитрила небольших количеств метилового спирта наблюдается снижение характеристической вязкости. Объясните причину этого явления.
Ответ. Метиловый спирт является нерастворителем для полиакрилонитрила. Введение его в диметилформамидные растворы ухудшает термодинамическое качество растворителя, что приводит к свертыванию молекулярных клубков, уменьшению их гидродинамического сопротивления и в результате — к снижению [η].
Так как изменение второго вириального коэффициента В обусловлено теми же факторами, что и изменение ζ, то
Поэтому в θ-растворителе ζ = 1 и В = 0.
Задача. Рассчитать среднеквадратичное расстояние между концами статистически свернутой макромолекулы полиакрилонитрила в θ-растворителе
диметилформамид — метиловый спирт (80:20), если для полимера с M v = 8·10 5 [η]θ = 4,23.
Решение. Так как для θ-растворителя ζ = 1 и Ф0, θ = 2,84·10 21 , то, согласно формуле (2.47),
[ h
| 2 |
| 0 |
] = 1,12 · 10 -10 см 2 ;
[ h
| 2 |
| 0 |
] 1/2 = 1,06 · 10 -6 см = 106 нм.
Отметим, что для системы полиакрилонитрил — диметилформамид
Значения ζ могут быть вычислены из значений [η] в данном и в θ-растворителе:
Вопрос. В результате осмометрических исследований кадоксеновых растворов фракционированных препаратов целлюлозы и амилозы было установлено, что значения М n в обоих случаях идентичны. Однако вискозиметрические измерения показали, что [η] для целлюлозы больше, чем для амилозы. Объясните вероятную причину этого эффекта.
Ответ. Различия в значениях [η] для кадоксеновых растворов целлюлозы и амилозы могут быть объяснены как различной скелетной гибкостью макромолекул сравниваемых полисахаридов, так и различными величинами термодинамического сродства растворителя и полимера, т.е. их равновесной гибкостью.
Задача. Вычислить коэффициент разбухания ζ для поливинилацетата, если в ацетоне [η] = 2,52, а в θ-растворителе — смеси метилпропилкетон — гептан — [η]θ = 0,92.
Решение. В соответствии с уравнением (2.49)
Следует отметить, что значения константы Флори в различных растворителях зависят от ζ:
где Ф0, θ — константа Флори для θ-растворителя, равная 2,84·10 21 .
Задача. Вычислить величину сегмента Куна Lк макромолекул полиакрилонитрила в θ-растворителе при 25°С, если Кη, θ = 8,0·10 5 .
Решение. Согласно уравнениям (1.32) и (2.47) имеем
[η]θ = Ф0, θ [ h
| 2 |
| θ |
] 3/2 M v = Kη, θ M
| 0,5 |
| v |
.
где M0 — молекулярная масса элементарного звена;
Задача. Вычислить [ h
| 2 |
| θ |
] макромолекулы с M v = 5·10 5 , если в некотором растворителе этот полимер характеризуется [η] = 56,8. Значение α = 0,5.
Решение. Если α = 0,5, то полимер растворен в θ-растворителе, для которого ζ = 1. Поэтому
[ h
| 2 |
| θ |
] = 56,8·5·10 5 /(2,84·10 21 ) = 1·10 -16 .
Следовательно, [ h
| 2 |
| θ |
] 1/2 = 46,4 нм.
Изучение гидродинамических свойств и светорассеяния разбавленных растворов позволяет получить определенную информацию о размерах и форме молекулярных клубков в растворе. Лишь в θ-растворителе макромолекулы приобретают конформацию статистического клубка, в котором взаимное расположение звеньев и сегментов может быть описано вероятностной кривой Гаусса. Тэта-состояния раствора можно достигнуть, либо варьируя соотношение растворитель — осадитель, либо изменяя температуру. Ниже приводятся значения θ-температур (в °С) для растворов полиакрилонитрила в различных растворителях:
| Диметилформамид | 131 |
| Диметилсульфоксид | 96 |
| Азотная кислота 60%-я | 47 |
| γ-Бутиролактон | 107 |
| Гидроксиацетонитрил | 57 |
Например, подбор θ-растворителя методом изменения состава растворяющей смеси основан на определении значения постоянной α в уравнении Марка — Хаувинка — Флори в различных растворителях при изотермических условиях.
Задача. Рассчитать состав растворителя для сополимера акрилонитрила с винилпиридином в θ-точке, если из вискозиметрических данных для его растворов в смеси Диметилформамид — метиловый спирт получены следующие значения:
| ДМФ : СН3ОН, % (об.) | 100:0 | 95:5 | 90:10 | 86:14 | 82:18 |
| α | 0,81 | 0,74 | 0,66 | 0,60 | 0,54 |
Решение. Строим график зависимости а от состава растворителя (рис. 2.8) и при экстраполяции прямой на линию, проведенную через α = 0,5 параллельно оси абсцисс, получаем точку, соответствующую составу θ-растворителя: 80% (об.) диметилформамида + 20% (об.) метилового спирта.
Размеры макромолекулярных клубков можно определить также по интенсивности рассеяния света частицами под одинаковыми углами θ для различных длин волн λ (по дисперсии светорассеяния), если воспользоваться следующим уравнением:

Рис. 2.8. Зависимость а от состава растворитель-осадитель (система полиакрилонитрил-диметилформамид-метанол) при 25°С
Вопрос. Объясните, почему в хороших растворителях значение HC/Rθ для эквиконцентрированных растворов больше, чем в θ-растворителе.
Ответ. Так как величина HC/R 0 связана со статистическим размером молекулярного клубка, то ухудшение термодинамического качества растворителя (уменьшение [ h 2 ] при M w = const) влечет за собой ее снижение.
Из сопоставления уравнений (2.48) и (1.58) становится очевидным, что величина HC/τ зависит от значений второго вириального коэффициента В. Если размер молекулярного клубка соизмерим с длиной волны падающего света или больше ее [≥(λ/20)], то возникает асимметрия рассеянного света [см. уравнение (2.49)J.
Так, по графику двойной экстраполяции (по Зимму) можно, оценивая tgφ (см. рис. 1.20), определить В, так как
Из этого же графика может быть определен и радиус инерции молекулярного клубка:
[ r 2 ] =
| 3 |
| 16π (n0 / λ) 2 |
| tgω |
| h’ |
,
где n0 — показатель преломления растворителя; h’ — величина отрезка от начала координат.
Для свободносочлененной цепи [ r 2 ] = (1/6)[ h 2 ], а для жесткой цепи (для f0 r 2 ] = (1/12)L 2 .
Однако достоверная оценка размеров частиц этим способом возможна в двух случаях:
1) при получении на кривой HC/Rθ = f[sin 2 (θ/2) + КС] не менее 4-5 экспериментальных точек в области
(8/3)π 2 ( h 2 )/λ 2 )sin 2 (θ/2) h 2 ]/λ 2 ) 1/2 2 (θ/2) + KC] не менее 4-5 экспериментальных точек в области
(8/3)π2([ h 2 ]/λ 2 )sin 2 (θ/2) > 6,
что реализуется при ([ h 2 ]/λ 2 ) 1/2 > 0,7, т.е. при размерах молекулярных клубков > 250 нм.
4.1.3. Вязкость растворов полимеров
В отличие от коллоидных частиц, форма которых обусловлена способом получения и не изменяется в зависимости от температуры и концентрации дисперсной фазы, форма макромолекул зависит от многих факторов интенсивности межмолекулярного взаимодействия полимерных молекул с растворителем, зависящей от температуры, концентрации полимера в растворе, внутримолекулярных взаимодействий и т.д.
Непосредственно перенести уравнения, полученные для дисперсных систем, на растворы полимеров можно только при соблюдении некоторых условий. В частности, уравнения, описывающие вязкость дисперсных систем, были получены при рассмотрении изменений потока жидкости около индивидуальной частицы, поэтому их можно применять только к разбавленным растворам полимеров, в которых не образуются ассоциаты макромолекул, или экстраполировать измеренные значения вязкости к нулевой концентрации. В этой связи при изучении растворов полимеров часто оперируют с величиной hуд/с = hs, называемой приведенной вязкостью:
где[h] – называют характеристической вязкостью.
Чаще всего рассматривают макромолекулу полимера как жесткую частицу, т.е. предполагают, что внутренние связи в макромолекуле не допускают перемещения отдельных ее частей при течении раствора. Естественно, что макромолекулы могут иметь в растворах самую разнообразную форму: сферы, эллипсоида, стержня и т.п. В растворах часть молекул растворителя прочно связана с макромолекулами и перемещается с ними как единая кинетическая единица.
Для характеристики сольватации макромолекул часто используется величина, выраженная в единицах массы связанного растворителя на единицу массы растворенного вещества, называемая числом сольватации и обозначаемая как Ws. В частном случае, когда в качестве растворителя используется вода, эта характеристика называется числом гидратации, или удельной гидратацией и обозначается как Wh.
При течении раствора полимера свернутые в клубки макромолекулы перемещаются совместно с некоторым количеством растворителя, связанным с макромолекулой силами межмолекулярного взаимодействия. В связи с этим при использовании методов, основанных на явлениях переноса, обычно получают молекулярную массу полимера, отличающуюся от ее истинного значения на массу связанного растворителя. Ее следует учитывать при расчете массы гидродинамической частицы, каковой является молекула полимера в текущем растворе. При таком учете масса одной сольватированной молекулы
Экспериментальное определение числа сольватации Ws обычно представляет собой сложную задачу, так как различные методы позволяют найти лишь ту или иную часть растворителя, связанного с растворенным веществом. Один из наиболее распространенных методов изучения гидратации – вискозиметрия.
При расчетах сольватации из вискозиметрических данных объемную долю растворенного вещества заменяют концентрацией растворенных молекул
где j2– объемная доля растворенного вещества; C– концентрация, г/см 3 , раствора; vef – эффективный объем макромолекул в растворе, совместно с объемом связанного растворителя.
Если выделить некоторый объем V раствора, то он будет состоять из объема, занятого макромолекулами g2v2, объема, занятого связанным растворителем g2Wsv1, и объема, занятого свободным растворителем (g1– g2Ws)v1 0 :
где v2 – удельный объем сухого растворенного полимера; v1, v1 0 – удельный объем связанного и свободного растворителя; g2 – масса растворенного вещества.
Для очень разбавленных растворов, когда Ws уже не зависит от концентрации, можно перейти от объема раствора к парциальному удельному объему 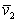
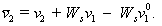
Объем одной сольватированной макромолекулы в растворе
или с учетом (2.4.28)
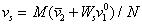
Обычно парциальный удельный объем растворенного вещества находят методом измерения плотности раствора при изменении его концентрации, удельный объем растворителя – как v1=1/r1, объем сольватированной частицы находят по измеренной вязкости, а молекулярную массу полимера измеряют каким-либо независимым методом. После этого можно рассчитать Ws . Для нахождения числа гидратации определяют характеристическую вязкость, записывая уравнение (2.4.21) в форме
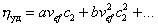
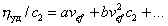
и вводя обозначение аvef =[h]:
Уравнение (2.4.33) называют уравнением Хаггинса, где K’– постоянная Хаггинса, для сферических макромолекул, близкая к 2,0.
Таким образом, после экстраполяции к нулевой концентрации находят характеристическую вязкость [h], размерность которой см 3 /г, и затем рассчитывают сольватацию. Так как
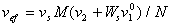
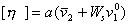
где а = 2,5 для сферических макромолекул.
Если форма макромолекул в растворах сильно отклоняется от сферической, что можно определить по постоянной Хаггинса, то коэффициент формы находят независимым методом, например, по рассеянию света в растворах полимера под различным углом к падающему свету, и только после этого определяют сольватацию.
Существует ряд эмпирических и полуэмпирических формул, которые связывают характеристическую вязкость с молекулярной массой растворенного полимера. На основе этого существует необычайно простой метод определения молекулярной массы полимера по вязкости его разбавленных растворов, требующий предварительной калибровки постоянных расчетного уравнения по значениям молекулярной массы, измеренной предварительно каким-либо независимым методом.
Эмпирическое уравнение, впервые предложенное Марком и Хаувинком (1940 г.), связывающее молекулярную массу и характеристическую вязкость, имеет вид
где K и а – постоянные, зависящие от природы полимера, растворителя и температуры. Постоянная а для гибких макромолекул изменяется в небольших пределах (от 0,5 до 0,8). Жесткие стержнеобразные молекулы имеют а = 1,8.
Молекулярная масса, определяемая вискозиметрическим методом, может быть как среднечисленной, так и среднемассовой, в зависимости от того, каким методом определена молекулярная масса полимера при калибровке постоянных K и а. Более того, если использовать различные методы предварительного определения молекулярной массы, то и постоянные для одного и того же полимера будут различными даже при одной температуре.
Кремнийорганические эмали и краски
обзоры, методики, рецепты
Реологические свойства лакокрасочных материалов
Основным показателем, отражающим реологические свойства лакокрасочных материалов, является вязкость. Значение вязкости определяется коэффициентом пропорциональности в выражении, связывающем напряжение сдвига σ с градиентом скорости сдвига γ:

В системе СИ вязкость выражается в Па*с (1Па*с=10П).
При измерении вязкости задают определенные значения напряжения сдвига и измеряют скорость сдвига (например, скорость течения) или при заданных значениях градиента скорости сдвига определяют напряжение сдвига.
Вязкость прямо пропорциональна σ и обратно пропорциональна γ. В идеальном случае эта зависимость выражается прямой 3 на рис. 10, на котором изображены наиболее часто встречающиеся кривые течения. Жидкости, обладающие таким характером течения, называются ньютоновскими.
Рис. 10. Виды течения жидкостей: 1 — пластическое течение; 2 — псевдопластическое течение; 3—ньютоновское течение; 4 — дилатантное течение.
Реальные жидкости в ту или иную сторону имеют отклонение от идеальности. Некоторые вещества могут течь только при достаточно большой нагрузке и без приложения ее являются по сути дела твердыми телами. При приложении определенного напряжения сдвига начинается течение, т. е. тело разрушается и превращается в жидкость. Такое течение называется пластическим (кривая 1). Обычно в начале течения, т. е. при малых градиентах скорости сдвига, зависимость σ = f(γ) нелинейна и поэтому трудно установить напряжение сдвига, при котором начинается течение.
Поэтому σпр определяют экстраполяцией к нулевому значению у. В некоторых веществах, имеющих внешние признаки пластичных тел, вообще не существует истинного предельного напряжения сдвига. Такие системы называются псевдопластичными, и их реологические кривые в той или иной степени характерны практически для всех пигментированных лакокрасочных материалов.
Приращение вязкости в результате образования связей между структурными элементами называется структурной составляющей вязкости. Псевдопластичные системы, в которых структура после разрушения со временем появляется вновь, называются тиксотропными.
Существует еще один вид течения, который во всех практических системах является нежелательным. Это дилатантное течение (рис. 10, кривая 4), которому свойственно интенсивное увеличение напряжения при увеличении градиента скорости сдвига, что проявляется в повышении вязкости при возрастании скорости деформации.
В лакокрасочных материалах широко используется псевдопластичность и тиксотропность. Возникновение структуры, препятствующей течению при малых напряжениях сдвига, уменьшает оседание пигментов и наполнителей, а также предотвращает образование потеков при нанесении лакокрасочных материалов на вертикальные поверхности.
Независимо от способа придания тиксотропности лакокрасочным материалам на их реологические свойства существенное влияние оказывают растворители. При использовании в качестве тиксотропного средства бентонита или аэросила максимальный эффект достигается после предварительной обработки тиксотропного средства полярным растворителем, например этиловым спиртом.
Тиксотропные алкидные пленкообразователи, полученные при совмещении обычных алкидных смол со специальными полиамидами, максимальный тиксотропный эффект дают в алифатических растворителях. Как видно из рис. 11, добавка более полярных растворителей снижает тиксотропность в ряду:
Алифатические углеводороды > Ароматические углеводороды > > Эфиры > Кетоны > Спирты
Это происходит вследствие того, что тиксотропная структура, образующаяся за счет водородных связей полиамидов, разрушается при их взаимодействии с растворителями, которые также образуют водородные связи. Способность к образованию водородных связей возрастает в приведенном выше ряду растворителей, что согласуется с параметрами растворимости.
Вязкость растворов полимеров является одним из свойств, определяющих их отличие от низкомолекулярных веществ. Даже разбавленные растворы полимеров (до 1 %) имеют аномально высокую вязкость. Для разбавленных растворов зависимость приведенной вязкости от концентрации выражается уравнением Хаггинса:
где k’ — константа Хаггинса — определяет наклон прямой и характеризует взаимодействие полимера с растворителем.
Рис. 11. Влияние растворителей на тиксотропные свойства алкндиополиамидного связующего: 1 —уайт-спирит; 2—толуол; 3—бутилацетат; 4—ацетон; 5—бутиловый спирт.
Характеристическая вязкость зависит от молекулярной массы полимера и его взаимодействия с растворителем, что определяется уравнением Марка—Куна — Хувинка:
Это выражение служит для определения молекулярной массы вискозиметрическим методом. Константы К и а являются постоянными для данной системы полимер — растворитель; α теоретически имеет значения от 0,5 до 1, для реальных систем а = 0,6-0,8. Чем лучше растворитель, тем больше значение а и тем меньше значение К. Следовательно, с улучшением качества растворителя повышается характеристическая вязкость раствора.
При повышении концентрации увеличивается взаимодействие полимер — полимер, что приводит к образованию ассоциатов макромолекул. Поэтому при концентрации более 1 % вязкость начинает быстро расти и линейная зависимость ее от концентрации не сохраняется. Для лакокрасочных материалов, в которых используются концентрированные растворы полимеров (от 10 % и выше), практический интерес представляют закономерности, характерные для концентрированных растворов.
Если в разбавленных растворах элементарными единицами, участвующими в течении, являются клубки макромолекул, то в концентрированных растворах такими элементами служат ассоциаты и надмолекулярные образования. В противоположность разбавленным растворам ухудшение качества растворителя вызывает повышение вязкости за счет укрупнения надмолекулярных образований вследствие увеличения взаимодействия полимер — полимер.
Это усугубляется тем, что при высокой концентрации макромолекулам свойственна более распрямленная форма, обеспечивающая большее взаимодействие их друг с другом.
Взаимодействие цепей макромолекул, которое приводит к образованию надмолекулярных образований, способствующих структурированию растворов, выражается в отклонении от ньютоновского характера течения даже при малой концентрации. Однако в узких диапазонах напряжений сдвига ньютоновское течение сохраняется. При напряжениях сдвига до 10—100 Па у концентрированных растворов полимеров имеет место так называемая наибольшая ньютоновская вязкость.
Увеличение напряжения сдвига до 10 3 —10 4 Па вызывает разрушение структуры растворов; в этом диапазоне вязкость в наибольшей степени зависит от напряжения сдвига. При более высоких значениях напряжения сдвига вязкость вновь перестает зависеть от него — достигается минимальная ньютоновская вязкость. Вязкость концентрированных растворов полимеров в большой мере зависит от природы полимера и растворителя.
Влияние растворителя особенно сильно сказывается в случае растворов жесткоцепных полимеров (если вязкость двух растворителей отличается, например, в несколько раз, то вязкость растворов в этих растворителях при достаточно высоких концентрациях полимера будет отличаться на несколько порядков), в случае же растворов гибкоцепных полимеров оно начинает существенно проявляться при температурах ниже температуры стеклования.
С повышением температуры концентрационные кривые вязкости в разных растворителях сближаются и при температуре выше температуры стеклования полимера вязкости растворов практически отличаются только на значение вязкости растворителя. Вообще вязкость растворов полимеров отчасти зависит от вязкости растворителей: чем выше вязкость растворителя, тем выше вязкость раствора.
Большое влияние на вязкость концентрированных растворов полимеров оказывает термодинамическое сродство растворителя к полимеру. Увеличение взаимодействия полимер — растворитель, т. е. улучшение качества растворителя, повышает гибкость цепей макромолекул, что приводит к уменьшению вязкости раствора. Однако такая зависимость не всегда проявляется. Во-первых, вязкость может быть столь высока, что увеличение гибкости цепи не может ее компенсировать, во-вторых, в концентрированных растворах большую роль играют надмолекулярные образования, характер которых предопределяет реологическое поведение растворов.
Рис. 12. Зависимость вязкости 20%-ных растворов сополимера винилхлорида с винилиденхлоридом от состава бинарного растворителя нитропропантолуол.
Изменение состава бинарных растворителей, которые применяются для лакокрасочных материалов, приводит к изменению вязкости раствора полимера. Было замечено, что добавка плохого растворителя часто вызывает снижение вязкости раствора полимера. Это можно объяснить тремя причинами.
1. Если добавляемый плохой растворитель имеет меньшую вязкость, то снижение вязкости связано со снижением вязкости бинарного растворителя.
2. Снижение вязкости проявляется при улучшении растворяющей способности бинарного растворителя за счет повышения подвижности сегментов макромолекул. Это может наблюдаться, если параметр растворимости полимера лежит между параметрами растворимости хорошего и плохого растворителей. В качестве примера можно привести систему сополимер винилхлорида с винилиденхлоридом в бинарном растворителе нитропропан — толуол. На рис. 12 показано, как добавка толуола (6=18,18) до 40% к нитропропану (6 = 20,2) вызывает снижение вязкости раствора полимера за счет приближения параметра растворимости бинарного растворителя к параметру растворимости сополимера (σ=18,92). Дальнейшее увеличение содержания толуола приводит к гелеобразованию системы.
3. При добавке плохого растворителя надмолекулярные образования из-за ухудшения взаимодействия полимер — растворитель уплотняются подобно клубкам макромолекул в разбавленных растворах полимеров в плохих растворителях, что вызывает падение вязкости
Характер изменения вязкости полимеров в бинарном растворителе зависит от различных факторов, в особенности от концентрации (рис. 13). При концентрации раствора сополимера винилхлорида с винилацетатом 5 % увеличение содержания плохого растворителя толуола приводит к понижению вязкости подобно тому, как это происходит в разбавленных растворах. При концентрации сополимера 10—20 % вязкость растворов проходит через минимальное значение, как это наблюдалось в случае раствора сополимера винилхлорида с винилиденхлоридом в смеси нитропропан — толуол (см. рис. 12). Совершенно иной характер носит зависимость вязкости 25 %-ных растворов от состава растворителя.
Рис. 13. Зависимость вязкости растворов сополимера винилхлорида с винилацетатом разной концентрации от состава бинарного растворителя бутилацетат —толуол.
Рис. 14. Влияние температуры на зависимость вязкости 25%-иых растворов сополимера винилхлорида с винилацетатом от состава бинарного растворителя бутилацетат —толуол.
Характерной особенностью таких систем является резкое снижение вязкости при большом содержании толуола. Это связано с разрушением геля и образованием органодисперсий.
Повышение температуры растворов в некоторой степени эквивалентно снижению концентрации полимера (рис. 14). При температуре 50 0C 25%-ные растворы ведут себя аналогично 10—20 %-ным, а при 70 0C зависимость вязкости от состава растворителя подобна таковой для 5 %-ных растворов.
Таким образом, на вязкость растворов полимеров оказывают влияние состав растворителя, концентрация полимера и температура, причем все эти факторы взаимосвязаны.
Как явствует из диаграммы растворимости сополимера винилхлорида с винилацетатом в смеси метилэтилкетон — толуол (рис. 15), существует переходная зона между растворами и расслаивающимися системами. В этой зоне составы обладают тиксотропными свойствами, что используется для нанесения лакокрасочного материала толстым слоем путем окунания.
Однако такие составы при хранении нестабильны и переходят в прочные необратимые гели, особенно при низких температурах. Если использовать в качестве разбавителей не ароматические углеводороды, имеющие достаточно высокое сродство к сополимеру, а алифатические растворители, например гептан или бензин, можно получить достаточно стабильные тиксотропные составы.
Такие составы представляют собой лиофилизованные органодисперсии полимера, т. е. дисперсии, образованные сильно набухшими частицами полимера. В состоянии покоя такие дисперсии переходят в гель, который легко разрушается при перемешивании (рис. 16). Структура полностью разрушается уже при относительно невысоких градиентах скорости сдвига (457 с -1 ), в то время как при нанесении кистью развиваются градиенты скорости сдвига порядка 10 4 с -1 , а при безвоздушном распылении градиент скорости сдвига может достигать 10 6 с -1 .
При уменьшении содержания хорошего растворителя лиофильность дисперсии снижается и образуются дисперсии переходного типа, занимающие среднее положение между лиофильными и лиофобными. При определенных соотношениях хорошего и плохого растворителей могут быть получены устойчивые органодисперсий, которые предназначены для покрытий, формируемых при высокой температуре, причем их вязкость значительно ниже вязкости растворов того же полимера, Это позволяет изготовлять на основе органодисперсий лакокрасочные материалы с повышенным содержанием нелетучих веществ. На рис. 17 показано изменение вязкости составов на основе сополимера винилхлорида с винилацетатом в зависимости от содержания разбавителя.
Рис. 16. Зависимость вязкости раствора частично омыленного сополимера винилхлорида с винйлацетатом От состава бинарного растворителя бутилацетат — гексан при различных градиентах скорости сдвига.
Рис. 17. Зависимость вязкости органодисперсий сополимера винилхлорида с винйлацетатом от содержания разбавителя гептана в его смеси с бутилацетатом.
При содержании гептана 60 % вязкость органодисперсий отличается от вязкости раствора в бутилацетате на 3 порядка. На рис. 18 представлена диаграмма изменения вязкости в зависимости от состава бинарного растворителя.
Рис. 18. Схематическая диаграмма изменения вязкости системы полимер — растворитель — разбавитель.
Диаграмма разделена на три зоны. В зоне 1 преобладает растворитель, что позволяет получать растворы; в этой зоне при увеличении содержания разбавителя возможно некоторое снижение вязкости. В зоне II образуется гель, который при разрушении переходит в лиофильную органодисперсию. В этой зоне вязкость сильно зависит от градиента скорости сдвига — составы псевдопластичны и тиксотропны. Вязкость проходит через максимальное значение и в дальнейшем при увеличении содержания разбавителя лиофильность дисперсии уменьшается, что вызывает падение вязкости, вплоть до образования устойчивых органодисперсий переходного типа. При высоком содержании разбавителя в зоне III устойчивость дисперсий уменьшается, что приводит к быстрому расслоению.
http://xumuk.ru/colloidchem/128.html
http://www.emalko.ru/reologicheskie-svojstva-lakokrasochny-h-materialov/